群體感應分子法尼醇與白念珠菌和宿主相互作用機制研究進展
方陽欣, 唐建國
白念珠菌(Candida albicans)是人類中定植于消化道、泌尿生殖道和皮膚黏膜上最常見的機會性致病真菌之一[1]。一旦機體免疫功能減退,白念珠菌會大量繁殖并改變形態結構,侵入機體引起疾病。白念珠菌的雙相性轉換,尤其是由酵母相向菌絲相的轉換,在其致病性中發揮著關鍵作用[2]。除了許多環境因素,如溫度、二氧化碳濃度以及酸堿度等可觸發白念珠菌的形態轉換,白念珠菌自身產生的群體感應分子(quorum sensing molecule)也可調控菌體的形態[1,3]。法尼醇(farnesol)是第1個在白念珠菌中發現的群體感應分子,其功能有調控白念珠菌的雙相性相互轉換(morphology)、影響生物膜(biofilm)的生成和調節宿主免疫等[4-6]。因此,本文就法尼醇與白念珠菌、宿主免疫的相互關系作一綜述。
1 法尼醇影響白念珠菌雙相性互相轉換
法尼醇是在白念珠菌中第1個被發現可調節菌絲生長的群體感應分子。大量研究表明,在菌株密度<106cfu/mL,白念珠菌主要向菌絲形式發展,反之在密度≥106cfu/mL,則主要以酵母為生長方式,這種現象受法尼醇控制[3]。法尼醇主要抑制酵母相向菌絲相的轉換,不改變已生成菌絲的細胞生長率,然而對其在菌絲相轉換為酵母相的過程中以及維持菌絲的生長中所產生的影響知之甚少。此外,法尼醇產生作用的過程中存在劑量、介質和時間依賴性,與劑量成正相關,與時間成負相關[7]。目前,有研究發現法尼醇在瓊脂包埋和液體介質的條件下促進菌絲相向芽孢相的轉換,尤其是處理芽孢6 h后形成的菌絲,并且與溫度成負相關,但是誘導該轉換發生的速度慢于菌絲的萌發[8],該過程的發生所涉及的分子機制尚未明確。
法尼醇抑制白念珠菌的雙相性轉換涉及一系列的因子,如Tup1、Nrg1、Ras1、Cyr1、Efg1、Cek1和Chk1。Tup1是一種轉錄抑制因子,與轉錄遏制子Ssn6 或Tcc1一起抑制基因的表達[9]。Kebaara等[10]研究發現Tup1和轉錄調節因子,即DNA結合蛋白Nrg1和Rfg1共同抑制菌絲特異性基因(HWP1和RBT1)的表達,法尼醇增加TUP1mRNA表達以及蛋白質的合成。Lu等[11]研究發現菌絲形成可通過Sok1激酶介導Nrg1蛋白質降解,法尼醇主要通過抑制SOK1的表達進而抑制Nrg1蛋白質的降解,該過程主要通過抑制由N端規則E3泛素連接酶Ubr1介導的轉錄抑制因子Cup9的降解所產生(圖1)。
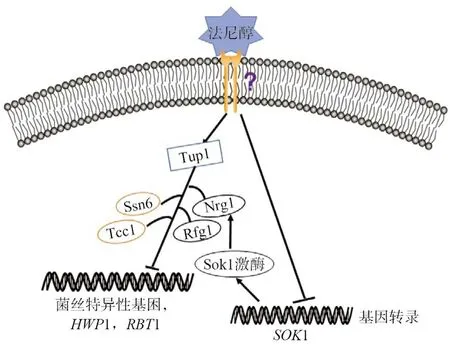
圖1 法尼醇調控白念珠菌菌絲形成轉錄因子
法尼醇可調控白念珠菌酵母和菌絲絲狀生長中涉及信號通路中的關鍵酶[12]。酵母至絲狀形式的轉化可經許多途徑激活,包括Ras/cAMP依賴性途徑,CEK1促分裂原活化蛋白激酶(MAPK)途徑和Chk1雙組分信號轉導途徑[13]。法尼醇抑制Ras1-Cyr1(Cdc35)-cAMP-PKA-Efg1信號通路,由此抑制芽孢和菌絲的轉換、生物膜的形成和應激反應基因,如表達過氧化氫酶的CTA1[14-16]。白念珠菌Ras1定位于質膜,在GTP結合模式時和Cyr1相互作用,增加cAMP的生成從而促進酵母相轉化為菌絲相,法尼醇可直接抑制Cyr1和改變Ras1蛋白質中與法尼醇和法尼基相似性結構。由此得出,法尼醇可干擾Ras1翻譯后修飾或法尼基化的Ras1與膜的相互作用[14]。研究表明法尼醇在生物相關濃度下不改變Ras1質膜定位,但是抑制了由細胞質中的Ras1突變體靶向介導的菌絲誘導[17]。目前有研究發現完整的Ras1在菌絲中含量更高,并且裂解的Ras1抑制菌絲生長,Ras1的裂解受Ras1-cAMP通路所抑制,兩者之間存在一個正反饋環路,法尼醇抑制Cyr1的活性,從而使裂解的Ras1增多,抑制菌絲的生成[18]。有研究證明法尼醇對于該條信號通路中的cAMP的磷酸二酯酶Pde1和Pde2無影響,升高cAMP反應性轉錄因子CTA1和HSP12mRNA的含量水平,減少HWP1mRNA的含量,同時這一抑制過程可以被二丁酰基-cAMP(db-cAMP)所逆轉[16]。Czf1白念珠菌鋅指轉錄調節因子可以誘導白念珠菌的菌絲生長,CZF1的表達受Ras1-cAMP激活的轉錄因子Efg1調節,此外,Czf1和Efg1對于白念珠菌的雙相性轉換具有相互拮抗作用[19]。Langford等[20]研究發現Czf1是法尼醇發揮作用的一個重要下游效應因子,并且與Efg1一起參與白念珠菌中的法尼醇介導細胞死亡的控制,但是CZF1mRNA水平不受法尼醇的調節,同時發現PKA的亞型Tpk1受法尼醇的調節,進而抑制菌絲生長。cAMP-PKA信號通路還可下調主要的菌絲形成抑制因子NRG1以及轉錄抑制因子TUP1的表達,增加菌絲的生成。細胞周期蛋白可以調控白念珠菌的雙相性生長,G1期的細胞周期蛋白依賴性激酶(CDK)和G2期CDK分別產生細胞的極性生長和各向同性生長[21]。Hgc1是G1細胞周期蛋白相關蛋白,并與CDK CaCdc28共沉淀。有研究發現在菌絲形成的誘導條件下HGC1高度表達,只在細胞周期G1期發揮作用,即促進細胞的極性生長,法尼醇則抑制HGC1的表達,即抑制菌絲的生長,菌絲誘導信號通過cAMP-PKA途徑和其下游轉錄因子Efg1激活HGC1表達,在酵母細胞中,HGC1被Tup1-Nrg1阻遏物復合物抑制,然而,有絲分裂原活化蛋白激酶(MAPK)途徑和其效應轉錄因子Cph1不參與[22]。Carlisle等[23]證明HGC1在菌絲誘導后立即被激活,而Ume6不參與HGC1表達的初始激活,維持HGC1的表達必不可少。Banerjee等[24]研究發現Efg1和Sun4在Ume6誘導白念珠菌某些絲特異性轉錄物的能力中起重要作用。此外,Cek1MAPK介導的通路影響白念珠菌菌絲的產生,該條通路中主要由Hst7MAPKK、跨膜蛋白Sho1及其下游信號分子組成[25-26]。MAP激酶通過調節一般氨基酸通透酶(GAP1)表達影響菌絲的生長,該過程可以被法尼醇所抑制[27]。研究證明法尼醇還可通過降低HST7和CPH1 mRNA的表達水平來抑制MAP激酶的活性。然而,MAP激酶不影響ALS家族、HYR1和HWP1這些菌絲特異性mRNAs的表達[28]。法尼醇還可抑制Cek1磷酸化,這一過程依賴于Sho1跨膜蛋白而不依賴于Chk1途徑(圖2)[25]。
2 法尼醇抑制白念珠菌生物膜的形成
生物被膜定義為一種由互利共生的微生物復合體組成,體內外均可形成表面關聯的、封閉在自身產生的保護性胞外基質中的高度結構化群落,具有保護菌體、抵抗物理和化學不利因素、協同菌體代謝以及參與菌落的基因表達調控等特性[29]。
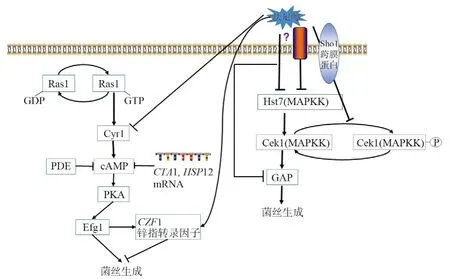
圖2 法尼醇調控白念珠菌菌絲生成信號通路
白念珠菌成熟的生物膜是由細胞外基質包圍的酵母、菌絲和假菌體組成的結構化群落,其形成的特征主要分為6個階段,分別是酵母細胞的初始黏附(0~2 h);萌發和微集落形成(2~4 h);細絲化,即白念珠菌的雙相性轉換,從芽殖酵母形式到絲狀真菌形式的轉變,中間過程是細絲、假菌絲直至形成菌絲(4~6 h);單層發展(6~8 h);與相鄰酵母形成的菌絲編織形成網絡結構,增殖(8~24 h);三維空間結構的形成和成熟(24~48 h)[1]。法尼醇是抑制白念珠菌生物膜形成的主要因素之一。研究指出法尼醇抑制生物膜的形成具有劑量依賴性,但是法尼醇只在白念珠菌菌絲形成之前發揮作用,下調編碼菌絲特有的細胞壁HWP1的表達[30]。Cao等[31]研究發現法尼醇通過調節多種基因的表達,從而達到抑制生物膜形成的目的,如菌絲形成基因、細胞膜形成基因、維持細胞壁相關作用的基因、鐵轉運基因、編碼熱休克蛋白的數種基因以及細胞疏水性基因和生物膜形成后高表達的耐藥性基因。近年來有研究表明,從食用地衣分離的膳食類黃酮槲皮素可以作為致敏劑提高氟康唑抗白念珠菌的效力,并且這種致敏作用依賴于槲皮素產生的法尼醇效應[32]。很多體外研究數據表明,氟康唑和法尼醇具有協同抗生物膜形成的作用,生物膜的結構變化取決于兩者的聯合效應,其最大聯合效應取決于法尼醇的濃度[33],而Bozo等[34]研究發現基于用局部抑制濃度指數評價,氟康唑和法尼醇的協同作用只存在于SC5314菌株,其余的無論是對于氟康唑敏感或者抵抗的菌株,兩者的協同作用均未明確。
3 法尼醇與宿主免疫系統的相互作用
法尼醇是白念珠菌自分泌的形態調節劑,抑制白念珠菌轉換至菌絲致病相,但是它在哺乳動物體內成為白念珠菌致病性的一種毒力因子,增加白念珠菌的播散性。Navarathna等[35]第1次發現通過敲除菌株內編碼將法尼基焦磷酸轉化為法尼醇磷酸酶的DPP3基因,從而減少白念珠菌自身產生法尼醇,并將該菌株接種至小鼠體內,菌株引起的小鼠死亡率明顯降低。他們通過口服、腹腔注射等方式給予法尼醇至小鼠體內,發現法尼醇會加速感染白念珠菌小鼠的死亡,并證明該現象可能與增加白念珠菌在腎臟的定植有關。
在抵御系統性白念珠菌病的過程中,宿主體內早期的固有免疫發揮著重要作用,單核細胞和巨噬細胞通過吞噬作用和氧化或者非氧化機制破壞白念珠菌的菌絲和酵母。在適應性免疫應答過程中,巨噬細胞、T細胞及其分泌的細胞因子限制白念珠菌在宿主體內進行播散。Navarathna等[36]發現法尼醇以腹腔內注射的方式給予感染白念珠菌的小鼠,抑制輔助性T1(Th1)細胞產生干擾素(IFN)-γ和白細胞介素(IL)-12,減少巨噬細胞產生IL-12 p40和p70,增加Th2細胞產生IL-5,而腫瘤壞死因子α(TNF-α)無變化。在細胞水平的實驗中證明[37],法尼醇主要誘導巨噬細胞內的氧化應激反應,使得胞內DNA片段斷裂,可能參與細胞的凋亡從而抑制巨噬細胞的吞噬等抗白念珠菌感染的功能,該氧化應激反應可以被普羅考布和維生素E等抗氧化劑阻斷。近年來,有研究發現法尼醇可刺激巨噬細胞的隨意趨化性運動并且增加宿主體內巨噬細胞的腹膜浸潤[38],然而白念珠菌被巨噬細胞吞噬3~6 h后,通過形成穿透巨噬細胞質膜的菌絲殺死巨噬細胞,從而產生免疫逃逸[39]。至于其他固有免疫細胞,Leonhardt等[39]研究發現法尼醇通過以下方面影響細胞的功能,從而減少機體對于白念珠菌的吞噬以及清除,①法尼醇增加單核細胞(CD86和HLA-DR)和中性粒細胞(CD66b和CD11b)表面的活化標志物的表達,并促進氧化應激暴發和促炎細胞因子[TNF-α、巨噬細胞炎癥蛋白1α(MIP-1α)]的釋放,但是該作用并不增加細胞攝取或殺死白念珠菌。②高濃度法尼醇阻斷單核細胞分化為未成熟的樹突狀細胞(iDC),尤其降低幾種對細胞成熟和抗原呈遞有重要作用的標志物如CD1a、CD83、CD86和CD80的表達。③法尼醇影響樹突狀細胞多種炎性因子的釋放、限制細胞的遷移和阻止細胞進行抗原呈遞,從而限制Th1細胞的免疫應答,這些過程可能均由于iDC對于粒細胞-巨噬細胞集落刺激因子(GM-CSF)的低水平應答并表現出單核細胞的特性。
4 小結與展望
法尼醇調控白念珠菌的形態轉換,有助于深入了解白念珠菌的信號傳遞。近10年深入研究了法尼醇作用于白念珠菌形態轉換相關信號通路中的下游關鍵分子,但是法尼醇作用的上游信號分子和具體胞膜或者質膜受體及其他結合部位尚需進一步明確。法尼醇在宿主體內可能成為白念珠菌的一種致病因子,其對于宿主免疫細胞的氧化應激和誘導凋亡作用機制尚未明確,有待進一步在體內外研究法尼醇與免疫細胞相互作用及其具體機制。研究證實法尼醇的同分異構體在抑制白念珠菌雙相性的轉換及生物膜的形成等作用中,雖然效力很低但不會成為致病因子,那么深入研究法尼醇的同分異構體將有望開發新型抗白念珠菌的藥物或者輔助用藥,減少耐藥白念珠菌的產生。
[1] RAMAGE G, VANDEWALLE K, WICKES BL, et al.Characteristics of biofilm formation byCandida albicans[J].Rev Iberoam Micol, 2001, 18(4): 163-170.
[2] YAPAR N. Epidemiology and risk factors for invasive candidiasis[J]. Ther Clin Risk Management, 2014, 10(default): 95.
[3] HORNBY JM, JENSEN E C, LISEC AD, et al. Quorum sensing in the dimorphic fungusCandida albicansis mediated by farnesol [J]. Appl Environ Microbiol, 2001, 67(7): 2982-2992.
[4] ALBUQUERQUE P, CASADEVALL A. Quorum sensing in fungi – a review [J]. Med Mycol, 2012, 50(4): 337-345.
[5] WONGSUK T, PUMEESAT P, LUPLERTLOP N. Fungal quorum sensing molecules: role in fungal morphogenesis and pathogenicity [J]. J Basic Microbiol, 2016, 56(5): 440-447.
[6] ALLISON DL, WILLEMS HM, JAYATILAKE JA, et al.Candida-bacteria interactions: their impact on human disease [J].Microbiol Spectr, 2016, 4(3).
[7] MOSEL DD, DUMITRU R, HORNBY JM, et al. Farnesol concentrations required to block germ tube formation inCandida albicansin the presence and absence of serum [J]. Appl Environ Microbiol, 2005, 71(8): 4938-4940.
[8] LINDSAY AK, DEVEAU A, PIISPANEN AE, et al. Farnesol and cyclic AMP signaling effects on the hypha-to-yeast transition inCandida albicans[J]. Eukaryot Cell, 2012, 11(10): 1219-1225.
[9] KANEKO A, UMEYAMA T, UTENA-ABE Y, et al. Tcc1p,a novel protein containing the tetratricopeptide repeat motif,interacts with Tup1p to regulate morphological transition and virulence inCandida albicans[J]. Eukaryotic Cell, 2006, 5(11): 1894-1905.
[10] KEBAARA BW, LANGFORD ML, NAVARATHNA DH,et al.Candida albicansTup1 is involved in farnesol-mediated inhibition of filamentous-growth induction [J]. Eukaryot Cell,2008, 7(6): 980-987.
[11] LU Y, SU C, UNOJE O, et al. Quorum sensing controls hyphal initiation inCandida albicansthrough Ubr1-mediated protein degradation [J]. Proc Natl Acad Sci USA, 2014, 111(5):1975-1980.
[12] POLKE M, SPRENGER M, SCHERLACH K, et al. A functional link between hyphal maintenance and quorum sensing inCandida albicans[J]. Mol Microbiol, 2017, 103(4): 595-617.
[13] KRUPPA M, KROM BP, CHAUHAN N, et al. The twocomponent signal transduction protein Chk1p regulates quorum sensing inCandida albicans[J]. Eukaryot Cell, 2004, 3(4):1062-1065.
[14] HALL RA, TURNER KJ, CHALOUPKA J, et al. The quorumsensing molecules farnesol/homoserine lactone and dodecanol operate via distinct modes of action inCandida albicans[J].Eukaryot Cell, 2011, 10(8): 1034-1042.
[15] DEVEAU A, PIISPANEN AE, JACKSON AA, et al. Farnesol induces hydrogen peroxide resistance inCandida albicansyeast by inhibiting the ras-cyclic AMP signaling pathway [J].Eukaryotic Cell, 2010, 9(4): 569-577.
[16] DAVIS-HANNA A, PIISPANEN AE, STATEVA LI, et al.Farnesol and dodecanol effects on theCandida albicansRas1-cAMP signalling pathway and the regulation of morphogenesis[J]. Mol Microbiol, 2008, 67(1): 47-62.
[17] PIISPANEN AE, BONNEFOI O, CARDEN S, et al. Roles of Ras1 membrane localization duringCandida albicanshyphal growth and farnesol response [J]. Eukaryot Cell, 2011, 10(11):1473-1484.
[18] PIISPANEN AE, GRAHL N, HOLLOMON JM, et al.Regulated proteolysis ofCandida albicansRas1 is involved in morphogenesis and quorum sensing regulation [J]. Mol Microbiol, 2013, 89(1): 166-178.
[19] ZORDAN RE, GALGOCZY DJ, JOHNSON AD. Epigenetic properties of white-opaque switching inCandida albicansare based on a self-sustaining transcriptional feedback loop [J]. Proc Natl Acad Sci USA, 2006, 103(34): 12807-12812.
[20] LANGFORD ML, HARGARTEN JC, PATEFIELD KD, et al.Candida albicansCzf1 and Efg1 coordinate the response to farnesol during quorum sensing, white-opaque thermal dimorphism, and cell death [J]. Eukaryot Cell, 2013, 12(9):1281-1292.
[21] MOSELEY JB, NURSE P. Cdk1 and cell morphology :connections and directions [J]. Current Opini Cell Biol, 2009,21(1): 82-88.
[22] ZHENG X, WANG Y, WANG Y. Hgc1, a novel hypha-specific G1 cyclin-related protein regulatesCandida albicanshyphal morphogenesis [J]. EMBO J, 2004, 23(8): 1845-1856.
[23] CARLISLE PL, KADOSH D.Candida albicansUme6, a filament-specific transcriptional regulator, directs hyphal growth via a pathway involving Hgc1 cyclin-related protein [J].Eukaryotic Cell, 2010, 9(9): 1320-1328.
[24] BANERJEE M, UPPULURI P, ZHAO XR, et al. Expression of UME6, a key regulator ofCandida albicanshyphal development, enhances biofilm formation via Hgc1- and Sun41-dependent mechanisms [J]. Eukaryot Cell, 2013, 12(2): 224-232.
[25] ROMáN E, ALONSO-MONGE R, GONG Q, et al. The Cek1 MAPK is a short-lived protein regulated by quorum sensing in the fungal pathogenCandida albicans[J]. FEMS Yeast Res,2009, 9(6): 942-955.
[26] BROWN AJ, BUDGE S, KALORITI D, et al. Stress adaptation in a pathogenic fungus [J]. J Exp Biol, 2014, 217(Pt 1): 144.
[27] BISWAS S, ROY M, DATTA A. N-acetylglucosamine-inducible CaGAP1 encodes a general amino acid permease which coordinates external nitrogen source response and morphogenesis inCandida albicans[J]. Microbiology, 2003, 149(Pt 9):2597-2608.
[28] SATO T, WATANABE T, MIKAMI T, et al. Farnesol, a morphogenetic autoregulatory substance in the dimorphic fungusCandida albicans, inhibits hyphae growth through suppression of a mitogen-activated protein kinase cascade [J]. Biol Pharm Bull, 2004, 27(5): 751-752.
[29] DEVEAU A, HOGAN DA. Linking quorum sensing regulation and biofilm formation byCandida albicans[J]. Methods Mol Biol, 2011, 692 :219-633.
[30] RAMAGE G, SAVILLE SP, WICKES BL, et al. Inhibition ofCandida albicansbiofilm formation by farnesol, a quorumsensing molecule [J]. Appl Environ Microbiol, 2002, 68(11):5459-5463.
[31] CAO YY, CAO YB, XU Z, et al. cDNA microarray analysis of differential gene expression inCandida albicansbiofilm exposed to farnesol [J]. Antimicrob Agents Chemother, 2005, 49(2):584-589.
[32] SINGH BN, UPRETI DK, SINGH BR, et al. Quercetin sensitizes fluconazole-resistantCandida albicansto induce apoptotic cell death by modulating quorum sensing [J].Antimicrob Agents Chemother, 2015, 59(4): 2153-2168.
[33] KATRAGKOU A, MCCARTHY M, ALEXANDER EL,et al.In vitrointeractions between farnesol and fluconazole,amphotericin B or micafungin againstCandida albicansbiofilms[J]. J Antimicrob Chemother, 2015, 70(2): 470-478.
[34] BOZO A, DOMAN M, MAJOROS L, et al. Thein vitroandin vivoefficacy of fluconazole in combination with farnesol againstCandida albicansisolates using a murine vulvovaginitis model[J]. J Microbiol, 2016, 54(11): 753-760.
[35] NAVARATHNA DH, HORNBY JM, KRISHNAN N, et al.Effect of farnesol on a mouse model of systemic candidiasis,determined by use of a DPP3 knockout mutant ofCandida albicans[J]. Infect Immun, 2007, 75(4): 1609-1618.
[36] NAVARATHNA DH, NICKERSON KW, DUHAMEL GE, et al. Exogenous farnesol interferes with the normal progression of cytokine expression during candidiasis in a mouse model [J].Infect Immun, 2007, 75(8): 4006-4011.
[37] ABE S, TSUNASHIMA R, IIJIMA R, et al. Suppression of anti-Candidaactivity of macrophages by a quorum-sensing molecule, farnesol, through induction of oxidative stress [J].Microbiol Immunol, 2009, 53(6): 323-330.
[38] HARGARTEN JC, MOORE TC, PETRO TM, et al.Candida albicansquorum sensing molecules stimulate mouse macrophage migration [J]. Infect Immun, 2015, 83(10): 3857-3864.
[39] LEONHARDT I, SPIELBERG S, WEBER M, et al. The fungal quorum-sensing molecule farnesol activates innate immune cells but suppresses cellular adaptive immunity [J]. MBio, 2015, 6(2): e00143.

