長期使用質子泵抑制劑對老年胃食管反流病患者腸道菌群的影響
何海濤,丁西平,王金平,李燁
(1安徽醫科大學附屬省立醫院,合肥230032;2廬江縣人民醫院;3廬江縣中醫院)
胃食管反流病(GERD)是常見的消化系統疾病,其發病率有逐漸增高趨勢[1],且隨年齡增加其患病率也上升。2014年中國GERD專家共識意見指出,質子泵抑制劑(PPIs)是治療GERD的首選藥物,療程應至少維持8周以上。長期應用PPIs抑制胃酸分泌,可導致胃酸屏障功能降低,引起胃內細菌定植和腸道菌群紊亂。目前,長期使用PPIs對老年患者腸道菌群的影響尚無充分的臨床及基礎研究。2016年1月~2017年1月,我們使用實時熒光定量聚合酶鏈反應(PCR)分析了43例老年GERD患者長期使用PPIs后腸道菌群的變化。現報告如下。
1 資料與方法
1.1 臨床資料 收集廬江縣人民醫院及安徽省立醫院長期服用PPIs的老年GERD患者。納入標準:①年齡≥60歲;②使用PPIs超過6個月;③BMI<24;④入選前3個月內未使用過任何抗生素及益生菌、益生元;⑤大便常規正常,無腹瀉、腹脹等腸道菌群紊亂表現。排除標準:①GERD以外的其他急慢性胃腸道疾病;②急慢性感染;③合并內分泌系統疾病(糖尿病及肥胖等);④伴有嚴重心腦血管病或全身感染性疾病或臟器功能衰竭等。共選取患者43例(研究組),男32例、女11例,年齡(74.2±8.2)歲,基礎疾病為高血壓26例、冠心病15例、腦梗死13例、慢性阻塞性肺疾病9例;選擇同時期無GERD的老年患者35例(對照組),男25例、女10例,年齡(74.8±9.2),基礎疾病為高血壓19例、冠心病12例、腦梗死15例、慢性阻塞性肺疾病7例。兩組性別、年齡、基礎疾病具有可比性。研究組根據數字表隨機分為治療組及觀察組,治療組21例予以PPIs及雙歧桿菌三聯活菌膠囊(申信宜)口服1個月,觀察組22例僅繼續口服PPIs。本研究經醫院醫學倫理委員會批準,患者均簽署知情同意書。
1.2 腸道菌群觀察方法 ①標本采集:兩組納入后及研究組1個月后均留取中段大便1次(2 g以上),使用無菌凍存管儲存,半小時內放入-80 ℃冰箱凍存。②大便標本DNA提取:取0.3 g大便,用細菌基因組DNA提取試劑盒(北京天根生化科技有限公司)提取大便細菌DNA,放入-80 ℃冰箱內凍存。③引物設計與合成:參照相關文獻及報道,通過GenBank數據庫比對不同引物的代表性和特異性,篩選出特異性強的引物,由上海生工生物公司合成,引物信息詳見表1。④DNA定量分析:將提取的DNA分別進行7種細菌的16 S rDNA熒光定量PCR,每次實驗同時設標準品校正和ddH2O代替DNA模板的陰性對照,每個樣品均同時做2個平行復孔。反應完畢后根據曲線分析PCR產物的特異性。⑤反應體系及擴增條件:優化反應體系及擴增條件,進行SYBR Green為熒光染料的實時定量PCR;根據讀取的熒光數據,由系統軟件自動分析循環閾值(Ct),并生成標準曲線。菌群數量用log拷貝數/濕便重(g)表示。

表1 腸道7種目標菌群的特異性引物序列
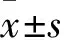
2 結果
2.1 PPIs對老年GRED患者腸道菌群的影響 與對照組比較,研究組大便中雙歧桿菌及乳酸桿菌數量減少(P均<0.05),而葡萄球菌數量增加(P<0.01);腸桿菌、腸球菌、大腸埃希菌及產氣莢膜梭菌組間差異無統計學意義。按年齡層分析顯示,研究組60~69歲者大便中雙歧桿菌及乳酸桿菌數量減少(P均<0.05),而葡萄球菌數量增加(P<0.05);70~79歲者大便中雙歧桿菌及乳酸桿菌數量明顯減少(P均<0.05);≥80歲者大便中雙歧桿菌及乳酸桿菌數量減少(P均<0.05),而葡萄球菌及大腸埃希菌的數量增加(P均<0.05)。見表2。
2.2 雙歧桿菌對長期服用PPIs老年GRED患者腸道菌群的影響 治療組1個月后大便中雙歧桿菌及乳酸桿菌數量增加(P均<0.01),而大腸埃希菌及葡萄球菌數量減少(P均<0.05)。見表3。
3 討論
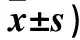
表2 PPIs對老年GRED患者腸道菌群定量的影響(logN/g濕便,
注:與對照組比較,*P<0.05,#P<0.01。
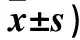
表3 雙歧桿菌對長期服用PPIs老年GRED患者腸道菌群定量的影響(logN/g濕便,
注:與本組基線比較,*P<0.05,#P<0.01;與對照組同時點比較,△P<0.05,○P<0.01。
PPIs自上世紀80年代開始應用臨床以來,顯著地改善了胃酸分泌過多相關性胃疾病的臨床癥狀,對酸相關性胃疾病的治療具有重要意義。臨床上一直以來認為,PPIs具有良好的療效和安全性,其應用范圍不斷擴大;但是,近年來PPIs過度使用,包括超適應證、超劑量、超療程等問題日益突出,其長期使用對人體的不利影響逐步受到重視[2]。
PPIs是老年人的常用藥物之一,老年患者常多病共存及多重用藥,藥物間相互作用、相互影響導致藥物的不良反應發生率也相應升高。因此,老年患者如何合理安全應用PPIs也尤為重要。腸道菌群是由定居在腸道的微生物構成,腸道微生物數量龐大,根據其對人體的作用可以分為有益菌、有害菌和中性菌。在正常情況下,腸道菌群保持著相對穩定的狀態;有益菌占總菌群總量約90%,包括雙歧桿菌、乳酸桿菌、擬桿菌屬等;這些復雜的微生物系統共同組成了一個超級生物體,主要作用包括營養與物質代謝、免疫調節和生物屏障等[3]。細菌、宿主和環境三者之間相互依存、制約與影響,如三者之間平衡被打破則容易導致相關疾病發生[4]。研究[5,6]發現,老年人的腸道定植抗力下降,容易發生腸道菌群的失調;而PPIs可降低胃酸對外源性細菌的防御作用,導致外源性致病菌容易侵襲并定植在人體腸道內,影響老年人腸道正常菌群的繁殖和生長;改變老年人腸道菌群的穩態,增加感染機會。因此,務必要重視老年患者長期應用PPIs后腸道菌群變化及干預措施。
本研究通過對長期使用PPIs老年患者的腸道菌群進行定量檢測,結果顯示長期使用PPIs的老年患者腸道雙歧桿菌及乳酸桿菌數量較對照組減少,而葡萄球菌數量增加;與Imhann等[7]研究結果一致;提示長期使用PPIs可導致老年患者的腸道菌群紊亂,主要表現為有益菌數量減少而有害菌數量增加。因此,老年人腸道菌群紊亂可導致腸道炎癥性疾病及肺部、腹部炎癥性疾病等多種慢性炎癥及疾病。對于PPIs引起老年患者腸道菌群失調,其原因可能包括:首先,胃內強酸環境不適合病原微生物乃至絕大多數微生物的生存,且老年人的胃酸分泌并不會隨著年齡的增長而降低;長期應用PPIs持續抑制胃酸分泌,導致胃內pH值明顯升高、胃酸屏障功能降低,可引起胃內細菌定植和腸道菌群過度生長[8]。Bavishi等[9]認為,應用PPIs后引起的嚴重低胃酸可導致胃內定植細菌增多,腸道有害菌易感性風險增加;同時,消化道與外界相通,必然與大量病原微生物接觸,易引起腸道菌群易位,增加腸道感染的風險[5]。其次,胃酸減少及胃內pH值明顯升高,繼之胃蛋白酶原激活下降以及胰液、膽汁、腸液的分泌減少,導致腸道中未被吸收的營養物質,尤其是蛋白質類增加,為腸道有害細菌提供氮源促進其生長,影響老年人腸道菌群的穩態[10]。老年患者各年齡段分析結果與老年患者整體情況一致,長期使用PPIs可引起各年齡段老年患者腸道菌群失調;提示在老年各年齡段使用PPIs均應該提高警惕。腸道菌群失調主要表現為腸道中雙歧桿菌及乳酸桿菌數量明顯下降,而在≥80歲的患者糞便中葡萄球菌及大腸埃希菌的數量明顯增加;提示長期應用PPIs的高齡患者腸道菌群失調較80歲以下老年患者嚴重,可能與高齡患者腸道蠕動減少、腸道慢性炎癥及腸道衰老有關。因此,對于高齡患者長期應用PPIs應慎重,并注意警惕腸道菌群紊亂引起的相關臨床癥狀。
Sheu等[11]認為,在三聯抗幽門螺桿菌時使用抗生素及PPIs同時補充乳酸桿菌和雙歧桿菌,可改善抗生素和PPIs的應用對胃腸道菌群的影響;并且,益生菌制劑對預防和治療老年重癥肺部感染中抗生素相關性腹瀉具有明顯療效[12]。腸道益生菌影響腸道微生物主要通過以下方面:增加腸道免疫力,促進腸上皮細胞分泌參與腸道的防御屏障,直接抑制腸道致病菌的侵襲[13];造成厭氧菌生長的微環境,促進厭氧菌的生長;產生抗菌物質,對大腸埃希菌、鏈球菌、難辨梭菌和沙門菌等多種致病菌發揮抑制作用[14]。乳酸桿菌屬及雙歧桿菌屬均是促進人類腸道健康的重要菌群。有研究[15]顯示,雙歧桿菌及乳酸桿菌減少可增高腸道的通透性,腸道通透性增高可使水、鈉吸收減少產生腹瀉;同時還能夠抑制大腸桿菌以及金黃色葡萄球菌等致病菌的生長,起到調節腸道菌群失調的作用。本研究中,治療組服用PPIs同時予以雙歧桿菌三聯活菌膠囊,1個月后腸道大便雙歧桿菌及乳酸桿菌數量增加,而大腸埃希菌及葡萄球菌數量減少,而觀察組腸道菌群無明顯變化;提示補充雙歧桿菌三聯活菌可明顯改善患者腸道菌群,糾正PPIs對老年患者腸道菌群的影響。因此,對于需要長期服用PPIs的老年患者,可考慮同時予以補充腸道益生菌。
老年患者長期使用PPIs易導致腸道菌群紊亂,對存在慢性基礎疾病的老年患者,應權衡長期PPIs治療的獲益和風險;對患有腸道功能紊亂及腸道感染的老年患者,應嚴格控制PPIs治療的適應證。對必須長期使用PPIs的老年患者,在經濟條件允許的情況下可考慮聯合使用腸道微生態制劑。但是,何時使用何種腸道微生態制劑對調節腸道菌群失調最為有效,仍需進一步研究。
:
[1] Bredenoord AJ, Pandolfino JE, Smout AJ. Gastro-oesophageal reflux disease[J]. Lancet, 2013,381(9881):1933-1942.
[2] Masclee GM, Sturkenboom MC, Kuipers EJ. A benefit-risk assessment of the use of proton pump inhibitors in the elderly[J]. Drugs Aging, 2014,31(4):263-282.
[3] 張泉,朱蓉,趙逵.幽門螺桿菌感染及腸道菌群失調與結直腸癌發病關系的研究進展[J].山東醫藥,2017,57(25):101-103.
[4] Rooks MG, Garrett WS. Gut microbiota, metabolites and host immunity[J]. Nat Rev Immunol, 2016,16(6):341-352.
[5] Williams C, McColl KE. Review article: proton pump inhibitors and bacterial overgrowth[J]. Aliment Pharmacol Ther, 2006,23(1):3-10.
[6] Mandar R, Mikelsaar M. Transmission of mother′s microflora to the newborn at birth[J]. Biol Neonate, 1996,69(1):30-35.
[7] Imhann F, Bonder MJ, Vich Vila A, et al. Proton pump inhibitors affect the gut microbiome[J]. Gut, 2016,65(5):740-748.
[8] Minalyan A, Gabrielyan L, Scott D, et al. the gastric and intestinal microbiome: role of proton pump inhibitors[J]. Curr Gastroenterol Rep, 2017,19(8):42.
[9] Bavishi C, Dupont HL. Systematic review: the use of proton pump inhibitors and increased susceptibility to enteric infection[J]. Aliment Pharmacol Ther, 2011,34(11-12):1269-1281.
[10] Evenepoel P, Claus D, Geypens B, et al. Evidence for impaired assimilation and increased colonic fermentation of protein, related to gastric acid suppression therapy[J]. Aliment Pharmacol Ther, 1998,12(10):1011-1019.
[11] Sheu BS, Wu JJ, Lo CY, et al. Impact of supplement with Lactobacillus- and Bifidobacterium-containing yogurt on triple therapy for Helicobacter pylori eradication[J]. Aliment Pharmacol Ther, 2002,16:1669-1675.
[12] Johnston BC, Goldenberg JZ, Parkin PC. Probiotics and the Prevention of Antibiotic- Associated Diarrhea in Infants and Children[J]. JAMA, 2016,316(14):1484-1485.
[13] 張冬梅,許斌斌,余礫,等.布拉酵母菌預防住院老年患者抗生素相關性腹瀉的前瞻性隨機對照研究[J].中華內科雜志,2017,56(6):398-401.
[14] Mantegazza C, Molinari P, D′Auria E, et al. Probiotics and antibiotic-associated diarrhea in children: A review and new evidence on Lactobacillus rhamnosus GG during and after antibiotic treatment[J]. Pharmacol Res, 2017,128:63-72.
[15] Tompkins TA, Hagen KE, Wallace TD, et al. Safety evaluation of two bacterial strains used in Asian probiotic products[J]. Can J Microbiol, 2008,54(5):391-400.

