芍藥苷對銀屑病小鼠皮損的治療作用及機制探討
李娜,趙穎,張曉杰,李偉寧
(1山東中醫藥大學,濟南250355;2 山東中醫藥大學附屬醫院)
銀屑病是T細胞介導的慢性炎癥疾病,特征是表皮增生、角化過度、炎癥細胞浸潤以及血管形成增加[1,2],全球患病率為2%~3%[3]。目前研究發現,血管內皮生長因子(VEGF)家族中以VEGF-A為主,常以其水平表示VEGF水平,其受體主要包括VEGFR1、VEGFR2。研究表明[4~6],銀屑病患者血清VEGF水平與疾病嚴重程度密切相關,VEGF誘導的血管異常生成被認為是銀屑病發病機制之一。因此,調控VEGF是治療銀屑病的關鍵方法之一[7]。然而,由于復雜的病因及化療的不良反應,目前沒有較理想的銀屑病藥物用于臨床。芍藥苷(PF)是芍藥總葡萄糖苷(TGP)的主要成分,具有抗炎、免疫調節及護肝的功能。多項研究[8,9]指出,PF在銀屑病治療中具有抗炎作用,但其對銀屑病發病過程中血管生成增加是否有作用尚不清楚。2016年5月~2017年5月,我們觀察了PF對銀屑病小鼠的治療作用,并探討其是否通過調控銀屑病皮膚病變中的VEGF發揮作用。現報告如下。
1 材料與方法
1.1 材料 40只雌性8~11周齡小鼠,購自上海實驗動物中心小鼠,飼養于無病原微生物的環境,均按照動物保護及應用協會的指導說明進行。咪喹莫特(IMQ)霜(四川明欣藥業),純度96%的PF(寧波立華植物提取技術有限公司)。制冰機(北京長流科學儀器公司),電熱恒溫水箱(上海躍進醫療器械公司);正置顯微鏡(Olympus公司),石蠟切片機(Leica公司);Quanti Fast SYBR Green PCR Kit試劑盒(Qiagen公司),Light CyclerTM480 Ⅱ型熒光定量PCR儀(Roche公司),低溫冷凍離心機(上海盧湘儀離心機儀器有限公司),旋渦振蕩器(青浦瀘西儀器廠),電動勻漿機(Fluko公司),mini protean 3 cell電泳儀(Bio-Rad 公司),PS-9電轉儀(大連競邁科技有限公司);ELISA試劑盒(eBioscience公司),MK3酶標儀(Finnpipette公司),Tanon-5200成像系統(Tanon公司)。
1.2 實驗方法
1.2.1 動物分組、造模與用藥處理 將40只小鼠隨機分為4組,每組10只。各組將小鼠背部毛發全部剔光,用Na2S擦拭。A組小鼠背部每天涂抹凡士林,連續涂抹7 d;B、C、D組小鼠均先用IMQ霜擦拭7 d(銀屑病造模),B、C組分別腹腔注射生理鹽水、PF 200 mg/(kg·d)10 d,D組腹腔注射PF 200 mg/(kg·d)后6 h背部皮下注射重組VEGF蛋白 100 ng 10 d。 以小鼠背部出現一定范圍肉眼可見鱗屑性紅斑區域,判為銀屑病造模成功。在治療第18天小鼠被安樂死,收集皮損組織及眼眶靜脈血液標本。
1.2.2 皮損組織病理觀察 收集皮損組織,以4%多聚甲醛固定后進行石蠟包埋。從石蠟組織塊上切取4 μm厚切片,HE染色后光學顯微鏡下進行組織學分析,并行微血管計數。采用Weidner微血管計數法評價:將切片置于40倍顯微鏡下確定染色最高血管密度區域,然后置于200倍顯微鏡下,選擇3個最高血管密度區進行微血管計數,求其平均值。
1.2.3 外周血VEGF蛋白檢測 采用ELISA法,按照試劑盒說明書進行操作。
1.2.4 皮損組織VEGF、VEGFR1、VEGFR2 mRNA檢測 采用實時定量PCR法。利用TRIzol試劑抽提小鼠背部皮膚組織總RNA,以M-MLV反轉錄酶體系將總RNA(1 μg)反轉成cDNA。用于GADPH、VEGF、VEGFR1、VEGFR2基因檢測的RT-PCR引物序列,見表1。實時定量PCR反應體系:SYBR Green Mix 12.5 μL,上下游引物各0.5 μL,ddH2O 9.5 μL,cDNA模板2 μL。PCR反應條件:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 1 min,40個循環;最后72 ℃ 5 min。以GAPDH基因作內參,應用 2-ΔΔCT方法分析相關基因VEGF、VEGFR1、VEGFR2的相對表達量。

表1 VEGF、VEGFR1、VEGFR2及內參基因PCR引物序列 (5′→3′)
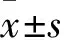
2 結果
2.1 各組皮損組織病理觀察結果 B、D組皮損組織具有典型的銀屑病樣病理特征,如表皮角化過度和角化不全,棘層增厚,表皮突下延,真皮乳頭內血管增多、擴張;相比之下,A組皮損組織未見病理學異常,C組皮損組織銀屑病樣病理特征顯著減輕。A、B、C、D組皮損組織中血管數分別為(9.33±3.51)、(21.33±3.51)、(11.33±3.05)、(14.67±4.16)條,B組皮損組織中血管數多于A、C、D組(P均<0.05),D組多于C組但無統計學差異。
2.2 各組外周血VEGF蛋白水平比較 A、B、C、D組外周血VEGF蛋白水平分別為(92.47±18.87)、(232.70±48.38)、(114.52±27.72)、(162.96±30.22)pg/mL,B組外周血VEGF蛋白水平高于A、C、D組(P均<0.05),D組高于C組但無統計學差異。
2.3 各組皮損組織中VEGF、VEGFR1、VEGFR2 mRNA表達量比較 見表2。

表2 各組皮損組織中VEGF、VEGFR1、VEGFR2 mRNA表達量比較
注:與A組比較,aP<0.05;與B比較,bP<0.05;與C組比較,cP<0.05。
3 討論
銀屑病是最常見的慢性炎癥性增生性皮膚病之一,易復發,病情頑固且可造成全身系統損害。其主要的組織病理學改變為新生血管形成,角質形成細胞過度增生及炎癥細胞浸潤。其中,新生血管形成可能是銀屑病發病的關鍵因素之一。
銀屑病在中醫文獻中有“干癬”“松皮癬”“白疕”等名稱。中醫學一般認為,銀屑病初起多由風寒、風熱之邪侵襲,營衛失和,氣血不暢,阻于肌表,日久化熱而生;有的因脾虛失其運化,濕熱蘊積,外不能宣泄,內不能利導,郁阻于肌膚所致;或者風寒、風熱、濕熱之邪日久化熱化燥,氣血耗傷則生風化燥,肌膚失養,郁阻肌表而成;也有因享賦不足,肝腎兩虧,沖任失調而發病。近年來我們通過大量臨床經驗的積累,認為該病是身心疾病,越來越重視情志因素在誘發和加重銀屑病中的作用。將銀屑病從肝論治,在龍膽瀉肝湯的基礎上配伍平肝柔肝藥白芍,調氣機而暢情志,對銀屑病的恢復有較好的效果。
白芍味苦、酸,入肝經,能補肝血而柔肝。各路醫家用以疏肝理氣,柔肝養血,緩中止痛,平肝斂陰。其主要藥效成分被稱為白芍總苷,包括PF、羥基芍藥苷、芍藥花苷、苯甲酰和芍藥內酯苷,其中PF占90%以上。PF是一種單萜類糖苷化合物,具有抗炎、抗過敏以及免疫調節的功效。我們前期研究采用獨特的治療干預模式,造模后實驗組小鼠病變皮膚組織出現典型的銀屑病皮損特征,如表皮角化過度,角化不全,棘層肥厚,真皮和表皮炎癥浸潤,真皮乳頭內毛細血管增生、迂曲、擴張等,這些指征在PF治療后得到了明顯的緩解;相反,同時予PF和VEGF處理的小鼠銀屑病皮損重回造模小鼠水平。表明PF全身給藥可有效緩解銀屑病造成的皮膚炎癥,而PF、VEGF聯合給藥可消除這種作用[10]。
VEGF又稱血管通透因子或血管調理素,最先從腫瘤細胞分離出來,是一種能與肝素結合的二聚體糖蛋白分子,并能特異性地作用于血管內皮細胞,是目前所發現的生物體內最強、最特異的血管活性因子,能促進血管形成、增加血管通透性。VEGF在銀屑病皮損和血清中過表達,與銀屑病斑塊形成、真皮乳頭層毛細血管擴張、扭曲密切相關。因此,VEGF在銀屑病發病機制中可能起關鍵作用。VEGF家族有5個成員,分別為VEGF-A、B、C、D、E和胎盤生長因子。人體中最常見的是VEGF-A,其位于染色體6p21.3,全長14 kb,由8個外顯子和7個內含子構成,是一種35~45 kb的同型二聚體糖蛋白,由兩個亞基通過二硫鍵相連。其氨基酸序列高度保守,與血小板衍生生長因子(PDGF)及胎盤生長因子之間具有部分同源性。
VEGF有VEGFR1、VEGFR2和VEGFR3 3種受體,他們都是酪氨酸激酶受體(RTKs),具有高親和力[11]。VEGF在銀屑病發病機制中的潛在作用與VEGF基因多態性和銀屑病患者VEGFR1、VEGFR2和VEGFR3過表達密切相關[12]。VEGFR1在正常血管發育中起重要作用,負責招募造血前體和引導單核細胞遷移;而VEGFR2則決定血管內皮細胞的遷移和增殖,其最重要的功能是增加血管通透性[13]。本研究結果顯示,VEGF、VEGFR1和VEGFR2基因水平在銀屑病小鼠的血清和皮損組織中均高表達,并且這種高表達水平在PF治療后恢復正常。PF、VEGF聯合給藥逆轉了PF對銀屑病小鼠的治療作用,這很好地解釋了VEGF在維持表皮屏障功能中的作用,表明角質細胞增生與表皮VEGF之間存在重要聯系[14]。一些研究報道指出,實驗誘導皮膚炎癥小鼠的表皮中VEGF過表達,進而誘導的炎癥反應導致出現了銀屑病的形態學、組織學和免疫學特征[15]。上述實驗結果表明,銀屑病發病機制的關鍵早期特征之一可能是通過上調VEGF及其受體引起表皮和免疫學改變。本研究中,D組皮損組織VEGF、VEGFR1、VEGFR2 mRNA表達量高于C組,差異有統計學意義;雖然D組外周血VEGF蛋白水平高于C組,皮損組織中血管數多于C組,但尚無統計學差異。這可能與本研究觀察時間較短,PF與VEGF聯合給藥已經從基因水平進行了逆轉,但外周血及組織學方面尚未產生明顯變化有關。
綜上所述,PF對銀屑病小鼠的皮損具有一定治療作用,與其抑制VEGF及其受體表達抗血管生成有關。本研究闡明了PF治療銀屑病可能的分子機制,為銀屑病的治療提供了新思路。
:
[1] Desmet E, Ramadhas A, Lambert J, et al. In vitro psoriasis models with focus on reconstructed skin models as promising tools in psoriasis research[J]. Exp Biol Med (May wood), 2017,242(11):1158-1169.
[2] Hegyi Z, Zwicker S, Bureik D, et al. Vitamin D analog calcipotriol suppresses the Th17 cytokine-induced proinflammatory S100 "alarmins" psoriasin (S100A7) and koebnerisin (S100A15) in psoriasis[J]. J Invest Dermatol, 2012,132(5):1416-1424.
[3] Ma HL, Liang S, Li J, et al. IL-22 is required for Th17 cell-mediated pathology in a mouse model of psoriasis-like skin inflammation[J]. J Clin Invest, 2008,118(2):597-607.
[4] Marina ME, Roman II, Constantin AM, et al. VEGF involvement in psoriasis[J]. Clujul Med, 2015,88(3):247-252.
[5] Nielsen HJ, Christensen IJ, Svendsen MN, et al. Elevated plasma levels of vascular endothelial growth factor and plasminogen activator inhibitor-1 decrease during improvement of psoriasis[J]. Inflamm Res, 2002,51(11):563-567.
[6] Nofal A, Al-Makhzangy I, Attwa E, et al. Vascular endothelial growth factor in psoriasis: an indicator of disease severity and control[J]. J Eur Acad Dermatol Venereol, 2009,23(7):803-806.
[7] Chen HQ, Li X, Tang R. Effects of narrow band ultraviolet B on serum levels of vascular endothelial growth factor and interleukin-8 in patients with psoriasis[J]. Am J Ther, 2016,23(3):655-662.
[8] Wen J, Wang X, Pei H, et al. Anti-psoriatic effects of Honokiol through the inhibition of NF-kappaB and VEGFR-2 in animal model of K14-VEGF transgenic mouse[J]. J Pharmacol Sci, 2015,128(3):116-124.
[9] Sun Y, Zhang J, Huo R, et al. Paeoniflorin inhibits skin lesions in imiquimod-induced psoriasis-like mice by downregulating inflammation[J]. Int Immunopharmacol, 2015,24(2): 392-399.
[10] Zhao J, Di T, Wang Y, et al. Paeoniflorin inhibits imiquimod-induced psoriasis in mice by regulating Th17 cell response and cytokine secretion[J]. Eur J Pharmacol, 2016,772:131-143.
[11] Son ED, Kim HJ, Kim KH, et al. S100A7 (psoriasin) inhibits human epidermal differentiation by enhanced IL-6 secretion through IkappaB/NF-kappaB signalling[J]. Exp Dermatol, 2016,25(8):636-641.
[12] Heidenreich R, Rocken M, Ghoreschi K. Angiogenesis drives psoriasis pathogenesis[J]. Int J Exp Pathol, 2009,90(3):232-248.
[13] Grun D, Adhikary G, Eckert RL. VEGF-A acts via neuropilin-1 to enhance epidermal cancer stem cell survival and formation of aggressive and highly vascularized tumors[J]. Oncogene, 2016,35(33):4379-4387.
[14] Shibuya M. Vascular endothelial growth factor and its receptor system: physiological functions in angiogenesis and pathological roles in various diseases[J]. J Biochem, 2013,153(1):13-19.
[15] Elias PM, Arbiser J, Brown BE, et al. Epidermal vascular endothelial growth factor production is required for permeability barrier homeostasis, dermal angiogenesis, and the development of epidermal hyperplasia: implications for the pathogenesis of psoriasis[J]. Am J Pathol, 2008,173(3):689-699.

