農大7號歐李葉片愈傷組織的誘導和增殖
武莎莎,張 彬,杜俊杰,王鵬飛,張建成,穆霄鵬,傅鴻博
(山西農業大學園藝學院,山西太谷030801)
歐李(Cerasus humilisBge.)又名鈣果,為薔薇科櫻桃屬[1],是我國特有的一種優良灌木果樹,分布于我國的黑龍江、遼寧、內蒙古、河北、山東、山西等省區,多生長在向陽山坡或沙丘邊緣,資源相當豐富[2]。其耐寒、耐旱、耐瘠薄,固土保水作用強,山西省已將其列為經濟林木樹種[3]。歐李果實含有糖、蛋白質、維生素和各種礦質元素及抗氧化等人體營養和保健活性物質[4]。隨著果樹轉基因研究的不斷深入,其基因功能的驗證要求能在大多數的木本果樹本身或類似的果樹上進行,但多數木本果樹結果晚、體積大、驗證時間長、成本高。
歐李具有結果早、樹體小的特點,作為木本果樹的基因功能驗證模式植物優勢明顯。農大7號品種是新選育的一個鮮食歐李品種,其外觀漂亮、香味濃郁、酸甜適口,且結果早、豐產性強[5],但若要作為轉基因功能驗證的模式品種,必須首先建立其高效再生體系。盡管近年來歐李再生體系的研究已有報道[6-9],但再生體系因品種其差異較大。
本研究以歐李農大7號為材料,探討其愈傷組織建立的技術,旨在為歐李高效再生體系的建立提供理論基礎。
1 材料和方法
1.1 試驗材料
供試材料取自山西農業大學歐李資源圃農大7號品種當年生枝條中上部平展無病害葉片。
1.2 試驗方法
1.2.1 外植體處理 將剪下的葉片放在流動水下沖洗30 min,用洗潔精清洗3~5 min,之后用清水沖洗至無泡沫為止。在無菌條件下,將材料用0.1%升汞消毒9 min,再用75%酒精消毒15 s,然后用滅好菌的無菌蒸餾水沖洗3~5次,最后用無菌濾紙擦干。將葉片去掉葉邊緣及葉柄,剪成長寬為1 cm大小方塊,近軸端接觸培養基。
1.2.2 單因素 NAA,2,4-D對愈傷組織的誘導試驗
生長素 NAA 設 0.5,0.8,1.2 mg/L 等 3 個質量濃度,2,4-D 設 0.5,0.8,1.0,1.2,1.5 mg/L 等 5 個質量濃度,在MS培養基中進行培養。
1.2.3 多因素NAA,6-BA在不同培養基中對愈傷組織的誘導試驗 選MS,1/2 MS和改良MS這3種培養基作為基本培養基,其中,改良MS培養基為在MS培養基基礎上鈣鹽、鐵鹽含量各增加了25%,生長素 NAA 質量濃度設為 0.4,0.8,1.2 mg/L,6-BA設0.5,1.0,1.5 mg/L,按正交試驗L9(33)進行處理設計。
1.2.4 多因素NAA,TDZ在MS培養基中對愈傷組織的誘導試驗 生長素 NAA 設 0.2,0.5,0.8 mg/L等 3 個質量濃度,分裂素 TDZ設 1.5,3.5,5.5 mg/L等3個質量濃度進行完全交叉試驗,在MS培養基中進行培養。
1.2.5 愈傷組織增殖試驗 將培養25~30 d、大小為0.3~0.5 cm3的愈傷組織分別轉接到單因素培養基和多因素培養基上進行增殖試驗。其中,單因素為 MS+2,4-D,2,4-D質量濃度設為 0.6,0.8,1.0,1.2 mg/L;多因素為 MS+2,4-D+6-BA,其中,2,4-D 質量濃度設為 0.6,0.8,1.0,1.2 mg/L,6-BA質量濃度設為 0.2,0.5mg/L,進行交叉試驗。培養 30d后觀察愈傷增殖情況。
培養基 pH 值為 5.8~6.0、蔗糖 30 g/L、瓊脂6.5 g/L。外植體接種后先暗培養10 d,后再在光下培養,30 d后觀察統計結果。培養條件(25±1)℃,光暗周期18 h/6 h,光照強度2 000~3 000 lx。

1.3 數據分析
采用SAS統計分析軟件包對試驗觀測到的數據進行方差分析、多重比較。
2 結果與分析
2.1 單因素NAA,2,4-D對愈傷組織誘導的影響
從表1可以看出,單因素NAA,2,4-D均有較高誘導率,2,4-D的誘導率整體上高于 NAA;2,4-D誘導的愈傷組織時間快,顏色呈黃白狀,質量濃度0.8 mg/L相對較好(圖1);NAA誘導的愈傷組織呈綠色,質地疏松,質量濃度0.5 mg/L相對較好。整體得出,單因素誘導愈傷組織試驗中,以MS+0.8 mg/L 效果最好。
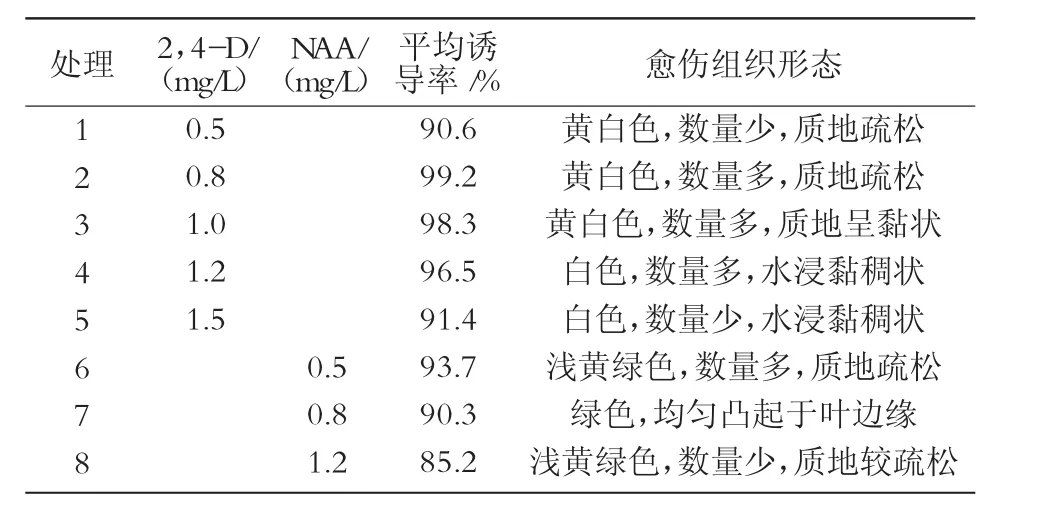
表1 單因素對愈傷組織的誘導

2.2 多因素NAA,6-BA在不同培養基中對愈傷組織誘導的影響
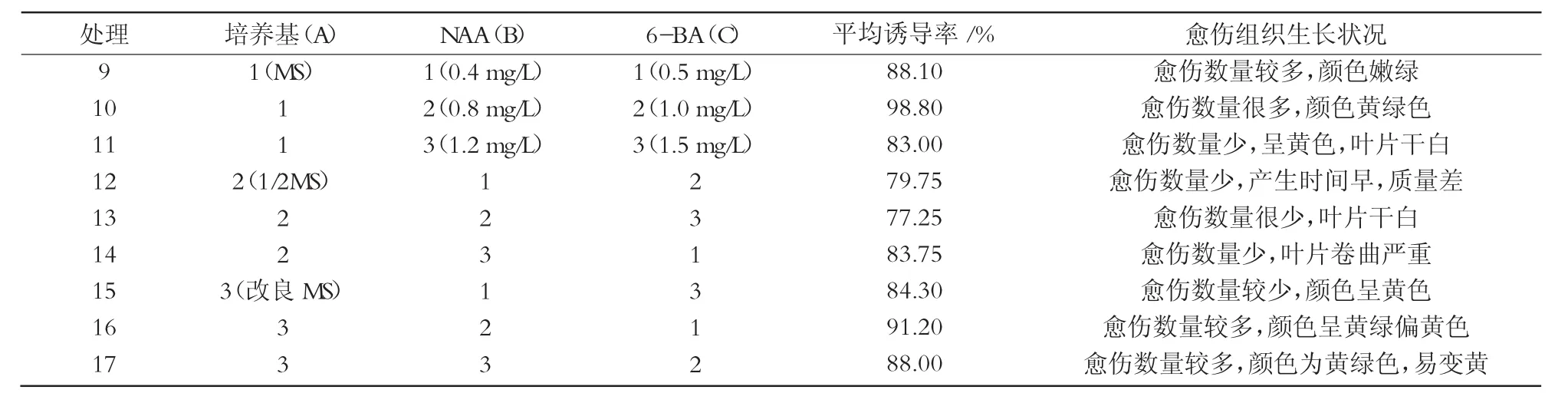
表2 多因素NAA,6-BA在不同培養基中對愈傷組織的誘導
葉片接種3 d后開始微微隆起,7 d左右主葉 脈傷口處膨大,10 d左右有小顆粒狀愈傷組織出現,20~30 d有大量愈傷組織產生。1/2 MS培養基中產生愈傷時間最早,其次依次為MS和改良MS,但是1/2 MS誘導的愈傷疏松,易老化。MS、改良MS產生的愈傷呈黃綠、嫩綠色,質地緊密。30 d統計愈傷組織誘導率,結果列于表2。對數據進行方差分析和差異性顯著比較,結果如表3,4所示。

表3 方差分析結果

表4 單因素多重比較 %
由表3,4可知,農大7號歐李品種在葉片愈傷組織誘導時,B因素NAA對愈傷組織誘導率的影響達顯著水平,A因素(培養基)和C因素(6-BA)對愈傷組織誘導率的影響均達到極顯著水平,說明3個因素均有重要作用,同時各因素的主次關系為A>C>B。對A因素進行多重比較表明,A1極顯著高于A2和A3,因此,A1即MS培養基對歐李葉片愈傷組織誘導效果最好;生長素B2極顯著高于B3和B1,即NAA質量濃度0.8 mg/L效果最好;C2和C1極顯著高于C3,且C2又顯著高于C1,因此,C2即6-BA 1.0 mg/L的效果最好。通過分析以及表型觀察得出,農大7號葉片愈傷組織誘導以MS+NAA 0.8 mg/L+6-BA 1.0 mg/L 組合最好(圖 2)。


表5 多因素NAA,TDZ在MS培養基中對愈傷組織的誘導

從表5可以看出,NAA和TDZ誘導的愈傷組織整體呈綠色,質地偏硬、脆,最適培養基為NAA 0.5 mg/L+TDZ3.5 mg/L,誘導率達到 98.3%(圖 3)。
2.4 MS培養基下不同生長調節劑對愈傷組織增殖的影響
從表6可以看出,單一添加2,4-D增殖愈傷組織中以質量濃度0.8 mg/L效果最好,過高或過低都不利于增殖和質地的優化。同時添加2,4-D和6-BA增殖愈傷組織中,高質量濃度2,4-D和低質量濃度6-BA下增殖的愈傷組織偏黃、質地疏松,而在低質量濃度2,4-D和高質量濃度6-BA下增殖的愈傷組織偏綠且質地緊密。本試驗中,MS+6-BA0.2mg/L+ 2,4-D0.6 mg/L為最佳愈傷組織增殖培養基。

表6 歐李農大7號愈傷組織增殖情況
3 討論
愈傷組織具有高度再分化的能力,經過長期繼代保存而不喪失其胚性并且具有旺盛的自我增殖能力,可用于建立大規模的愈傷組織無性系,通過愈傷組織的再分化建立高頻率植株再生體系,進而為通過遺傳轉化改良品種奠定基礎[10]。愈傷組織的形成過程受植物基因型、外植體類型及理化狀態、培養基成分、光照條件、糖源濃度等諸多因素相互作用的影響[11]。培養基種類以及生長調節劑又是主導因素[12]。因此,本試驗通過不同培養基、不同生長調節劑和濃度來篩選農大7號愈傷組織的最適培養條件,為以后歐李分子機制、遺傳轉化和種質資源保存奠定基礎。
愈傷組織的誘導和培養是內源激素和外源激素共同作用的結果,通過附加外源激素可以調節總的激素水平,從而完成由外植體脫分化形成愈傷組織的過程[13]。植物愈傷組織培養過程中,植物基因型、培養基及激素配比等為主要因素[14]。植物組織培養中,不同植物的遺傳特性、生物學特性都不同,因而,適宜物種組織生長的營養條件也會有所不同,甚至同一植物的不同部位、同一部位的不同生長時期對營養的要求也會有所變化[15]。因此,在組培過程中首先需要選擇一個最適培養基。
劉琳[16]用 MS,N6,B5,WPM這 4 種培養基進行對比試驗,結果表明,MS和B5都可作為鈣果微體快繁的培養基,但使用B5培養基,試管苗易出現黃化現象,故基本培養基用MS。本試驗進一步證明,葉片誘導愈傷組織質量最好的為MS培養基。杜研[17]研究發現,在愈傷組織誘導中,MS+KT0.3 mg/L+NAA 0.5 mg/L培養基中,農大3號葉片愈傷組織的誘導率達到97.8%。本試驗中,單因素 2,4-D0.8mg/L誘導產生的愈傷組織時間早、數量多;多因素MS+NAA 0.8 mg/L+6-BA 1.0 mg/L 誘導的愈傷組織效果好,但是當2,4-D質量濃度高于1.0 mg/L時,愈傷組織數量少,形態呈水漬黏狀。在只添加2,4-D的誘導培養基上生長的愈傷組織比較松軟,呈黏液化和泡狀,一般不易分化,且再生頻率很低[18],本試驗雖然證明了單用2,4-D也能產生較好的愈傷組織,但在歐李樹種上應進一步進行驗證。本試驗添加6-BA的培養基誘導出的愈傷組織呈黃綠色、質地疏松,但是高質量濃度的6-BA(超過2.0 mg/L)會抑止愈傷組織增殖,愈傷組織在后期會發生嚴重褐化,是否褐化作為植物組培能否成功的關鍵因子之一[19],在試驗中應避免材料發生褐化。本試驗中,褐化原因可能是由于歐李作為一種灌木果樹,本身分生能力較強,因此,歐李不需要高濃度分裂素。TDZ分裂能力較強,在添加TDZ的培養基誘導出的愈傷組織顏色偏深綠,質地較硬。姚婷等[8]研究表明,離體葉片不定芽再生的最適植物生長調節劑組合為改良 MS+TDZ4.0 mg/L+IBA 0.2 mg/L,再生率達到63.1%,且超過20 d時就可產生不定芽,本試驗也曾使用了該配比,但未得到不定芽,可能是由材料的不同所引起的。
在愈傷組織誘導增殖過程中,生長素和分裂素種類及濃度都起著舉足輕重的作用。在合適的濃度下,使用2,4-D誘導增殖愈傷組織數量多、速度快、質地穩定,因此,可用于材料的保存;6-BA和生長素NAA或2,4-D結合的愈傷組織質地顏色可以進一步用于不定芽的再生。TDZ分裂能力最強,但是沒有6-BA穩定。
參考文獻:
[1]俞德浚.中國果樹分類學[M].北京:農業出版社,1982:63-77.
[2]丁偉,杜俊杰,王鵬飛,等.黃土丘陵溝壑區不同立地類型歐李生長差異分析[J].山西農業科學,2017,45(5):764-768.
[3]陳赫男.砂石山區優良水土保持先鋒樹種歐李引種及其效益研究[D].泰安:山東農業大學,2007.
[4]朱華.歐李果酒的初步研究[J].釀酒科技,2004(4):97-98.
[5]王鵬飛,曹琴,杜俊杰,等.鮮食歐李新品種‘農大7號’[J].園藝學報,2013,40(1):181-182.
[6]肖遠志,黃國林,張平.新技術在觀賞植物組織培養中的應用[J].湖南農業科學,2013(15):20-22.
[7] WANG R F,HUANG F L,ZHANG J,et al.Establishment of a high-frequency regeneration system in Cerasus humilis,an important economic shrub[J].Forest Research,2016,21(5):244-250.
[8]姚婷,張開春,閆國華,等.歐李離體葉片再生體系的建立[J].果樹學報,2012,29(4):589-592,713.
[9]李勁,蔣澤平,梁珍海.優系歐李莖葉愈傷組織誘導與植株再生[J].江蘇林業科技,2006(1):12-15.
[10]郭曉博,張曉麗,李俊華,等.山藥愈傷組織研究進展[J].北方園藝,2014(24):183-186.
[11]崔凱榮,戴若蘭.植物體細胞胚發生的分子生物學[M].北京:科學出版社,2000:329-397.
[12]張海龍,劉艷軍,黃俊軒,等.影響冰燈玉露組培苗形態建成因子的研究[J].天津農業科學,2017,23(7):17-20.
[13]高兵.“嘎拉”蘋果葉片愈傷組織的誘導 [J].北方園藝,2017(9):88-92.
[14]孫瑞芬,李天然,李堃,等.草莓組培快繁及葉片誘導植株再生的研究[J].華北農學報,2002,17(4):49-53.
[15]GELLA R,ERREA P.Application of in vitro therapy for ilarvirus elimination in three Prunus species[J].Journal of Phtopathology,1998,146(8):445-449.
[16]劉琳.鈣果初代組織培養技術研究[J].安徽農業科學,2005,33(2):247.
[17]杜研.鈣果組織培養關鍵技術的研究 [D].蘭州:甘肅農業大學,2007.
[18]李代麗,康向陽.植物愈傷組織培養中內外源激素效應的研究現狀與展望[J].生物技術通訊,2007(3):546-548.
[19]劉藝平,王政,牛佳佳,等.不同糖源及蔗糖質量濃度對牡丹愈傷組織褐化的影響[J].河南農業科學,2013,42(3):103-106.

