血清炎性因子在Hp感染的消化性潰瘍患者中的臨床檢測價值研究
謝屹,王翔,王忠
(1.重慶醫科大學附屬第三醫院·捷爾醫院體檢中心,重慶 401120;2.重慶市第五人民醫院消化內科,重慶 400013)
臨床上消化性潰瘍(peptic ulcer,PU)發病率較高,其中胃、十二指腸潰瘍尤為常見,其發病主要與遺傳易感性、長期服用糖皮質激素等藥物及幽門螺桿菌(Hp)等因素關系密切,其中Hp是PU的重要病因[1]。據報道,Hp屬于微需氧菌之一,其感染后的炎性介質、細胞因子、黏附因子及Hp酶類等在機體非特異性的炎癥反應中可能扮演了重要角色,Hp感染不但可以使胃黏膜受損,而且可導致全身性慢性炎性反應及免疫反應,故免疫分子對慢性胃疾患者尤其是Hp相關疾病的影響作用日漸受重視[2-3]。本研究旨在通過檢測PU患者血清中白細胞介素-2(IL-2)、白細胞介素-6(IL-6)、白細胞介素-8(IL-8)、超敏C反應蛋白(hs-CRP)及腫瘤壞死因子-α(TNF-α)的表達水平及Hp感染狀況,探析Hp感染后PU患者免疫炎癥反應狀況,給PU患者的臨床治療提供一定地理論指導。
1 資料與方法
1.1 研究對象
分析2016年7月至2017年7月在本院接受診治的76例PU患者的臨床資料。入選標準:(1)同意接受相關檢查的患者;(2)臨床資料完整者;(3)既往無胃部手術史的患者;(4)胃鏡及病理確診為消化性潰瘍的患者。排除標準:(1)存在嚴重重要臟器疾患者;(2)最近1個月內有服用有關抗Hp藥物的患者;(3)不愿配合此次研究者;(4)經多次臨床規范治療及胃鏡復查后發現Hp檢測仍呈陽性的患者。本研究經醫學倫理委員會批準,患者及家屬知情同意此次研究并簽署相關知情同意書。根據Hp檢測結果,將入選者分成觀察組(Hp陽性,40例)和對照組(Hp陰性,36例)兩組。觀察組男性23例,女性17例,年齡(47.8±9.6)歲;根據疾病類型分類,十二指腸潰瘍31例,胃潰瘍9例。對照組男性20例,女性16例,年齡(46.4±9.4)歲,根據疾病類型分類,十二指腸潰瘍28例,胃潰瘍8例。兩組患者的年齡、性別等一般資料無明顯統計學差異(P>0.05),具有可比性。
1.2 研究方法
所有患者均接受規范的消化性潰瘍治療,觀察組同時接受Hp根治四聯療法,治療結束停止用藥1個月后復查Hp及胃鏡,最后確定潰瘍已經愈合且Hp感染根治后接受血清學復查。其中Hp根治四聯療法的具體步驟為:枸櫞酸鉍鉀300 mg/次,每日4次,餐前30 min及睡前服用;阿莫西林1 000 mg/次,每日兩次,餐后服用;克拉霉素500 mg/次,每日兩次,餐后服用;雷貝拉唑10 mg/次,每日兩次,餐后服用。
觀察指標:治療前后血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平的檢測:①采集血樣:清晨空腹采集3 mL靜脈血,室溫下靜置2 h后上機離心處理20 min,提取上清液送檢;②雙抗體夾心酶聯免疫吸附法(ELISA)法,按照相關說明書嚴格執行操作步驟。
1.3 統計學分析
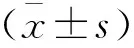
2 結果
2.1 兩組患者治療前血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平比較
由表1可見,治療前觀察組患者的IL-2水平明顯低于對照組,IL-6、IL-8、hs-CRP及TNF-α水平明顯高于對照組(P<0.05)。

表1 兩組患者治療前血清IL-2、IL-6、IL-8水平比較
2.2 兩組患者治療后血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平比較
治療后兩組患者的血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平比較,差異無統計學意義(P>0.05)。見表2。
表2兩組患者治療后血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平比較

指標觀察組(n=40)對照組(n=36)t/χ2值P值IL-2(ng/mL)4.01±0.724.11±0.580.6620.51IL-6(pg/mL)31.06±3.2730.87±3.140.2570.80IL-8(pg/mL)27.35±4.2626.92±4.370.4340.67hs-CRP(mg/L)8.96±1.948.15±2.021.7820.08TNF-α(μg/L)11.93±5.2711.12±5.340.6650.51
2.3 觀察組患者治療前后血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平比較
觀察組患者治療后IL-2水平明顯高于治療前,IL-6、IL-8、hs-CRP及TNF-α水平明顯低于治療前(P<0.05)。見表3。
表3觀察組患者治療前后血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平比較

指標治療前(n=40)治療后(n=40)t/χ2P值IL-2(ng/mL)2.07±0.624.01±0.7212.62<0.01IL-6(pg/mL)42.31±8.1431.06±3.277.745<0.01IL-8(pg/mL)39.24±6.3827.35±4.269.444<0.01hs-CRP(mg/L)10.24±2.178.96±1.942.699<0.01TNF-α(μg/L)15.63±5.7211.93±5.272.922<0.01
3 討論
PU主要由Hp感染引發,目前免疫分子在Hp相關的PU疾病病理機制中相關作用逐漸受到廣大學者的關注。有研究發現,Hp主要通過機體中的免疫炎癥反應致病,患者病情發展及預后等情況與免疫反應程度及其狀態等關系密切[4]。胃黏膜被Hp感染后,將免疫系統激活,從而釋放出大量炎癥細胞因子,并移動至上皮層,引發局部炎癥反應,釋放出大量IL-2、IL-6等細胞因子,一旦對機體實施毒素清除劑細菌消滅、組織修復時,機體內免疫炎癥反應間交互作用就會受阻,同時局部炎癥細胞不再往上皮層移動,潰瘍逐漸愈合,故機體內釋放的細胞因子是人體Hp感染的重要免疫指標之一[5]。細胞因子被Hp感染后在PU中發揮了重要作用,即Hp感染導致PU中免疫反應是重要機制之一[6]。
大量研究結果證實,細胞因子產生于T淋巴細胞,包括TH1與TH2細胞兩類,其中TH1細胞主要分泌IL-2、腫瘤壞死因子-β(TNF-β)等細胞因子參與細胞免疫反應,TH2細胞主要分泌IL-6及IL-8等細胞因子參與體液免疫反應[7,8]。有學者發現,機體內IL-2是反映細胞免疫功能的一個重要指標,其主要合成于活化T細胞,也可由B細胞及單核-巨噬細胞、NK細胞等產生,對抗病毒感染及免疫應答等均具有重要作用,可以刺激并促進已被致絲裂因數或特異性抗原活化的T細胞不斷增殖[9,10];IL-6屬于多功能細胞因子之一,主要調節免疫反應[11];IL-8有著重要的生物學活性,在免疫應答的調控及機體應激反應等活動中均具有重要作用[12]。hs-CRP屬于全身炎性反應的非特異性標志物之一,是機體內組織受損或受微生物入侵等炎癥性刺激時產生的急性相蛋白,主要由肝細胞合成;TNF-α屬于多活性細胞因子之一,一旦患者有腫瘤、感染或者自身免疫性等疾病時,機體內血清TNF-α水平會呈上升趨勢。本研究結果顯示,治療前觀察組患者的血清IL-2水平明顯低于對照組,而IL-6、IL-8、hs-CRP及TNF-α水平明顯高于對照組(P<0.05),提示Hp呈陽性的患者由于受Hp感染,機體內細胞免疫功能降低,局部細胞發生免疫反應,致局部炎性細胞釋放的細胞因子大幅增加,在PU發病過程中扮演了重要角色。此外,治療后兩組患者的血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平無明顯統計學差異(P>0.05),觀察組患者治療后的血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平較治療前發生明顯變化(P<0.05),但對照組治療前后的血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平無明顯統計學差異(P>0.05),提示Hp根治后患者的局部炎癥反應得到了有效控制,同時體液及細胞免疫反應得到了有效調控,改善了機體免疫反應,促進了局部潰瘍的快速愈合,故檢測PU患者血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平有助于對Hp感染后細胞免疫功能的評估及患者病情進展及預后情況的判斷。
總之,血清IL-2、IL-6、IL-8、hs-CRP及TNF-α水平在Hp感染的PU患者中具有重要的臨床檢測價值,不但可以幫助臨床醫師了解患者的免疫功能狀況及病情進展情況,而且有助于臨床診斷及療效判斷,科學指導PU患者的臨床治療。
參考文獻
[1] Yin YW,Hu AM,Sun QQ,etal.Association between interleukin-8 gene-251 T/A polymorphism and the risk of peptic ulcer disease:a meta-analysis[J].Hum Immunol,2013,74(1):125-130.
[2] Cheng HH,Tseng GY,Yang HB,etal.Increased numbers of Foxp3-positive regulatory T cells in gastritis,peptic ulcer and gastric adenocarcinoma[J].World J Gastroenterol,2012,18(1):34-43.
[3] Miszczyk E,Walencka M,Rudnicka K,etal.Antigen-specific lymphocyte proliferation as a marker of immune response in guinea pigs with sustained Helicobacter pylori infection[J].Acta Biochim Pol,2014,61(2):295-303.
[4] Qadri Q,Rasool R,Afroze D,etal.Study of TLR4 and IL-8 gene polymorphisms in H.pylori-induced inflammation in gastric cancer in an ethnic Kashmiri population[J].Immunol Invest,2014,43(4):3243-3236.
[5] Sekiguchi F,Matsumoto Y,Maeda Y,etal.Biological activity of Helicobacter pylori components in mammalian cells:is it independent of proteinase-activated receptors?[J].J Physiol Pharmacol,2012,63(6):571-576.
[6] Siddique I,Al-Qabandi A,Al-Ali J,etal.Association between Helicobacter pylori genotypes and severity of chronic gastritis,peptic ulcer disease and gastric mucosal interleukin-8 levels:Evidence from a study in the Middle East[J].Gut Pathog,2014,6(1):41.
[7] Ramis IB,Vianna JS,Gon alves CV,etal.Polymorphisms of the IL-6,IL-8 and IL-10 genes and the risk of gastric pathology in patients infected with Helicobacter pylori[J].J Microbiol Immunol Infect,2017,50(2):153-159.
[8] Kim JE,Kim MS,Yoon YS,etal.Use of selected lactic acid bacteria in the eradication of Helicobacter pylori infection[J].J Microbiol,2014,52(11):955-962.
[9] Mesali H,Ajami A,Hussein-Nattaj H,etal.Regulatory T Cells and Myeloid-Derived Suppressor Cells in Patients with Peptic Ulcer and Gastric Cancer[J].Iran J Immunol,2016,13(3):167-177.
[10] Akdogan RA,Ozgur O,Gucuyeter S,etal.A pilot study of Helicobacter pylori genotypes and cytokine gene polymorphisms in reflux oesophagitis and peptic ulcer disease[J].Bratisl Lek Listy,2014,115(4):221-228.
[11] Darwin E,Murni AW,Nurdin AE.The Effect of Psychological Stress on Mucosal IL-6 and Helicobacter pylori Activity in Functional Dyspepsia[J].Acta Med Indones,2017,49(2):99-104.
[12] Barrozo RM,Hansen LM,Lam AM,etal.CagY Is an Immune-Sensitive Regulator of the Helicobacter pylori Type IV Secretion System[J].Gastroenterology,2016,151(6):1164-1175.

