胸腹腔鏡Ivor-Lewis食管癌切除術的應用可行性與安全性分析
苗國強 劉 蒙 鈕 樂
食管癌是人類常見的惡性腫瘤,死亡人數居胃癌、肝癌和肺癌之后[1-2]。手術切除是食管癌治療的主要手段,其中Sweet(左胸后外側切口)手術在早期被廣泛用于食管癌切除,雖然有比較高的成功率,但存在術野暴露不足、淋巴結清掃和吻合重建不足等缺點[3-4]。隨著醫學技術的快速發展,胸腔鏡與腹腔鏡廣泛應用于各種外科手術,具有恢復快、失血少、創傷小等優點,食管癌微創手術也產生了多種手術方式[5],其中采用上腹正中、右胸后外側兩切口(Ivor-Lewis)術既能最大程度切除原發腫瘤,又能徹底清掃胸腹二區淋巴結,因此應用比較多見[6-7]。不過更大的切除范圍可能帶來更大的并發癥風險,這也是限制Ivor-Lewis手術廣泛開展的根源[8]。不過手術作為一種特殊類型的創傷,所致的應激反應會不同程度地干擾機體免疫功能,對于炎癥的表達有明顯影響[9-10]。本文具體探討與分析了胸腹腔鏡Ivor-Lewis食管癌切除術的應用可行性與安全性,現報告如下。
1 資料與方法
1.1 一般資料
2012年2月到2017年1月選擇在我院外科診治的食管癌患者120例作為研究對象,納入標準:患者知情同意本研究;符合食管癌的診斷標準;臨床分期Ⅰ~Ⅲ期;既往均無胸、腹部手術史;不伴頸部淋巴結腫大及遠處臟器轉移;適宜進行手術治療;研究得到醫院倫理委員會的批準。排除標準:妊娠與哺乳期婦女;嚴重心肺功能不全患者。根據入院順序,按照隨機數字表法分為觀察組與對照組,各60例。2組患者的一般資料對比無差異(P>0.05)。見表1。
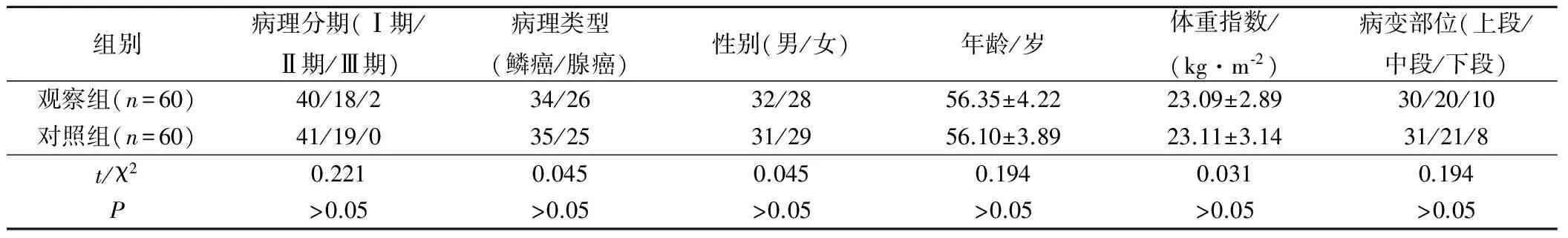
表1 2組基線資料對比
1.2 手術方法
觀察組:給予胸腹腔鏡Ivor-Lewis切除術。患者取平臥位,全麻雙腔氣管插管。在腹腔鏡操作中,腹壁作5個孔,游離胃并清掃腹腔干淋巴結。沿膈肌腳向上游離食管下段,左右膈肌腳部分分離,左側膈下放置引流管。在胸腔鏡操作中,胸壁作4個孔,胸游離下段食管并清掃比鄰淋巴組織,荷包縫合,置入25 mm端端吻合抵釘座后收緊縫線。將劍突下切口擴大到可放置吻合器,用切割縫合器制作管胃,實現端端吻合,縫合切口。 對照組:給予Sweet切除術,游離胸部食管,清掃肺門淋巴結、食管旁、隆突下、部分上縱膈淋巴結。切開膈肌,清掃賁門旁及胃左血管旁淋巴結,游離胃,吻合方法同觀察組。
1.3 觀察指標
(1)圍手術指標:觀察與記錄2組的手術時間、術后胸腔引流量、術中出血量、術后住院時間等。(2)并發癥:觀察2組術后1個月內發生的并發癥情況,包括胃瘺、肺部感染、胸胃綜合征、吻合口狹窄等。(3)炎癥因子檢測:在術前與術后1個月采集空腹靜脈血3~5 ml,低溫離心(4 ℃,2 000 rpm/min離心10 min)分離上層血清,采用全自動生化分析儀測定腫瘤壞死因子-α(TNF-α)、白細胞介素-6(IL-6)含量。
1.4 統計方法
選擇SPSS20.00軟件進行數據的分析與記錄,計量數據選擇均數±標準差(±s)進行表示,對比采用t檢驗;等級資料與計數數據采用百分比表示,對比采用卡方χ2檢驗與軼和檢驗等。P<0.05代表差異有統計學意義。
2 結果
2.1 圍手術指標對比
所有患者都順利完成手術,無中轉開放手術。觀察組的術后胸腔引流量、術中出血量、術后住院時間都明顯少于對照組(P<0.05);2組手術時間對比,差異無統計學意義(P>0.05)。見表2。
表2 2組圍手術指標對比(±s)
組別手術時間/min術中出血量/ml術后胸腔引流量/ml術后住院時間/d觀察組(n=60)214.42±33.57198.32±41.46771.49±100.117.91±1.45對照組(n=60)204.73±27.63316.93±55.33897.38±135.259.99±1.47t0.55513.9854.2986.111P>0.05<0.05<0.05<0.05
2.2 術后并發癥對比
觀察組術后1個月的胃瘺、肺部感染、胸胃綜合征、吻合口狹窄等并發癥發生情況明顯少于對照組(Z=5.105,P<0.05)。見表3。

表3 2組術后并發癥發生情況對比(例 ,%)
2.3 IL-6與TNF-α變化對比
2組術后1個月的的血清IL-6與TNF-α都明顯低于術前(P<0.05);同時觀察組術后1個月的血清IL-6與TNF-α明顯低于對照組(P<0.05)。見表4。
表4 2組手術前后IL-6與TNF-α變化對比(±s,ng/ml)
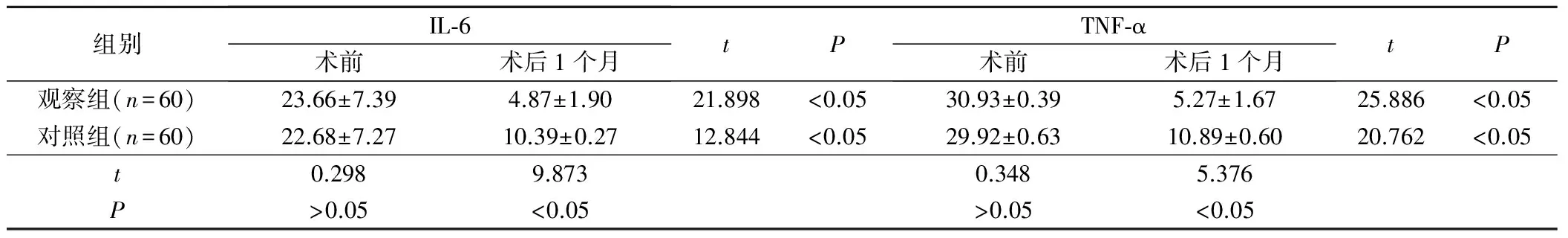
表4 2組手術前后IL-6與TNF-α變化對比(±s,ng/ml)
組別IL?6術前術后1個月tPTNF?α術前術后1個月tP觀察組(n=60)23.66±7.394.87±1.9021.898<0.0530.93±0.395.27±1.6725.886<0.05對照組(n=60)22.68±7.2710.39±0.2712.844<0.0529.92±0.6310.89±0.6020.762<0.05t0.2989.8730.3485.376P>0.05<0.05>0.05<0.05
3 討論
食管癌是一種人類常見的惡性腫瘤,當前在我國發病率與死亡率都比較高。手術是食管癌的治療首選方法,但是也是一種高風險的手術,有一定的死亡率,為此手術路徑的選擇很重要[11-12]。
Sweet早期被廣泛用于食管癌切除,有很高的手術成功率,但是對上縱隔及腹部的顯露不太明顯,淋巴結的清掃很難徹底[13-14]。右胸后外側和上腹正中兩切口是Lewis-Sanby提出的,切口可充分顯露整個胸段食管,尤其是喉返神經旁的上縱隔淋巴結,便于清掃縱膈淋巴結,提高了根治性切除率。本研究顯示所有患者都順利完成手術,無中轉開放手術,觀察組的術后胸腔引流量、術中出血量、術后住院時間都明顯少于對照組(P<0.05),2組手術時間差異無統計學意義(P>0.05)。從機制上分析,Ivor-Lewis手術避免了主動脈弓的阻擋,胸段食管全長暴露于手術野中,經過右側開胸手術切斷奇筋脈弓后可直視下解剖全長胸段食管,可切除更多食管,提高了淋巴結清掃水平,減少了斷端腫瘤殘留幾率[15]。Ivor-Lewis手術能夠非常清楚暴露整個食管床,使得更加徹底清掃腹部淋巴結成為可能[16]。
有報道顯示Ivor-Lewis手術后并發癥發生率增加,不利于患者康復[17]。本研究顯示觀察組術后1個月的胃瘺、肺部感染、胸胃綜合征、吻合口狹窄等并發癥發生情況明顯少于對照組(P<0.05)。主要在于Ivor-Lewis手術能保持膈肌的完整性,最大限度地減少手術對患者呼吸功能的損害,有利于術后的排痰,從而減少了呼吸道的并發癥。同時在手術應用中,管狀胃的應用較全胃明顯延長了胃的長度,使管胃很容易無張力達到胸內任意吻合高度,有效地避免了胸胃的擴張,可明顯減輕幽門部疼痛,從而減少并發癥[18-19]。
食管癌患者多伴隨有炎癥因子的異常表達,機體免疫功能損傷也主要通過炎癥反應的方式呈現出來。IL-6與TNF-α都為促炎性細胞因子,在手術創傷圍手術期可調控T淋巴細胞增殖分化、誘導殺傷性T淋巴細胞[20-21]。本研究顯示觀察組術后1個月的的血清IL-6與TNF-α都明顯低于術前(P<0.05),同時觀察組術后1個月的血清IL-6與TNF-α明顯低于對照組(P<0.05),表明胸腹腔鏡Ivor-Lewis食管癌切除術的應用能減少炎癥因子的表達。
總之,胸腹腔鏡Ivor-Lewis食管癌切除術的應用具有很好的可行性,能減少手術創傷,減少術后并發癥的發生,抑制炎癥因子的表達,有利于患者康復。
[1] 孫勇攀,梅 宏,許 川,等.胸腹腔鏡聯合Ivor-Lewis手術治療 食管胸中下段癌可行性、安全性及近期療效觀察〔J〕.海南醫學,2017,28(4):575-577.
[2] Chen L,Liu X,Wang R,et al.Minimally invasiveesophagectomy for esophageal cancer according to the location of the tumor:Experience of 251 patients〔J〕.Ann Med Surg (Lond),2017,1(17):54-60.
[3] Giugliano DN,Berger AC,Meidl H,et al.Do intraoperative pyloric interventions predict the need forpostoperative endoscopic interventions after minimally invasive esophagectomy?〔J〕.Dis Esophagus,2017,30(4):1-8.
[4] 劉海峰,申成玉,王獻增,等.Ivor-Lewis和Sweet術式治療食管中、下段癌的臨床研究〔J〕.長治醫學院學報,2017,31(1):43-46.
[5] 景向永.改良Ivor-Lewis術式與左開胸術式在治療中下段食管癌的療效〔J〕.包頭醫學院學報,2017,33(4):57-58.
[6] Zhang H,Chen L,Geng Y,et al.Modified anastomotic technique forthoracolaparoscopic Ivor-Lewis esophagectomy: early outcomes and technicaldetails〔J〕.Dis Esophagus,2017,30(5):1-5.
[7] 馬明全,姜宏景,唐 鵬,等.胸腔鏡微創與開放食管癌根治術圍手術期并發癥和淋巴結清掃情況的回顧性比較〔J〕.中華胸心血管外科雜志,2015,31(5):260-263.
[8] 韋海濤,李 麗,王作培,等.全胸腔鏡手術與傳統開胸手術治療食管癌近期臨床療效比較〔J〕.中華胸心血管外科雜志,2015,31(2):108-109.
[9] Blakely AM,Ajmal S,Sargent RE,et al.Critical analysis of feedingjejunostomy following resection of upper gastrointestinal malignancies〔J〕.World J Gastrointest Surg,2017,9(2):53-60.
[10] 翁文俊,侯宜軍,李劍鋒.Ivor-Lewis 和 Sweet 術式在中下段食管鱗癌根治術的應用〔J〕.江蘇醫藥,2016,42(24):2708-2710.
[11] Yan L,Wu M,Ba N,et al.Efficacy of dendritic cell-cytokine-induced killer immunotherapy plus intensity-modulated radiation therapy in treating elderly patients with esophageal carcinoma〔J〕.Genet Mol Res,2015,14(1):898-905.
[12] Shen C,Yang H,Zhang B,et al.Improved quality of life in patients with adenocarcinoma of esophagogastric junction after gastric tube reconstruction〔J〕.Hepatogastroenterology,2013,60(128):1985-1989.
[13] 蔡華新,黃燦華,陳志杰,等.不同手術路徑治療胸中段食管癌的療效分析〔J〕.癌癥進展,2016,14(9):904-906,909.
[14] Brown AM,Pucci MJ,Berger AC,et al.A standardized comparison of peri-operative complications after minimallyinvasive esophagectomy: Ivor Lewis versus McKeown〔J〕.Surg Endosc,2017,1(22):99-108.
[15] 申文明,林 琪,岑浩鋒.不同手術方法治療食管癌的療效比較及對肺功能的影響〔J〕.中國現代醫生,2014,52(8):28-30.
[16] Giacopuzzi S,Weindelmayer J,Treppiedi E,et al.Enhanced recovery after surgery protocol in patientsundergoing esophagectomy for cancer:a single center experience〔J〕.Dis Esophagus,2017,30(4):1-6.
[17] Linson J,Latzko M,Ahmed B,et al.Minimally invasive Ivor-Lewisesophagectomy for esophageal cancer with right aortic arch〔J〕.J Gastrointest Oncol,2017,8(1):E1-E2.
[18] 莊曉飛,廉建紅,張雙平,等.胸腔鏡聯合腹腔鏡食管癌切除108例〔J〕.腫瘤研究與臨床,2015,27(5):347-349.
[19] Zhao T,Kong FW,Wang H,et al.A long-termsurvivor with esophageal melanoma and pulmonary metastasis after single-stageesophagectomy and lobectomy:Case report and literature review〔J〕.Medicine(Baltimore),2017,96(21):e7003.
[20] 薛肖雷.左右胸不同路徑手術對胸中段食管癌患者的治療效果對比研究〔J〕.中國醫藥導刊,2016,18(3):219-220.
[21] Faber J,Uitdehaag MJ,Spaander M,et al.Improved body weight and performance status and reduced serum PGE2 levels after nutritional intervention with a specific medical food in newly diagnosed patients with esophageal cancer or adenocarcinoma of the gastro-esophageal junction〔J〕.J Cachexia Sarcopenia Muscle,2015,6(1):32-44.

