功能化納米石墨烯在腫瘤診斷方面的應用研究進展
,,
(1.商洛學院,陜西 商洛 726000; 2.中國科學院成都有機化學研究所,四川 成都 610041)
1 引 言
納米石墨烯是一種由碳原子以sp2雜化軌道組成六角形呈蜂巢晶格的單層片狀結構的新材料(如圖1(A)),它是世界上最薄的新型二維納米材料,只有一個碳原子的厚度,其厚度約為0.35nm[1-2]。
石墨烯發現10年來,由于其具有優異的電學、力學和熱學性質,已經被廣泛地應用于復合材料、傳感器、能源等領域[3]。目前,有關石墨烯鋰離子電池電極材料、超級電容器、太陽能電池電極材料、儲氫材料、光學材料等的報道較多[3-9]。而石墨烯在生物醫藥領域應用的研究是最近這些年才開始的,目前相關報道還比較少,但是發展十分迅速[10-13]。
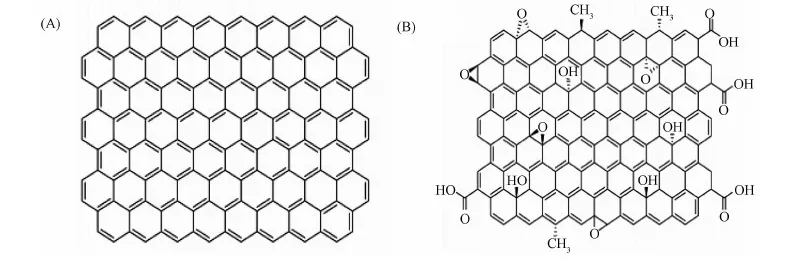
圖1 石墨烯及其衍生物的分子結構 ( A)碳原子以sp2雜化軌道組成的單層結構的石墨烯;(B)碳原子以sp2或sp3雜化軌道組成的含有羰基、環氧基和叔羥基官能團結構的氧化石墨烯Fig.1 Graphene and its derivatives A) A graphene sheet consisting of carbon atoms of sp2 hybridization B) Graphene oxide sheet consisting of either sp2 or sp3 hybridization, due to their derivatization with carbonyls, epoxides and tertiary alcohol functional groups
目前以石墨為原料制備石墨烯的方法主要有微機械剝離法、SiC熱解外延生長法、化學氣相沉積法、化學氧化還原法等。由于制備的石墨烯化學穩定性高,其表面呈惰性,與其他介質的相互作用較弱,難溶于水及常用的有機溶劑。功能化是實現石墨烯分散、溶解和成型加工的重要手段。由于分子表面具有很多親水性官能團,且表面積較大,功能化納米石墨烯可以被用作各種生物分子載體進行生物檢測、藥物和基因輸送[14-19]。在生物醫藥領域應用較多的石墨烯衍生物主要是功能化的氧化石墨烯GO[20]。因氧化條件的不同,所獲得的氧化石墨烯尺寸一般在十納米到幾百納米乃至微米之間[21]。氧化石墨烯(圖1(B))含有大量的含氧活性基團,如羰基、羧基、羥基與環氧基等。環氧基與羥基主要位于氧化石墨烯的基面上,而羰基與羧基則通常分布在氧化石墨烯的邊緣處[22-23]。由于含有大量的含氧活性基團,因此它具有良好的生物相容性和水溶液穩定性,同時有利于化學功能化修飾,從而減少納米材料對生物大分子和細胞的非特異性吸附。
近年來,功能化納米石墨烯有望在生物醫學,包括生物元件、微生物檢測、疾病診斷和藥物輸運系統等方面獲得應用(圖2)[24],使其成為納米生物醫學領域研究的熱點。本文將簡述功能化納米石墨烯在腫瘤診斷方面的應用及在體內體外的行為和潛在毒性的研究進展,并指出其現有研究中的不足。
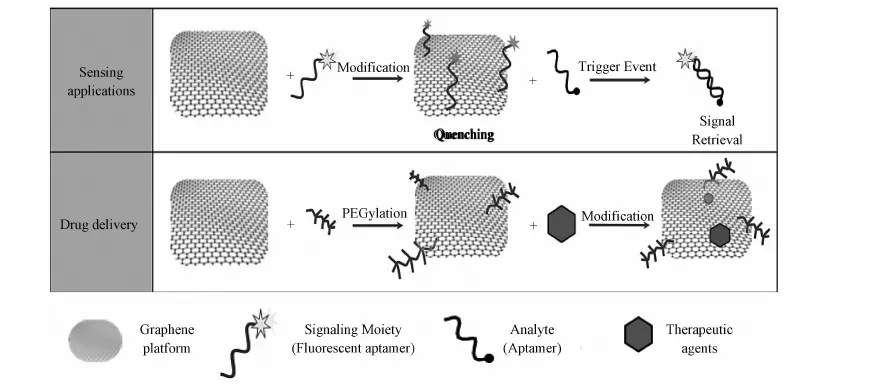
圖2 石墨烯及其衍生物在生物傳感器及藥物傳遞等生物醫藥方面的應用Fig.2 Biomedical applications of graphene related materials including sensing applications, drug delivery
2 功能化納米石墨烯在腫瘤治療方面的應用
氧化石墨烯及其衍生物應用于生物醫藥領域之前,必須對其進行良好的表面修飾。比如還原的氧化石墨烯由于在還原過程中失去了許多含氧親水基團,從而導致其在水溶液中以顆粒形式存在。雖然制備的氧化石墨烯能夠在水溶液中保持很好的穩定性,但是GO表面帶有羧基等含氧基團,整體帶負電荷,在生理溶液中比如PBS、生理鹽水以及細胞培養基中會出現鹽析現象而發生聚沉。只有通過良好的表面修飾才能提高納米氧化石墨烯材料在生物體內的穩定性以及控制其在體內的行為。由于氧化石墨烯邊緣和缺陷位置暴露出許多具有活性的化學基團像羧基、環氧基和羥基等,這些基團可以通過共價連接來使其得到修飾。在2008年,Dai和他的科研人員[25]第一次使用氨基端支鏈PEG來修飾氧化石墨烯,將其作為難溶性含芳香結構的抗癌藥物載體,主要利用PEG的氨基和氧化石墨烯表面的羧基相連,從而獲得PEG修飾的氧化石墨烯(nGO-PEG)(10~50nm)。nGO-PEG在各種生理溶液中都顯示出非常好的穩定性。
在2012年,劉莊課題組[26-27]使用支鏈狀PEG(C18PMH-PEG)來修飾nRGO,從而獲得具有非常穩定的nRGO-PEG(圖3)。nRGO-PEG具有超長的血液循環時間和超高的腫瘤被動富集,可以用于腫瘤的光熱治療,這進一步促進了功能化納米石墨烯在腫瘤治療中的應用。
2.1 光熱治療(PTT)
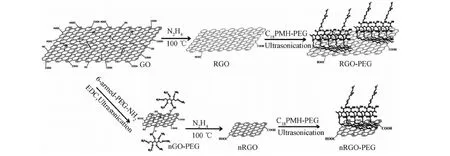
圖3 支鏈狀PEG連接到納米石墨烯表面的示意圖Fig.3 A scheme showing the preparation of nGO-PEG, RGO-PEG, and nRGO-PEG from GO
PTT是利用光吸收物質在激光照射下產生能量,導致腫瘤細胞局部高溫,從而殺死腫瘤細胞。光熱治療作為一種微創傷的腫瘤治療手段受到廣泛的關注。光熱治療需要兩大關鍵條件:(1)是近紅外光,它具有較強的組織穿透能力和較低的組織吸收率。因此它能穿透深層組織,到達生物體很多部位,從而可以充分發揮治療作用。而且激光光源可以特定地照射腫瘤部位,這樣可以避開較多的正常組織進行局部治療。這些特征為光熱治療的安全性提供了基本保證。(2)是光熱材料,它是指對近紅外光有高強吸收,并能將吸收的光能轉化成熱量釋放出來的材料。目前,很多種具有強近紅外吸收的納米材料包括金納米顆粒、碳納米材料甚至還有一些有機納米顆粒都可以作為光熱試劑用于腫瘤光熱治療。
然而,在臨床上,腫瘤的光熱治療有一個主要的缺陷,就是激光有限的穿透力使得在身體深處的腫瘤或者體積比較大的腫瘤無法完全治愈。除了光的穿透力以外,還需要相對高的激光功率產生足夠的熱能殺死腫瘤細胞。因此,如果使用超小功率達到有效的腫瘤光熱治療,就可以避免激光對正常組織的傷害。
科研工作者發現納米石墨烯在近紅外區(700~1100nm)有強的吸收。在過去的幾年里,科研人員對基于納米石墨烯的光療產生了濃厚的興趣。PEG修飾的GO和RGO具有很強的近紅外吸收,在腫瘤的光熱治療方面展現出了優勢[25,28]。
由于nGO-PEG具有高的腫瘤被動富集和超強的近紅外吸收,Liu和他的科研人員[29]以nGO-PEG作為一種光熱試劑對腫瘤細胞進行光熱治療。研究結果發現,所有nGO-PEG處理組的腫瘤在激光照射以后1天都消失了,留下黑色燒傷的疤,一個星期以后完全脫落。在其他三組對照組中,注射生理鹽水對照組、nGO-PEG而沒有光照的組和只有光照組的小鼠腫瘤顯示出相似的快速生長,這表明光照和nGO-PEG都不影響腫瘤的生長。這一結果證實了nGO-PEG作為光熱試劑得到了極為高效的腫瘤消除(圖4)。
在2010年,Liu等[29]第一次研究了使用PEG包被熒光標簽的納米石墨烯片(NGS)在體內的作用。研究結果發現:相比于碳納米管,PEG功能化的NGS展現了一些有趣的體內表征現象,包括高效率腫瘤被動靶向識別以及在材料網狀內皮組織中相對較低殘留。通過利用體內光熱療法中NGS在NIR光區的高光吸收,在靜脈注射NGS并在腫瘤移植部位用2W/cm2的808nm的近紅外激光照射腫瘤5min,經nGO-PEG處理的小鼠表面溫度升高到50℃,而對照組小鼠腫瘤表面只升高了2℃。而且所有在接下來40天的培養時間里,nGO-PEG和光處理的小鼠沒有再長出腫瘤。
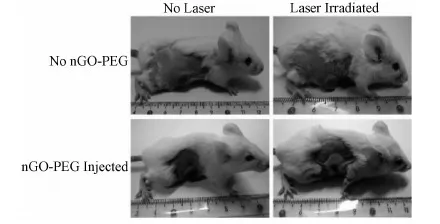
圖4 通過注射nGO-PEG作為光熱試劑得到活體腫瘤的光熱實驗示意圖Fig.4 Representative photoes of tumors on mice after various treatments indicated in vivo photothermal therapy study using intravenously injected nGo-PEG
最近,Dai課題組[30]發現將nGO-PEG還原可以得到一種超小尺寸的RGO,再用磷脂PEG修飾得到水溶性nRGO-PEG,它在近紅外區的光吸收明顯比nGO-PEG高很多,然后將多肽RGD連接到nRGO-PEG上獲得nRGO-PEG-RGD復合物,可以作為一種具有靶向性的光熱試劑進行選擇性地殺死腫瘤細胞。
2.2 光動力治療(PDT)
與光熱治療不同,光動力治療依賴光敏分子在適當光照下產生的單線態氧來殺死腫瘤細胞[31]。基于納米石墨烯的光動力治療工作是由Shi課題組首先開發的[32]。他們將光敏分子ZnPc通過π-π堆積和疏水作用力連接到nGO-PEG表面。然而,獲得的nGO-PEG-ZnPc在氙燈照射下顯示出顯著的細胞毒性。Huang et al.[33]將Ce6連接到接有葉酸的GO上實現葉酸受體靶向輸送到腫瘤細胞內,然后使用633nmHe-Ne激光照射達到有效的腫瘤細胞光動力治療。除此之外,Hu等[34]還發現GO-TiO2復合物在可見光照射下可實現光動力活性,這種光動力活性會顯著降低線粒體膜電位,激活超氧化物歧化酶、過氧化氫酶、谷胱甘肽過氧化物酶以及增加丙二醛的量,從而誘導腫瘤細胞凋亡。
2.3 基于納米石墨烯的聯合治療
基于功能化納米石墨烯腫瘤治療的多功能性,可以進行腫瘤的聯合治療。通過π-π堆積作用,Liu課題組[35]將光敏分子Ce6裝載到nGO-PEG表面,形成nGO-PEG-Ce6復合物。在激光照射下,nGO-PEG-Ce6復合物可以產生單線態氧用于腫瘤光動力治療。同時,研究還進一步發現,與單獨的Ce6相比,nGO-PEG-Ce6能夠顯著提高腫瘤細胞的光動力殺傷效率。這可能是由于nGO-PEG在近紅外的強吸收性質,在nGO-PEG的幫助下,增加細胞膜的通透性,從而顯著促進細胞吞噬nGO-PEG-Ce6的量。通過光熱和光動力兩種手段的協同作用,進一步增強對腫瘤細胞的光動力治療效果(圖5)。
nGO-PEG的光熱治療效果也可以與化療結合在一起實現聯合治療。Zhang et. al.將DOX裝載到nGO-PEG表面進行化療,然后利用nGO-PEG的近紅外吸收,實現了腫瘤的光熱治療-化療的協同效應[26]。與單獨的熱療或者化療相比,這種化療-熱療的聯合治療在小鼠腫瘤上實現了很高的治愈率(圖6)。
3 納米石墨烯的生物安全性
納米材料的安全性對于他們在生物醫學上的應用是至關重要的。納米石墨烯和許多無機納米材料一樣,都不容易被降解。因此,納米石墨烯在生物體中的行為以及潛在的毒性,是需要解決的重中之重。
Zhang et al.[36]比較了不同類型的碳納米材料包括納米金剛石、碳納米管及GO對HeLa細胞的毒性。研究結果顯示,GO相對于其它兩種材料顯示出最低的細胞吞噬率,但是三種材料對細胞都顯示出同樣的濃度依賴性毒性。Lu等也對納米石墨烯的細胞毒性進行了研究。實驗發現,當NGO濃度達到100mg/L時,細胞的相對存活率仍接近100%,這說明NGO對細胞毒性較低。Zhang課題組研究發現,葉酸修飾的NGO在濃度高達100μg/mL時,仍沒有明顯的細胞毒性[37]。Peng等[38]研究了氧化石墨烯復合物用于熒光探針進行細胞成像的生物安全性,結果表明該復合材料未表現出嚴重的細胞毒性,濃度為40μg/mL時僅使細胞的新陳代謝活性略有下降,而且這種中毒細胞的毒作用是可以逆轉的,其代謝活性可以恢復。
Liao et al.等[39]也發現小尺寸的GO能夠顯著引起溶血,但是如果用殼聚糖修飾GO將會完全消除溶血現象。納米石墨烯和沒有表面修飾的GO對各類型細胞的毒性是濃度依賴性的。相反,GO經過適當的親水大分子修飾如殼聚糖[40]、PEG、葡聚糖[41]和一些蛋白質修飾以后顯著地降低了GO的細胞毒性。Hu et.al.[42]發現細胞培養液中FBS也能降低GO的毒性。GO可以通過靜電和疏水作用力吸附蛋白,從而阻礙GO與細胞直接接觸,進而減小對細胞的毒性。Liu課題組[43]還進一步研究了功能化納米石墨烯在體內的長期分布和長期毒性,發現使用生物相容性高分子如PEG修飾GO,通過尾靜脈注射入小鼠體內,放射性核素標記的PEG修飾的納米石墨烯主要聚集在肝脾部位,但是可以通過尿液和糞便慢慢排出體外。通過對處理組小鼠的血常規和血生化指標進行測定,發現在90天的時間里,PEG修飾的納米石墨烯在20mg/kg的劑量下并沒有對實驗小鼠的肝功能和腎功能造成明顯的毒性傷害。
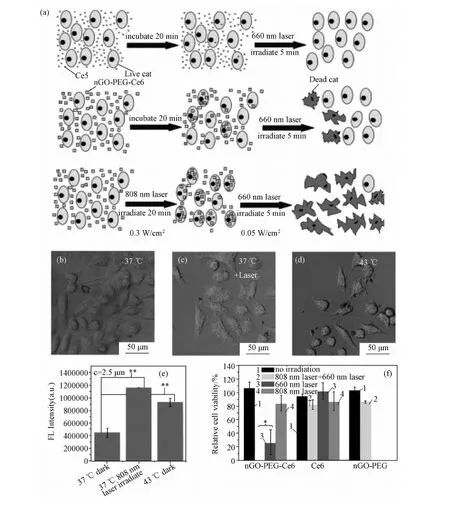
圖5 光熱促進光動力治療示意圖。(a)光熱促進光動力治療示意圖;(b~d):KB細胞與nGO-PEG-Ce6在37℃培養后沒有808nm激光照射(b)或有808nm激光照射(c)以及細胞在43℃的激光共聚焦照片(d);(e)在Ce6濃度為2.5μm下,細胞在不同條件下吞噬nGO-PEG-Ce6的量;(f)KB細胞在Ce6濃度為2.5μm下與nGO-PEG-Ce6,Ce6和nGo-PEG培養下的相對細胞活度Fig.5 Photothermally enhanced photodynamic therapy. Ce6 loaded nGO-PEG(nGO-PEG-Ce6) was used in this study. (a)A scheme of photothermally enhanced photodynamic therapy. (b-d)Confocal fluorescent images of KB cells incubated with nGO-PEG-Ce6 at 37℃ without (b) or with 808nm laser irradiation(c), and cells incubated at 43℃(d). (e)Cell uptake of nGO-PEG-Ce6 in different treatment groups at the Ce6 concentration of 2.5μm. The concentration of Ce6 was determined by the measured fluorescence intensities of cell lysate samples. (f)Relative viabilities of KB cells treated with nGO-PEG-Ce6, Ce6 and nGO-PEG at Ce6 concentration of 2.5μm
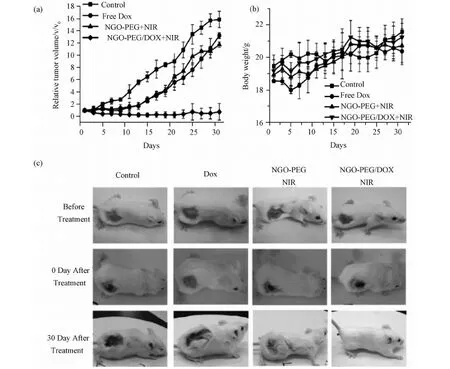
圖6 使用nGO-PEG進行的熱療和化療的聯合治療。(a)不同處理組小鼠腫瘤的生長曲線。在DOX和nGO-PEG/DOX處理組的DOX濃度為10mg/kg,激光功率為2W/cm2,照射時間為5min;(b)各個處理組小鼠的體重變化曲線,沒有觀察到明顯的體重下降;(c)不同處理組代表小鼠的照片Fig.6 Combined photothermal therapy and chemotherapy using nGO-PEG. (a)Tumor growth curves of different groups of mice after various treatments indicated. The drug dose in free DOX and nGO-PEG/DOX groups was 10mg/kg in terms of DOX. The laser irradiation was applied at the power density of 2W/cm2 for 5min. (b)Body weights of mice in different treated groups. No obviously weight loss was observed. (c)Photos of mice after different treatments indicated. Tumors of mice treated with NGO-PEG/DOX+NIR laser were completely ablated after 30 days
4 總結與展望
通過良好的表面修飾來提高納米石墨烯材料在生物體內的穩定性和相容性以及控制在體內的行為,使得功能化納米石墨烯應用于生物醫藥領域成為可能。目前,功能化納米石墨烯在腫瘤治療方面已經取得了一些進展,但大多處于起步階段,還不夠深入、系統。總之,尚需要在分子、細胞及器官乃至整個生物體層次上,深入研究納米石墨烯及其衍生物與生物體系的相互作用機制,為納米石墨烯在生物醫藥領域的應用提供理論依據。
目前制備的納米石墨烯在尺寸上分布比較寬(從10nm~50nm不等),這間接地影響了納米石墨烯的尺寸效應在生物體內的行為;現在,大多數研究都采用PEG來修飾納米石墨烯,從而獲得生物相容性較好的功能化納米石墨烯,并將其應用于腫瘤治療,這也需要進一步開發出更多更好的表面修飾高分子,以便提高在腫瘤部位的富集量。雖然科研人員已經從器官的組織學及血液學上宏觀地探究了功能化納米石墨烯在體內的長期分布和長期毒性,但尚未從分子水平上研究功能化納米石墨烯對基因調控和蛋白表達的影響。科研人員對這種新型的碳納米材料還需作出更多的長期研究。
[1] K. S. Novoselov, A. K. Geim, S. V. Morozov, et al. Electric Field Effect in Atomically Thin Carbon Films [J]. Science, 2004, 306: 666~669.
[2] Changgu Lee, Xiaoding Wei, Jeffrey W. Kysar, James Hone. Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene [J]. Science, 2008, 321: 385~388.
[3] 徐馳,朱和國. 石墨烯的制備及其在能源方面的應用研究進展[J]. 材料科學與工程學報,2016, 34(2): 326~332.
[4] Zhong-Shuai Wu, Wencai Ren, Lei Wen, et al. Graphene Anchored with Co3O4Nanoparticles as Anode of Lithium Ion Batteries with Enhanced Reversible Capacity and Cyclic Performance [J]. ACS Nano, 2010, 4 (6): 3187~3194.
[5] Hailiang Wang, Li-Feng Cui, Yuan Yang, et al. Mn3O4-Graphene Hybrid as a High-Capacity Anode Material for Lithium Ion Batteries [J]. J. Am. Chem. Soc., 2010, 132(40): 13978~13980.
[6] F. Kim, J. Luo, R. Cruz-Silva, et al. Self-Propagating Domino-like Reactions in Oxidized Graphite [J]. Adv. Funct. Mater., 2010, 20(17): 2867~2873.
[7] K.P. Loh, Q. Bao, G. Eda, M. Chhowalla. Graphene Oxide as a Chemically Tunable Platform for Optical Applications [J]. Nat. Chem., 2010, 2(12): 1015~1024.
[8] A.K. Geim, K.S. Novoselov. The Rise of Graphene [J]. Nat. Mater., 2007, 6(3): 183~191.
[9] H. Wang, Y. Liang, T. Mirfakhrai, et al. Advanced Asymmetrical Supercapacitors Based on Graphene Hybrid Materials [J]. Nano Res., 2011, 4(8): 729~736.
[10] Y. Wang, Y. Xiao, X. Ma, N. Li, X. Yang. Label-free and Sensitive Thrombin Sensing on a Molecularly Grafted Aptamer on Graphene [J]. Chem. Commun., 2012, 48(5): 738~740.
[11] H. Wang, Q. Zhang, X. Chu, T. Chen, J. Ge, R. Yu. Graphene Oxide-peptide Conjugate as an Intracellular Protease Sensor for Caspase-3 Activation Imaging in Live Cells [J]. Angew. Chem. Int. Ed., 2011, 50(31): 7065~7069.
[12] A. Bonanni, M. Pumera. Graphene Platform for Hairpin-DNA- Based Impedimetric Genosensing [J]. ACS Nano, 2011, 5(3): 2356~2361.
[13] M. Giovanni, A. Bonanni, M. Pumera. Detection of DNA Hybridization on Chemically Modified Graphene Platforms [J]. Analyst, 2012, 137(3): 580~583.
[14] Z. Liu, J.T. Robinson, et al. PEGylated Nanographene Oxide for Delivery of Water-Insoluble Cancer Drugs [J]. J. Am. Chem. Soc., 2008, 130(33): 10876~10877.
[15] L. Feng, S. Zhang, Z. Liu. Graphene Based Gene Transfection [J]. Nanoscale, 2011, 3(3): 1252~1257.
[16] S. He, B. Song, D. Li, et al. A Graphene Nanoprobe for Rapid, Sensitive, and Multicolor Fluorescent DNA Analysis [J]. Adv. Funct. Mater., 2010, 20(3): 453~459.
[17] L.A.L. Tang, J. Wang, K.P. Loh. Graphene-Based SELDI Probe with Ultrahigh Extraction and Sensitivity for DNA Oligomer [J]. J. Am. Chem. Soc., 2010, 132(32): 10976~10977.
[18] L. Zhang, J. Xia, Q. Zhao, L. Liu, Z. Zhang. Functional Graphene Oxide as a Nanocarrier for Controlled Loading and Targeted Delivery of Mixed Anticancer Drugs [J]. Small, 2010, 6(4): 537~544.
[19] L. Zhang, Z. Lu, Q. Zhao, J. Huang, H. Shen, Z. Zhang. Enhanced Chemotherapy Efficacy by Sequential Delivery of SiRNA and Anticancer Drugs using PEI-grafted Graphene Oxide [J]. Small, 2011, 7(4): 460~464.
[20] 邵偉力,桑鋒,何書杰,錢潔玉,李強,王倩. 氧化石墨烯增強的骨仿生靜電紡左旋聚乳酸納米纖維支架的制備及表征[J]. 材料科學與工程學報,2016, 34(4): 535~539.
[21] Guohua Chen, Wengui Weng, Dajun Wu, et al. Preparation and Characterization of Graphite Nanosheets from Ultrasonic Powdering Technique [J]. Carbon, 2004, 42(4): 753~759.
[22] Hae-Kyung Jeong, Yun Pyo Lee, Rob J. W. E. Lahaye, et al. Evidence of Graphitic AB Stacking Order of Graphite Oxides [J]. J. Am. Chem. Soc., 2008, 130(4): 1362~1366.
[23] A. Barinov, B. Malciogluo, S. Fabris. Initial Stages of Oxidation on Graphitic Surfaces: Photoemission Study and Density Functional Theory Calculations [J]. J. Phys. Chem. C, 2009, 113(21): 9009~9013.
[24] D. Bitounis, H.A. Boucetta, B.H. Hong, et al. Prospects and Challenges of Graphene in Biomedical Applications [J]. Adv. Mater., 2013, 25(16): 2258~2268.
[25] Z. Liu, J.T. Robinson, et al. PEGylated Nanographene Oxide for Delivery of Water-Insoluble Cancer Drugs [J]. J. Am. Chem. Soc., 2008, 130(33): 10876~10877.
[26] K. Yang, J. Wan, S. Zhang, et al. The Influence of Surface Chemistry and Size of Nanoscale Graphene Oxide on Photothermal Therapy of Cancer using Ultra-low Laser Power [J]. Biomaterials, 2012, 33(7): 2206~2214.
[27] K. Yang, L. Hu, X. Ma, et al. Multimodal Imaging Guided Photothermal Therapy using Functionalized Graphene Nanosheets Anchored with Magnetic Nanoparticles [J]. Adv. Mater., 2012, 24(14): 1868~1872.
[28] J.H. Jung, D.S. Cheon, F. Liu, K.B. Lee, T.S. Seo. A Graphene Oxide Based Immuno-biosensor for Pathogen Detection [J]. Angew. Chem., Int. Ed., 2010, 49(33): 5708~5711.
[29] K. Yang, S. Zhang, G. Zhang, et al. Graphene in Mice: Ultrahigh in Vivo Tumor Uptake and Efficient Photothermal Therapy [J]. Nano Lett., 2010, 10(9): 3318~3323.
[30] J.T. Robinson, S.M. Tabakman, Y.Y. Liang, et al. Ultrasmall Reduced Graphene Oxide with High Near-Infrared Absorbance for Photothermal Therapy [J]. J. Am. Chem. Soc., 2011, 133(17): 6825~6831.
[31] D. Dolmans, D. Fukumura, R.K. Jain. Photodynamic Therapy for Cancer [J]. Nat. Rev. Cancer, 2003, 3(5): 380~387.
[32] H. Dong, Z. Zhao, H. Wen, et al. Poly(ethylene glycol) Conjugated Nano-graphene Oxide for Photodynamic Therapy [J]. Sci. China: Chem., 2010, 53(11): 2265~2271.
[33] P. Huang, C. Xu, J. Lin, et al. Folic Acid-conjugated Graphene Oxide loaded with Photosensitizers for Targeting Photodynamic Therapy [J]. Theranostics, 2011, 1(1): 240~250.
[34] Z. Hu, Y. Huang, S. Sun, et al. Visible Light Driven Photodynamic Anticancer Activity of Graphene oxide/TiO2Hybrid [J]. Carbon, 2012, 50(3): 994~1004.
[35] B. Tian, C. Wang, S. Zhang, et al. Photothermally Enhanced Photodynamic Therapy Delivered by Nano-Graphene Oxide [J]. ACS Nano, 2011, 5(9): 7000~7009.
[36] X. Zhang, W. Hu, J. Li. A Comparative Study of Cellular Uptake and Cytotoxicity of Multi-walled Carbon Nanotubes, Graphene Oxide, and Nanodiamond [J]. Toxicol. Res., 2012, 1(1): 62~68.
[37] C.H. Lu, C.L. Zhu, J. Li. Using Graphene to Protect DNA from Cleavage During Cellular Delivery [J]. Chem. Commun., 2010, 46(18): 3116~3118.
[38] C. Peng, W.B. Hu, Y.T. Zhou. Intracellular Imaging with a Graphene-based Fluorescent Probe [J]. Small, 2010, 6(15): 1686~1692.
[39] K.H. Liao, Y.S. Lin, C.W. Macosko. Cytotoxicity of Graphene Oxide and Graphene in Human Erythrocytes and Skin Fibroblasts [J]. ACS Appl. Mater. Interface, 2011, 3(7): 2607~2615.
[40] H. Bao, Y. Pan, T. Wu, L. Li, L.H. Gan. Chitosan-functionalized Graphene Oxide as a Nanocarrier for Drug and Gene Delivery [J]. Small, 2011, 7(11): 1569~1578.
[41] Shuai Zhang, Kai Yang, Liangzhu Feng, Zhuang Liu. In Vitro and in Vivo Behaviors of Dextran Functionalized Graphene [J]. Carbon, 2011, 49(12): 4040~4049.
[42] Wenbing Hu, Cheng Peng, Min Lv, et al. Protein Corona-Mediated Mitigation of Cytotoxicity of Graphene Oxide [J]. ACS Nano, 2011, 5(5): 3693~3700.
[43] K. Yang, H. Xu, L. Cheng, et al. In Vitro and in Vivo Near-infrared Photothermal Therapy of Cancer using Polypyrrole Organic Nanoparticles [J]. Adv. Mater., 2012, 24(41): 5586~5592.

