IMRT聯合TP方案治療局部晚期食管鱗癌療效及安全性研究
許俐文 丁 婷 姚曉丹 王 純
食管癌是臨床常見的惡性腫瘤之一,早期可無癥狀或癥狀輕微,若發展到進行性吞咽困難已屬中晚期,許多已失去手術機會,尤其是患者,確診時只有不到10%的病例可以做根治性切除。放療是食管癌的主要治療手段,但僅靠單一常規放療,5年生存率一直在10%左右,其主要原因為局部復發或未控[1]。目前化療是除手術治療以外臨床上公認的最有效治療方法之一,雖近期效果顯著,但是遠期效果仍然不佳,加上化療治療之后患者復發率較高,多數患者需要接受多次的化療治療,副作用較大,給患者的精神與身體帶來了一定的負擔與壓力,且治療費用較為昂貴[2-3]。近年來調強放療(intensity modulated radiation therapy,IMRT)技術臨床應用越來越廣泛,在減輕不良反應及提高療效等方面,較常規放療技術優勢,尤其在食管癌患者放棄手術前提下更具優勢,能夠在采用高劑量照射時仍然保護周圍組織,對局部的治療更加精確[4]。因此我們在臨床充不斷摸索和改進治療方案,盡可能的改善其生存質量并延長患者生存期,提高藥物治療的安全性及有效性。近年來我院采用聯合放化療治療的方法,予適形調強放療聯合TP方案化療治療晚期肺鱗癌,取得了較為滿意的效果,本文采用瞻性研究,旨在探討該聯合治療療效,現報告如下。
1 資料與方法
1.1 一般資料
選取2015年6月至2016年7月我院收治的局部食管鱗癌晚期76例患者。納入標準:①纖維胃鏡確診食管癌,經肝臟B超、胸片等影像學檢查無遠處轉移[5],病理類型均為鱗癌,臨床分期為Ⅱ期、Ⅲ期;②KPS評分≥80分[6]; ③年齡為40~68歲;④入院前均未接受過放治療及其他抗腫瘤治療及手術治療;⑤患者心肺功能、血常規、肝腎功能能耐受本方案。隨機分為兩組,對照組年齡40~62歲,平均年齡(54.8±7.8)歲,男性20例,女性18例;臨床分期Ⅲ期20例,Ⅱ期18例;觀察組年齡40~62歲,平均年齡(53.1±6.7)歲,男性19例,女性19例;臨床分期為Ⅲ期21例,Ⅱ期17例。兩組患者一般資料及疾病的基線水平等差異無統計學意義。見表1。

表1 兩組患者一般資料/例
1.2 方法
對照組:TP組患者治療第1天,靜脈滴注70 mg/(m·d)順鉑+150 ms/(m·d)紫杉醇進行化療。化療4個周期,每個周期21天。
觀察組:體模固定體位,CT模擬定位后重建圖象上勾畫靶區。靶區定義:大體腫瘤區(gross tumor volume,GTV):包括食管腫瘤病灶GTV和食管旁腫大淋巴結GTVnd。GTV根據電子胃鏡、食管造影片和CT檢查結果共同確定上下界;GTVnd勾畫標準:短徑≥0.5 cm。臨床腫瘤區(clinical tumor volume,CTV):軸向在GTV外擴5~10 mm,縱向包括GTV外30 mm食管及食管旁組織,不包括區域淋巴結,如有組織屏障的適當修改外擴范圍。計劃靶區(planning target volume,PTV):分別以GTV(包含GTVnd)及CTV為基礎均勻外擴5 mm生成PTV-GTV及PTV。脊危及器官劑量限制:脊髓最大劑量<50 Gy,肺受照超過20 Gy以上的體積百分比V20≤25%、受照超過30 Gy以上的體積百分比V30≤20%,以上作為約束條件進行優化。用PrrVl平均劑量歸一處方劑量。靶區目標:PTV-GTV平均劑量60 Gy/30次;PTV2劑量為54Gy/30次。限定子野總數<50個,子野面積>14 cm2,子野劑量≥5 MU。直線加速器6MV-X線每周治療5 天,每天1次。物理師完成適形計劃經副主任醫師以上醫生確認、CT模擬復位、加速器驗證后實施治療。每21天為1個周期,一共給予2個周期化療。
1.3 觀察和評價指標
出院后進行隨訪,記錄患者各項指標及不良反應、生存情況。根據世界衛生組織(WHO)《實體瘤療效評價標準》[7],采用WHO制定的《抗癌藥物常見不良反應分級標準》[8]結合影像學檢查、生化指標等進行評價。
治療效果。部分緩解(PR):即靶病灶最大直徑減少至少30%;完全緩解(CR):即所有靶病灶消失,維持超過4周;疾病進展(PD):即靶病灶最大直徑增加超過25%;疾病穩定(SD):即靶病灶增加的程度也沒達到PD水平,減小的程度沒達到PR,處于兩者之間。SD和PD判定為治療無效,CR和PR判定為治療有效。治療有效率=(CR+PR)/患者總數。不良反應。Ⅳ度:出現嚴重的不良反應,Ⅲ度:出現不可耐受的中度不良反應;Ⅱ度:可耐受性的中度不良反應;Ⅰ度:輕度的不良反應;0度:未發生不良反應。生存質量:采用Karnofsky 功能狀態評分評價,于治療前、治療6個月時進行評價。
1.4 統計學方法

2 結果
2.1 兩組患者近期療效
觀察組CR患者顯著多于對照組,對照組治療總有效率為42.11%,觀察組有效率為84.21%,總有效率兩組比較差異顯著(P<0.05),見表2。

表2 兩組患者近期療效比較/例
2.2 生存質量Karnofsky評分比較
治療后6個月后Karnofsky評分觀察組顯著高于對照組,差異具有統計學意義(P<0.05),見表3。
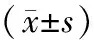
表3 生存質量Karnofsky評分比較
2.3 兩組不良反應發生情況比較
治療1個周期、2個周期后觀察組惡心、嘔吐反應以及粒細胞減少程度與對照組比較,差異無統計學意義 (P>0.05),見表4。

表4 兩組不良反應情況比較/例
2.4 兩組并發癥情況分析
對照組并發癥發生率與觀察組比較,差異無統計學意義(P>0.05),見表5。

表5 兩組并發癥發生情況比較/例
3 討論
食管癌給廣大患者造成巨大威脅,特別是局部晚期食管鱗癌患者,由于局部腫瘤不斷增大,食管癌患者腫瘤生長速度較快,外科手術是食管癌首選的治療方法,而術后轉移和復發情況發生率高[9]。患者即使進行了手術,術后并發癥也較年輕患者多,且恢復慢,加上患者發現的時候往往已經到了晚期,錯過了手術治療的最佳時機。這類患者需要采取化療治療,也是目前公認的治療方法,但是晚期鱗癌患者的身體狀況較差,化療的藥物的毒副作用下,耐受性也隨之降低,很難取得良好的治療效果,若患者能耐受則可在短期內控制腫瘤的生長[10]。
放射治療與手術及化療相比適應證更廣,且治療創傷小,采取局部治療并發癥相對少,因此在食管癌的治療中具有重要地位[11]。但多年來食管癌常規分割放療的生存率沒有明顯提高,5年生存率長期徘徊在8%。主要原因是常規放療技術不能保證腫瘤靶體積達到理想處方劑量,不可避免地使患者部分腫瘤及縱隔轉移淋巴結漏照或處于低劑量區。適形調強放療對病變和劑量進行精確定位和定量,充分利用現代加速器技術、計算機技術和影像學技術,使放療進入了精確擺位、精確定位和精確治療的新階段[12]。IMRT應用在頸段及胸上段食管癌上,與3D-CRT相比,可提高靶區適型性,并更好地保護了脊髓、肺。
研究表明,TP化療方案在鱗癌與非鱗癌的治療表現差異,其中可能是由于非鱗癌大多數是內生性,傾向于深層浸潤,而鱗癌則更加傾向于局部浸潤[13]。而TP化療方案中,紫杉醇主要通過發揮細胞毒性或者對酪氨酸激酶進行激活和基因誘導細胞凋亡來縮小腫瘤病灶和抑制癌細胞擴散[14];結合適行調強放射,將其應用在頸段及胸上段食管癌上,與普通放療相比,可提高靶區適型性,并更好地保護了脊髓、肺。通過本研究結果所示,聯合兩種方法干預可有效提高生存質量及治療有效率。本次研究中,在血液系統毒副反應方面,紅細胞減少和血小板減少發生情況兩組患者的不存在顯著性差異,聯合組患者的骨髓抑制發生率并不會增高;在非血液系統毒副反應方面,放射性損傷、胃腸道反應、周圍神經毒性和肝腎功能損害發生情況兩組患者不存在顯著性差異。說明在本次研究中,兩種新輔助化療方案的不良反應發生情況除了骨髓抑制的發生率外基本一致,而并發癥及不良反應則差異未見統計學意義,結果提示,聯合放化療治療的效果更佳。
綜上所述,調強放療能提高食管鱗癌患者的生存率、緩解進食梗阻癥狀從而提高臨床獲益率,療效明顯優于常規放療、3D-CRT,且安全性高,副作用少,已成為食管鱗癌患者的有效治療手段。聯合TP方案化療應用于晚期肺鱗癌新輔助治療并不會增加不良反應的發生率,且可有效增強提高患者的生存率,有利于改善患者生活質量。但對于如何最正確界定治療靶區、最佳的分割方式和總劑量等問題還有待今后的臨床研究進一步明確。
[1] Li JC,Liu D,Chen MQ,et al.Different radiation treatment in esophgeal carcinoma:a clinical comparative study〔J〕.J BUON,2012,17(3):512-516.
[2] Campbell NP,Villaflor VM.Neoadjuvant treatment of esop-hageal cancer〔J〕.World J Gastroenterol,2010,16(30):3793-3803.
[3] Wolf MC,Stahl M.Curative treatment of oesophageal carcinoma:current options and future developments〔J〕.Radiat Oncol,2011,6(10):55-57.
[4] 祝淑釵,李 任,王玉祥,等.500例中晚期食管癌單純放療的多因素分析〔J〕.中華放射腫瘤學雜志,2005,14(4):253-258.
[5] 中國抗癌協會食管癌專業委員會編.食管癌規范化診治指南〔M〕.中國協和醫科大學出版社,2011:15-16.
[6] 殷蔚伯,谷銑之,劉泰福,等.腫瘤放射治療學〔M〕.第四版.北京:北京醫科大學中國協和醫科大學聯合出版社,2008,561.
[7] 馮奉儀.實體瘤新的療效評價標準(解讀1.1版RECIST標準)〔C〕.第三屆中國腫瘤內科大會論文集,2009: 123-125.
[8] Garaci E,Pica F,Serafino A,et al.Thymosin alphal and cancer:action on immune effector and tumor target cells〔J〕.Ann N Y Acad Sci,2012,1269(1):26-33.
[9] Schrag D,Weiser MR,Goodman KA,et al.Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer:a pilot trial〔J〕.J Clin Oncol,2014,32(6):513-518.
[10] Kim SH,Lee JY,Lee JM,et al.Apparent diffusion coefficient for evaluating tumour response to neoadjuvant chemoradiation therapy for locally advanced rectal cancer〔J〕.Eur Radiol,2011,21(5):987-995.
[11] Van Cutsem E,Dicato M,Geva R,et al.The diagnosis and management of gastric cancer:expert discussion and recommendations from the 12th ESMO/World Congress on Gastrointestinal Cancer,Barcelona,2010〔J〕.Ann Oncol,2011,22(5):1-9.
[12] Wu XX,Sun Y,Guo WJ,et al.Rebuilding the balance of STAT1 and STAT3 signalings by fusaruside,a cerebroside compound,for the treatment of T-cell-mediated fulminant hepatitis in mice〔J〕.Biochem Pharmacol,2012,84(9):1164-1173.
[13] Cathcart MC,Gately K,Cummins R,et al.Thromboxane synthase expression and correlation with VEGF and angiogenesis in non-small cell lung cancer〔J〕.Bba- Mol Basis Dis,2014,1842(5):747-755.
[14] Lin SH,Wang L,Myles B,et al.Propensity score-based comparison of long-term outcomes with 3-dimensional conformal radiotherapy vs intensity modulated radiotherapy for esophageal cancer〔J〕.Int J Radiat Oncol Biol Phys,2012,84(5):1078-1085.

