不同精粗比率日糧對山羊瓣胃上皮細胞增殖的影響
盧勁曄,趙懷寶,顧蓓蓓,馮 晴,張 磊,許 君,沈贊明
(1.南京農業大學動物醫學院,江蘇 南京 210095;2.江蘇農牧科技職業學院,江蘇 泰州 225300;3.連云港東海縣動物衛生監督所,江蘇 連云港 222300)
反芻動物的胃是復胃,由四個胃室組成,分別是瘤胃、網胃、瓣胃和皺胃。其中,瓣胃為第三個胃室,主要起“篩網作用”,進入瓣胃的大顆粒食物在瓣胃肌肉的收縮下被研磨成細小的顆粒。瓣胃是反芻動物特有的、主要的消化和吸收器官之一。研究發現,提高精料飼喂比率后,瘤胃重量提高,而瓣胃重量下降[1]。前期的研究主要集中在提高精料比率后對瘤胃上皮細胞增殖的促進作用,而對瓣胃重量的下降并未進行深入探索,而目前與此相關的報道也很少,并且主要集中在表觀指標的測定,對其機理并未進行闡述和分析。本試驗擬進一步研究不同精粗比日糧對瓣胃上皮生長的影響及其機理。
1 試驗設計
1.1 動物飼養
試驗動物選用健康青年波雜山羊24只(90~120日齡)。試驗開始前適應2周時間,期間對山羊進行驅蟲,山羊自由采食及飲水,逐漸增加精料飼喂量至400 g·d-1。試驗開始后,根據體重相近及公母對半原則,隨機分為純粗料(PS組,n=8)、粗料加低精料(PSLC組,n=8)和粗料加高精料組(PSHC組,n=8)。試驗期間自由飲水及采食花生桿;PSLC組飼喂精料200 g·d-1,PSHC組飼喂精料400 g·d-1,飼喂持續42 d,第43 d屠宰取樣,飼糧營養水平見表1。
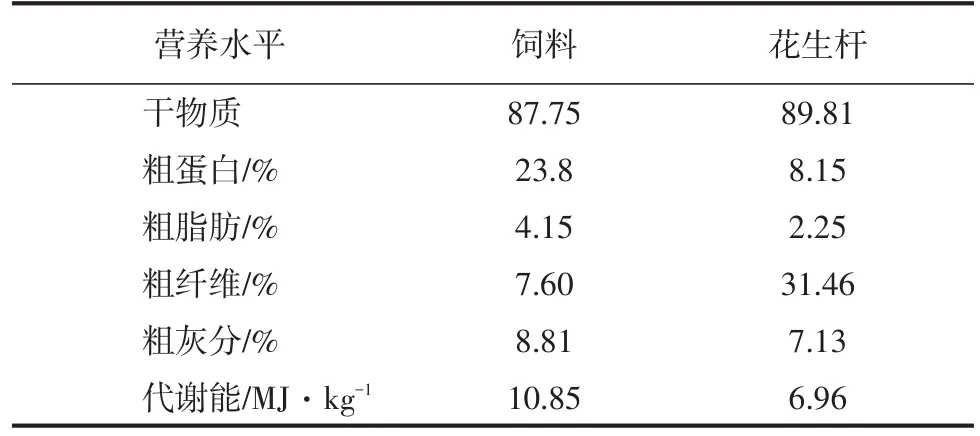
表1 飼糧營養水平 DM
1.2 樣品采集
山羊屠宰后取瓣胃,去除內容物并清洗后稱重,并剪取適量瓣胃葉片,用預冷的PBS(pH7.4)反復沖洗,再用吸水紙擦干,部分樣品用10%福爾馬林溶液固定,部分樣品置于液氮保存。
1.3 血清EGF濃度測定
無菌采血,ELISA試劑盒測定血清EGF濃度,EGF ELISA Kit購自R&D Systems公司。
1.4 瓣胃上皮細胞培養
采取新鮮瓣胃葉片,刷洗干凈,剪取約0.5 g組織,用加入4倍雙抗D-Hanks液漂洗3次,用胰酶水浴消化20 min后棄去上清液,重復3次。再將剩余組織放入無菌燒杯中,4倍雙抗D-Hanks液漂洗3次后,繼續采用胰酶消化,每10 min收集1次消化液。收集的消化液用小牛血清終止消化,并離心得到細胞沉淀。細胞沉淀加入DMEM培養液混勻,調整細胞密度為106個·mL-1,接種于24孔細胞培養板,置于CO2培養箱中培養24 h。
細胞貼壁后分為3組,每組6孔重復。試驗組:培養細胞孔中加入終濃度30和60 ng·mL-1的EGF;對照組:加入等量的DMEM培養液。8 h后收集細胞,PBS(pH7.4)洗滌3次后用75%酒精固定。
1.5 流式細胞分析
將75%酒精固定的上皮細胞1 500 r·min-1離心10 min。細胞沉淀用50 μL PBS重懸,再加入500 μL碘化丙啶染液,震蕩混勻后置于室溫避光染色20 min,再用流式細胞儀檢測細胞周期。每個樣品計數10 000~12 000個細胞,用ModFit軟件分析結果。
2 結果與分析
2.1 不同精粗比率日糧對血清EGF濃度的影響
不同精粗比日糧對山羊血清EGF濃度的影響見圖1。
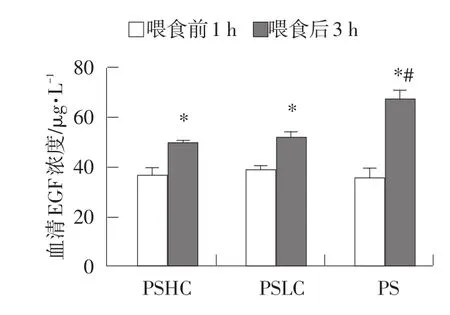
圖1 不同精粗比日糧對山羊血清EGF濃度的影響
由圖1可知,喂食后3 h,山羊血清EGF濃度均顯著提高(P<0.05);與PSHC組相比,PS組喂食后3 h山羊的血清EGF濃度較高。
2.2 不同精粗比率日糧對瓣胃重量的影響
不同精粗比日糧對山羊瓣胃重量的影響見圖2。由圖2可知,PS組瓣胃干重顯著高于PSHC組(P<0.05)。
2.3 EGF對瓣胃上皮細胞增殖的影響
流式細胞儀分析EGF對瓣胃上皮細胞周期的影響見圖3、表3。
由表3可知,EGF處理后顯著提高S期和G2/M期細胞比率,降低G0和G1期細胞比率。
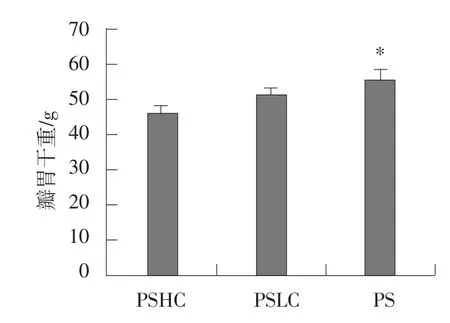
圖2 不同精/粗比日糧對山羊瓣胃重量的影響
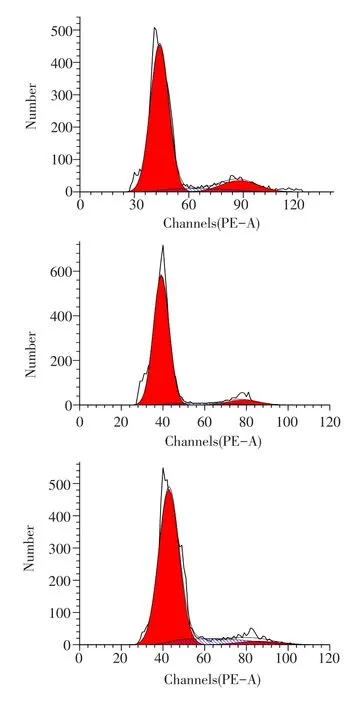
圖3 流式細胞儀分析EGF對瓣胃上皮細胞周期的影響
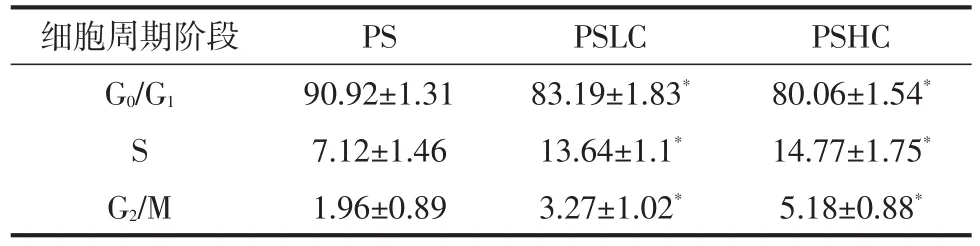
表3 EGF對瓣胃上皮細胞周期的影響 %
3 討論
粗料包括牧草、干草和秸稈等,是反芻動物前胃生長發育的重要養分。研究表明,提高粗料的攝食比率增大山羊瓣胃干重。結果與前人研究一致[3-7]。EGF作為多種細胞分裂促進劑,可促進多種細胞增殖。研究表明,粗料提高瓣胃干重的同時伴隨著血清EGF濃度的升高,提示瓣胃的增重可能與EGF有關。
細胞周期指細胞從1次分裂完成開始到下1次分裂結束所經歷的全過程[5]。細胞周期可分為G1(DNA合成前期)、S(DNA合成期)、G(2DNA合成后期)和M(有絲分裂期)4個期。當G1期的細胞停止分裂,則處于靜息狀態,此期稱之為G0期。通過流式細胞術,表明EGF可提高瓣胃上皮細胞S期和G2/M期比率,降低G0/G1期細胞比率,從而加速瓣胃上皮細胞周期運轉,促進細胞增殖。
研究結果表明,高粗料比率日糧可提高山羊血清EGF濃度,進而促進瓣胃上皮細胞增殖,加速瓣胃上皮生長。
[參考文獻]
[1] Lu J,Zhao H,Xu J,et al.Elevated cyclin D1 expression is gov?erned by plasma IGF-1 through Ras/Raf/MEK/ERK pathway in rumen epithelium of goats supplying a high metabolizable energy diet[J].J Anim Physiol Anim Nutr,2013,97(6):1 170-1 178.
[2] Johnson L R,Chandler A M.RNA and DNA of gastric and duode?nal mucosa in antrectomized and gastrin-treated rats[J].Ameri?can Journal of Physiology,1973,224(4):937-940.
[3] Fluharty F L,Mcclure K E.Effects of dietary energy intake and protein concentration on performance and visceral organ mass in lambs[J].Journal of Animal Science,1997,75(3):604-610.
[4] Mcclure K E,Solomon M B,Loerch S C.Body weight and tissue gain in lambs fed an all-concentrate diet and implanted with tren?bolone acetate or grazed on alfalfa[J].Journal of Animal Science,2000,78(5):1 117-1 124.
[5] Norbury C,Nurse P.Animal cell cycles and their control[J].Annu?al Review of Biochemistry,1992,61(1):441-470.
[6] 郭奇.不同精/粗比日糧對山羊前胃上皮生長的影響[D].南京:南京農業大學,2011.
[7] 趙懷寶.日糧粗/精比對山羊瓣胃上皮生長的影響及機理研究[D].南京:南京農業大學,2011.

