馬鈴薯早疫病拮抗菌的篩選及其代謝產物的抑菌活性
楊繼業楊 帆,3崔冠慧孫勁沖程輝彩張麗萍*王雅娜劉洪偉
(1河北省科學院生物研究所,河北石家莊 050081;2河北省主要農作物病害微生物控制工程技術研究中心,河北石家莊 050081;3河北工業大學,天津300130)
自我國啟動馬鈴薯主糧化戰略,馬鈴薯栽培面積隨之增加,成為僅次于水稻、小麥、玉米的第四大糧食作物。與此同時,馬鈴薯倒茬困難、連作障礙等問題日益嚴重(原霽虹,2015),使得土壤養分不足,有機質含量下降,導致植株衰弱,土傳病害增加,如馬鈴薯早疫病病原菌茄鏈格孢菌(Alternaria solani),更易侵染衰弱植株的葉片、莖稈以及塊莖,危害嚴重,是馬鈴薯的主要病害之一(郭潤婷 等,2016)。
目前國內外對馬鈴薯早疫病的防治主要通過化學防治,常用藥劑如丙森鋅、代森錳鋅、霜脲錳鋅等,化學農藥雖然方便、快速,但長期使用易造成生態環境污染嚴重,菌株抗藥性增加,同時農產品農藥殘留危害人類健康,因此亟須尋找環境友好型生物防治的方法(Wharton et al.,2007;漆文選,2017)。王愛軍等(2013)篩選出2株萎縮芽孢桿菌,對馬鈴薯黑痣病、干腐病病原菌具有較強抑制作用。姚彥坡(2015)篩選出2株木霉菌株HNA14和HNA12,對馬鈴薯晚疫病和辣椒疫病具有較好的防病效果。
目前芽孢桿菌對馬鈴薯早疫病的防治研究較少,因芽孢抗逆性強,具有耐高溫、紫外線,易儲存等優點,本試驗以馬鈴薯早疫病病原菌茄鏈格孢菌作為指示菌,從河北省科學院生物研究所微生物實驗室保存的生防菌株中篩選對馬鈴薯早疫病具有較強抑制效果的芽孢桿菌,對菌株進行生理生化及16S rDNA鑒定,同時對菌株代謝產物性質進行研究,以期得到代謝產物抑菌活性穩定的芽孢桿菌,為進一步研制馬鈴薯早疫病新型生防制劑奠定前期基礎。
1 材料與方法
1.1 試驗材料
供試病原菌為馬鈴薯早疫病病原菌茄鏈格孢菌,由河北農業大學植物保護學院朱杰華教授提供。供試生防菌株為河北省科學院生物研究所微生物研究室保藏的600多株生防菌株。
供試培養基:PB培養基、NB培養基、PDA培養基,配制方法參照細菌鑒定手冊(布坎南和吉本斯,1984;東秀珠和蔡妙英,2001)。
1.2 拮抗菌篩選
1.2.1 拮抗菌初篩 取活化好的直徑為8 mm的茄鏈格孢菌菌餅,點種于PDA培養基(直徑90 mm)中央,26 ℃培養2 d,在菌塊四周點種生防菌株,培養4 d后觀察菌株抑菌效果。
1.2.2 拮抗菌復篩 將初篩所得拮抗菌經二級搖床培養后,發酵液12 000 r·min-1離心10 min去除菌體,經0.22 μm無菌濾膜過濾得到無菌濾液。吸取30 mL茄鏈格孢菌懸浮液(1×106cfu·mL-1)于300 mL融化的PDA培養基中,混勻后倒入培養皿中,待培養基凝固后,打孔并點入100 μL上述無菌濾液,3~4 d后觀察抑菌效果。
1.3 菌株鑒定
1.3.1 形態特征及生理生化特性 在PB平板上接種菌株,32 ℃培養24 h后觀察菌株菌落形態,復紅染色后于顯微鏡鏡檢。菌株生理生化特性參照《伯杰細菌鑒定手冊》(布坎南和吉本斯,1984)和《常見細菌系統鑒定手冊》(東秀珠和蔡妙英,2001)進行鑒定。
1.3.2 基因組提取及16S rDNA序列擴增與分析 采用生工生物工程(上海)股份有限公司DNA提取試劑盒提取菌株的基因組DNA,選用16S rDNA基因通用引物進行PCR擴增。27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-CTACGGCTACCTTGTTACGA-3'。PCR 反 應 體系為50 μL:DNA模板2.5 μL,上下游引物各2 μL,2×Mix 25 μL,ddH2O 18.5 μL。PCR反應程序:94 ℃ 5 min;95 ℃ 30 s,55 ℃ 40 s,72 ℃ 90 s,30個循環;72 ℃ 10 min。PCR產物經1%瓊脂糖凝膠電泳檢測,并于生工生物工程(上海)股份有限公司進行測序,將所得序列與GenBank數據庫中序列進行Blast分析比對,并構建系統發育樹。
1.4 代謝產物的抑菌活性
1.4.1 熱穩定性 將菌株BAF-6的發酵液經0.22 μm無菌過濾器進行除菌,得到發酵濾液,分別在60、70、80、90、100、121 ℃下熱處理 30 min,冷卻至室溫后,采用打孔法在含有茄鏈格孢菌的平板上打孔,并于孔中分別點入100 μL各處理的發酵濾液,3~4 d后測量各處理抑菌圈的大小,以未經熱處理的發酵濾液為對照,以對照抑菌圈大小為活性100%,計算各處理的相對抑菌活性(楊艷紅 等,2017),每個處理3次重復。
1.4.2 蛋白酶穩定性 分別用質量濃度50 mg·L-1胰蛋白酶、胃蛋白酶、蛋白酶K于37 ℃處理菌株BAF-6發酵濾液2 h(胡忠亮 等,2017),以未經蛋白酶處理的發酵濾液為對照,采用1.4.1中的方法測定并計算各處理的相對抑菌活性,每個處理3次重復。
1.4.3 紫外穩定性 將菌株BAF-6的發酵濾液放置在紫外燈下(20 W)20 cm處,分別照射2、4、6、8 h,以未經紫外燈照射的發酵濾液為對照,采用1.4.1中的方法測定并計算各處理的相對抑菌活性,每個處理3次重復。
1.4.4 酸堿穩定性 用1 mol·L-1鹽酸和1 mol·L-1氫氧化鈉溶液分別將菌株BAF-6的發酵濾液pH值調節為 2、3、4、5、6、7、8、9、10、11、12,靜置12 h后,調節pH至中性,以未經處理的發酵濾液為對照,采用1.4.1中的方法測定并計算各處理的相對抑菌活性,每個處理3次重復。
1.5 數據處理
采用MEGA 5.0軟件對所篩菌株進行系統發育樹的構建,采用SPSS軟件進行數據差異顯著性分析,并用Excel軟件進行統計性分析及柱形圖的制作。
2 結果與分析
2.1 拮抗菌篩選結果
通過平板對峙法篩選出對茄鏈格孢菌有較強抑制作用的菌株11株,通過測定菌株無菌濾液的抑菌活性,菌株BAF-6抑菌圈直徑較大,為2.4 cm(圖1、2),說明菌株及菌株發酵濾液均對病原菌抑制作用較強。
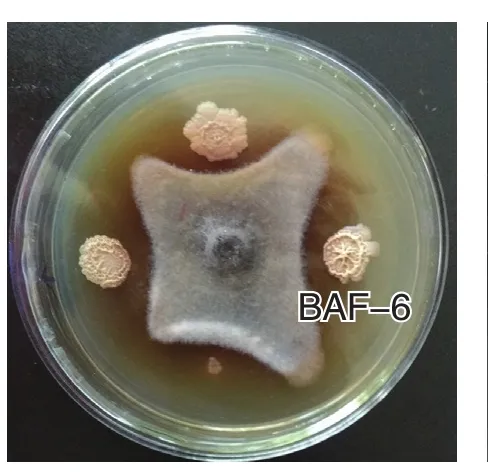
圖1 拮抗菌初篩
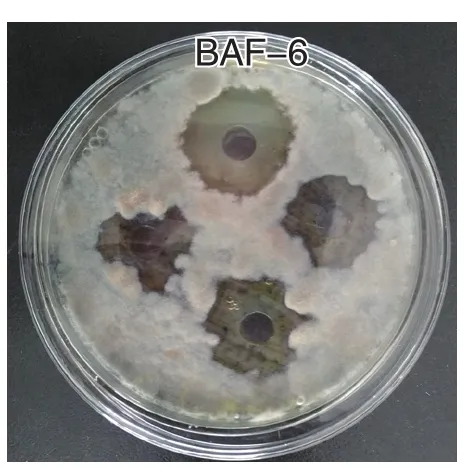
圖2 拮抗菌復篩
2.2 菌種鑒定
2.2.1 菌株BAF-6的形態特征 菌株BAF-6菌落呈白色,不透明,近圓形,邊緣不規則,菌體桿狀,菌體長約1.8 μm,寬約0.6 μm(圖3),產生橢圓形芽孢,芽孢中生。
2.2.2 菌株BAF-6的生理生化特性 通過2.2.1中菌株形態觀察及生理生化特性鑒定(表1),初步鑒定該菌株屬于芽孢桿菌屬(Bacillus)。
2.2.3 菌株BAF-6的分子鑒定 將菌株BAF-6的16S rDNA序列和NCBI網站中與其基因序列同源性較高的菌株進行比對,構建系統發育樹(圖4),結合菌株的形態特征、生理生化鑒定結果以及16S rDNA分子鑒定結果,將菌株BAF-6鑒定為解淀粉芽孢桿菌(Bacillus amyloliquefaciens)。
2.3 菌株BAF-6的代謝產物性質
2.3.1 熱穩定性 從圖5可以看出,60~80 ℃熱處理菌株BAF-6的發酵濾液后,濾液對茄鏈格孢菌的相對抑菌活性均與對照無顯著差異,抑菌活性均在95%以上。90~121 ℃處理下,發酵濾液的相對抑菌活性顯著降低,但100 ℃處理下發酵液的相對抑菌活性仍在85%以上,121℃下的相對抑菌活性在50%以上,說明菌株發酵濾液具有較高的熱穩定性。
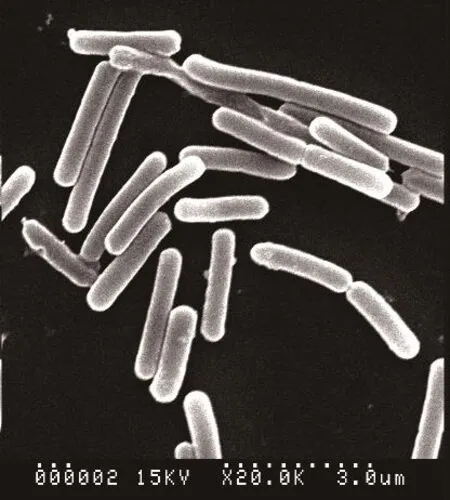
圖3 菌株BAF-6菌體形態

表1 菌株BAF-6的生理生化鑒定結果
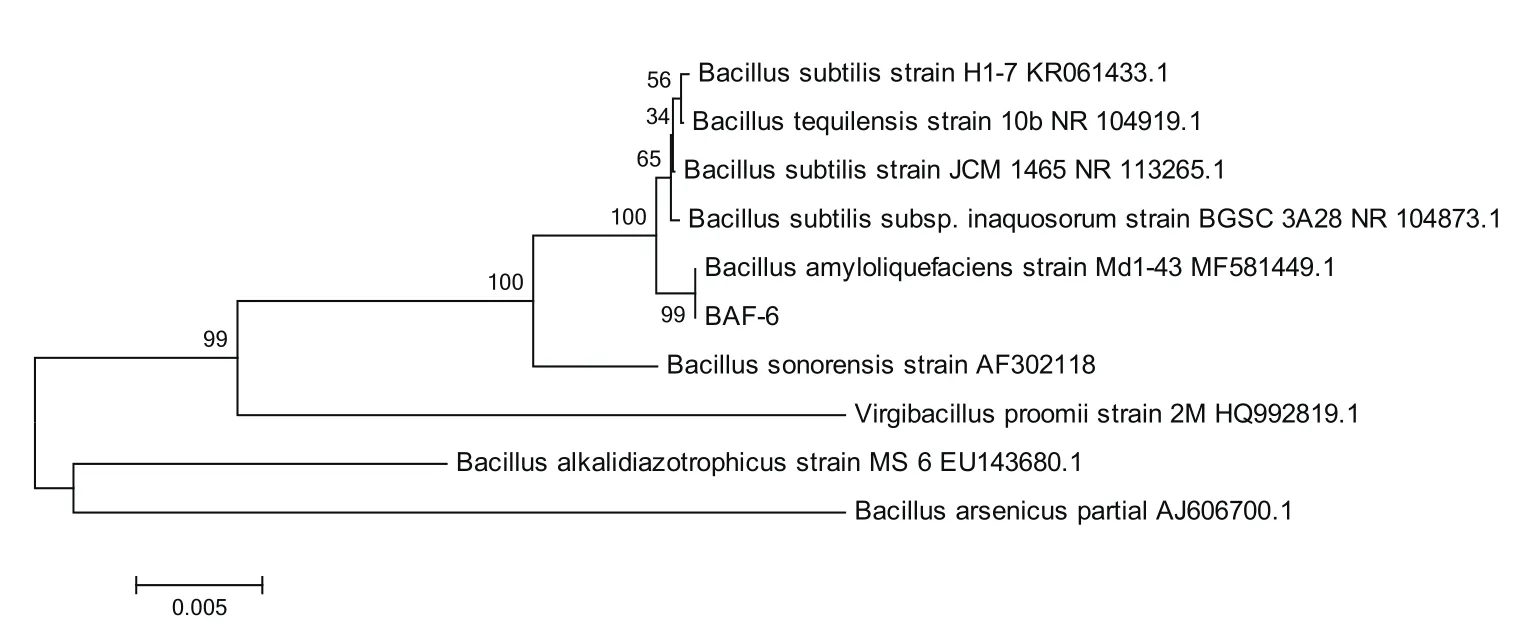
圖4 菌株BAF-6的16S rDNA的系統發育樹
2.3.2 蛋白酶穩定性 從圖6可以看出,采用蛋白酶K、胃蛋白酶、胰蛋白酶處理菌株BAF-6發酵濾液后,濾液對茄鏈格孢菌的相對抑菌活性均顯著降低,但仍在50%以上,說明菌株具有抑菌活性的物質可能不是蛋白質,也可能是蛋白質但不包含芳香族、脂族氨基酸的羧基肽鍵,不含賴氨酸、精氨酸及疏水殘基肽鍵。
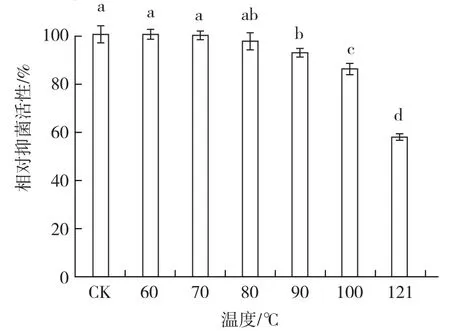
圖5 菌株BAF-6發酵濾液的熱穩定性
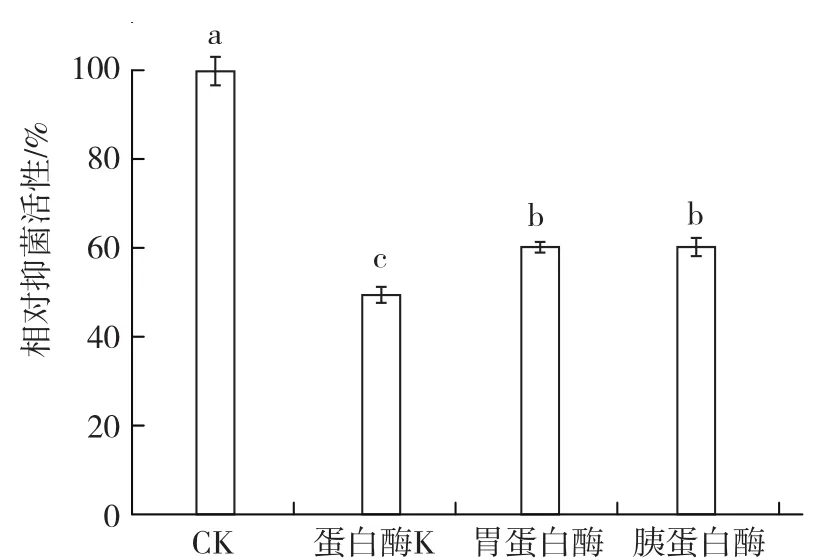
圖6 菌株BAF-6發酵時濾間液的蛋白酶穩定性
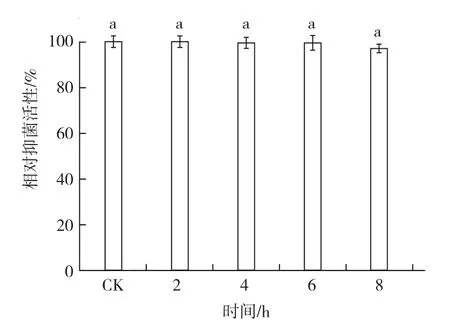
圖7 菌株BAF-6發酵濾液的紫外穩定性
2.3.3 紫外穩定性 從圖7可以看出,經紫外線照射后,菌株BAF-6發酵濾液對病原菌的相對抑菌活性均無顯著變化。說明菌株發酵濾液抑菌活性不因紫外照射而降低,適合于田間應用。
2.3.4 酸堿穩定性 從圖8可以看出,菌株BAF-6發酵濾液在pH值為2~9時的相對抑菌活性與對照均無顯著差異,當pH值為10時,菌株的相對抑菌活性仍為80%以上,說明菌株發酵濾液具有較高的酸堿穩定性。
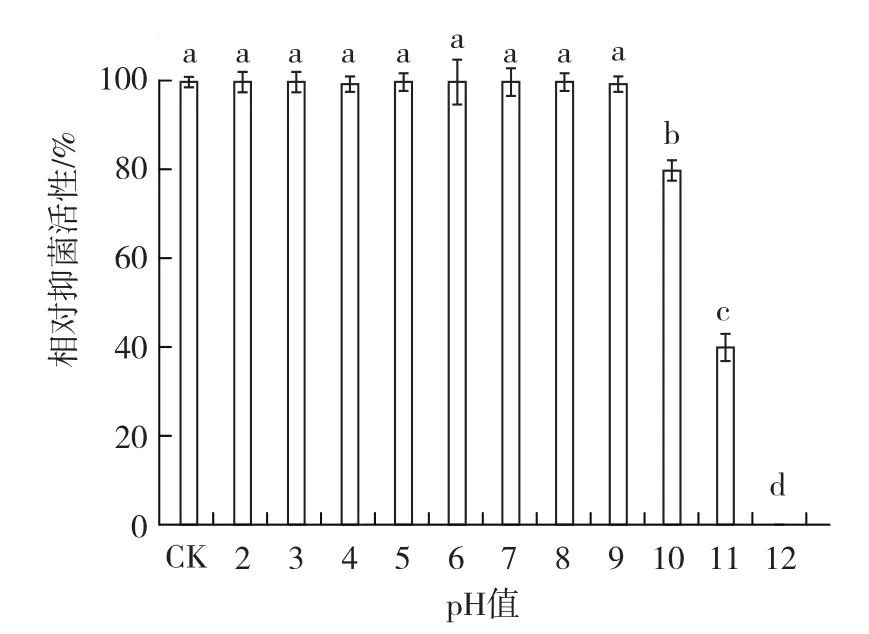
圖8 菌株BAF-6發酵濾液的酸堿穩定性
3 結論與討論
利用對病原菌具有拮抗作用的細菌等有益微生物及其代謝產物進行生物防治是防治農作物病害的有效方法與技術(邱德文,2010),既響應農藥減施及化肥零增長的政策,同時有益于環境、生態和人類健康。尋找高效生防菌資源,是生物防治途徑中最重要的環節。
目前防治馬鈴薯早疫病的生物菌劑主要為放線菌、木霉菌,芽孢桿菌的應用很少。芽孢桿菌可產生耐熱抗逆的芽孢,生存能力強,同時是土壤和植物微生態區系優勢種群,有利于在環境中存活、定殖和繁殖,因此具備較好的生防特性及開發前景(齊愛勇 等,2011)。本試驗以馬鈴薯早疫病病原菌茄鏈格孢菌為指示菌,通過平板對峙法篩選到1株對其具有較強抑制效果的菌株BAF-6,經鑒定該菌株為解淀粉芽孢桿菌(Bacillus amyloliquefaciens)。
解淀粉芽孢桿菌是植物病害防治中一大類芽孢桿菌類群,在生長過程中可產生肽類、聚酮類、脂肽類等具有抗菌活性的代謝產物(Chen et al.,2009)。薛鵬琦等(2011)從解淀粉芽孢桿菌YBWC43菌株中提取出可抑制油菜菌核病菌的桿菌霉素D和芬枯草菌素。本試驗對BAF-6菌株發酵濾液性質進行研究,結果表明菌株BAF-6發酵濾液具有較高的熱穩定性,且經蛋白酶K、胰蛋白酶、胃蛋白酶處理后,發酵濾液的相對抑菌活性仍在50%以上,說明抑菌活性物質可能有一部分并不是蛋白質,需要進一步對有效抑菌物質進行分離純化;菌株BAF-6發酵濾液對紫外線照射具有較強的抗性,在后期菌株田間應用過程中,發酵濾液中的活性物質可以有效保留;發酵濾液在pH值2~10時,相對抑菌活性仍在80%以上,說明菌株發酵濾液具有較高的酸堿穩定性。可見菌株BAF-6具有開發成馬鈴薯早疫病新型生防制劑的潛力。
布坎南,吉本斯.1984.伯杰細菌鑒定手冊.中國科學院微生物研究所《伯杰細菌鑒定手冊》翻譯組譯.8版.北京:科學出版社.
東秀珠,蔡妙英.2001.常見細菌系統鑒定手冊.北京:科學出版社.
郭潤婷,王惟萍,謝學文,李寶聚.2016.馬鈴薯早疫病的診斷與防治.中國蔬菜,(11):80-82.
胡忠亮,鄭催云,田興一,李警保,韓正敏,樊奔.2017.解淀粉芽孢桿菌HZM9菌株發酵液的抑菌譜及穩定性測定.南京林業大學學報,3(41):65-70.
齊愛勇,趙緒生,劉大群.2011.芽孢桿菌生物防治植物病害研究現狀.中國農學通報,27(12):277-280.
漆文選.2017.高寒山區馬鈴薯種薯主要病蟲害調查與防治方法.中國蔬菜,(9):93-98.
邱德文.2010.我國植物病害生物防治的現狀及發展策略.植物保護,36(4):15-18.
王愛軍,柴兆祥,李金花,郭慶剛,王蒂.2013.馬鈴薯干腐病菌和黑痣病菌拮抗芽胞桿菌的篩選及鑒定.中國生物防治學報,29(4):586-594.
薛鵬琦,劉芳,喬俊卿,伍輝軍,馮致科,高學文.2011.油菜菌核病生防芽孢桿菌的分離鑒定及其脂肽化合物分析.植物保護學報,38(2):127-132.
楊艷紅,余瑛,胡永強,余溪,李青青.2017.解淀粉芽孢桿菌AF1發酵液的抗菌活性與抗菌機理.生物技術通報,33(9):233-230.
姚彥坡.2015.防治馬鈴薯晚疫病和辣椒疫病木霉菌的篩選及生防機制研究〔博士論文〕.北京:中國農業大學.
原霽虹.2015.馬鈴薯連作障礙的研究進展.中國馬鈴薯,29(1):46-50.
Chen X H,Koumoutsi A,Scholz R,Borriss R,Schneider K,Vater J,S ü ssmuth R,Piel J,Borriss R.2009.Genome analysis ofBacillus amyloliquefaciensFZB42 reveals its potential for biocontrol of plant pathogens.Journal of Biotechnology,140(1):27-37.
Wharton P S,Kirk W W,Berry D,Tumbalam P.2007.Seed treatment application-timing options for control of Fusarium decay and sprout rot of cut seedpieces.American Journal of Potato Reseach,84(3):237-244.

