植物根際促生菌普城沙雷菌A21-4對黃瓜生長及土壤微生態的影響
丁方麗李 嫚劉東平張忠良孫治強樸鳳植*申順善*
(1河南農業大學植物保護學院,河南鄭州 450002;2河南農業大學園藝學院,河南鄭州 450002)
植物根際促生細菌(plant growth promoting rhizobacteria,簡稱PGPR)是指自由存在于植物根際范圍中的一類可促進植物生長、防治病害、增加產量的細菌的統稱(Kloepper et al.,1980)。PGPR菌株可通過溶磷、解鉀、固氮、產生植物激素等作用,直接促進植物生長,提高產量;還可以通過產生嗜鐵素和抗生素等抑制病原物的生存與繁殖,進而減輕作物病害,改善植物根際土壤微生態環境,間接促進植物生長(Jung et al.,2007;李冰 等,2015)。如:從辣椒根際分離得到的具有產生IAA能力的枯草芽孢桿菌NJAU-G10能顯著促進辣椒幼苗的生長和根系發育(張楊 等,2015);枯草芽孢桿菌QM3能顯著增加番茄植株葉片數,促進番茄株高及根系發育,且有效防治番茄早疫病(胡青平 等,2011);在大豆根際同時接種慢生大豆根瘤菌和膠質類芽孢桿菌后,土壤酶活性顯著提高(劉
麗 等,2015)。由于PGPR具有促進植物生長、防治植物病害和改善植物根際土壤微生態環境的優良特性,因此,很多學者都積極投入到PGPR的開發、應用研究中。邱勤等(2011)研究指出,將PGPR菌劑施于土壤后,能顯著促進苜蓿的生長,同時增加土壤中細菌、真菌、放線菌等微生物的數量,進而提高土壤養分。普城沙雷菌(Serratia plymuthica)A21-4是從洋蔥根際土壤中分離出的辣椒疫病生防菌,能有效定殖在辣椒根系及根際土壤,抑制辣椒疫病的發生(Shen et al.,2005),同時,能顯著促進辣椒生長,改善辣椒根際土壤微生態環境(呂雅悠 等,2016)。在前期A21-4對辣椒的促生作用研究的基礎上,本試驗探究了A21-4對黃瓜生長及根際土壤微生態環境的影響,以期為A21-4在黃瓜實際生產中的應用提供理論依據。
1 材料與方法
1.1 試驗材料
A21-4的利福平標記菌株(100 μL·mL-1)由河南農業大學植物病害生物防治研究室在-80 ℃超低溫冰箱保存備用;黃瓜品種為寒育6號(河南豫藝種業科技發展有限公司選育);供試培養基為TSA培養基(Tryptic Soy Broth Difco. 30 g,瓊脂 18 g,蒸餾水1 000 mL)、AIA培養基(Actinomycete Isolation Agar Difco. 22 g,蒸餾水1 000 mL)和PDA培養基(Potato Dextrose Broth Difco. 24 g,瓊脂18 g,蒸餾水1 000 mL)。
1.2 試驗方法
本試驗于2017年1~6月在河南省鄭州市毛莊綠園蔬菜基地進行。1月17日在日光溫室穴盤播種育苗,2月17日移栽到大棚,施肥按照蔬菜基地常規管理進行,6月15日拉秧結束。
1.2.1 A21-4菌懸液的配制及處理 將A21-4在TSA培養基上培養48 h后,用0.1 mol·L-1MgSO4無菌溶液配制成108cfu·mL-1的A21-4菌懸液。黃瓜育苗期和田間生育期分別用A21-4菌懸液處理,在育苗期,第1片真葉展開時,用A21-4菌懸液進行灌根處理(50 mL·株-1);移栽10 d后再用A21-4菌懸液進行灌根處理(200 mL·株-1),以清水處理為對照,每個處理設3次重復,每個重復150株(6行·重復-1,25 株·行-1)。
1.2.2 黃瓜生育指標和生理指標的測定 2月17日,即黃瓜播種后30 d,每個重復選9株,每個處理3次重復,測定黃瓜苗期株高、莖粗、地上部鮮質量、根鮮質量和第3片真葉的葉綠素含量;3月19日,即移栽后30 d,每個重復取5株,每個處理3次重復,測定黃瓜開花期株高、莖粗、葉片數、葉面積和開花數;在黃瓜苗期(2月17日)、開花期(3月19日)、初果期(4月7日)、盛果期(5月2日)和采收后期(6月7日)分別測定根系活力。葉綠素含量的測定采用分光光度法,根系活力的測定采用氯化三苯基四氮唑法(高俊鳳,2006)。
1.2.3 黃瓜產量和品質相關指標的測定 黃瓜采收期,每個重復選取30株(6行·重復-1,5株·行-1),每個處理3次重復,采集黃瓜果實,采用稱重法測定單株黃瓜果實質量,直至結果期完結后,計算單株產量和每667 m2產量。黃瓜初果期、盛果期和采收后期分別測定品質相關指標,VC含量采用2,6-二氯酚靛酚滴定法測定,蛋白質含量采用考馬斯亮藍G250法測定,可溶性糖含量采用蒽酮比色法測定(蒼晶和趙會杰,2013)。
1.2.4 黃瓜根際土壤酶活性的測定 在黃瓜開花期、初果期、盛果期和采收后期分別測定根際土壤脲酶、磷酸酶、過氧化氫酶和蔗糖酶活性。黃瓜根際土壤樣品的采集:輕輕撥開黃瓜表層土壤,收集黃瓜根際土壤,過60目篩,每處理3次重復。脲酶活性采用苯酚鈉-次氯酸鈉比色法測定,磷酸酶活性采用磷酸苯二鈉比色法測定,過氧化氫酶活性采用高錳酸鉀滴定法測定,蔗糖酶活性采用3,5-二硝基水楊酸比色法測定(關蔭松,1986)。
1.2.5 黃瓜根際土壤微生物數量的測定 在黃瓜開花期、初果期、盛果期和采收后期分別測定黃瓜根際土壤細菌、真菌和放線菌的數量。土壤樣品的采集方法同1.2.4,根際土壤微生物的測定采用稀釋平板涂布法。稱取1 g土樣,倒入裝有100 mL無菌水的三角瓶中,充分振蕩,然后用無菌水進行梯度稀釋,配制成一系列濃度梯度的稀釋液,將0.1 mL的稀釋液均勻涂布在含PCNB的TSA平板上,置于28 ℃恒溫箱中培養3 d后調查細菌數量;將0.1 mL的稀釋液均勻涂布在含乳酸的PDA平板上,置于26 ℃恒溫箱中培養5 d后調查真菌數量;將0.1 mL的稀釋液均勻涂布在含乳酸的AIA平板上,置于28 ℃恒溫箱中培養7 d后調查放線菌數量。調查細菌和真菌采用新鮮土樣,調查放線菌采用自然風干的土樣。
1.2.6 黃瓜根際土壤速效氮、磷、鉀的測定 在黃瓜開花期、初果期、盛果期和采收后期分別測定黃瓜根際土壤速效氮、磷和鉀的含量。土壤樣品的采集方法同1.2.4,速效氮含量的測定采用堿解擴散法,速效磷含量的測定采用碳酸氫鈉法,速效鉀含量的測定采用乙酸銨浸提,火焰光度法(鮑士旦,1999)。
1.3 數據處理與分析
采用Excel 2003和SPSS 13.0軟件進行數據分析,采用Duncan氏新復極差法(SSR法)進行顯著性檢驗。
2 結果與分析
2.1 A21-4對黃瓜生育指標和生理指標的影響
A21-4處理能顯著促進苗期和田間生育期黃瓜生長發育。在苗期,株高、莖粗、地上部鮮質量和根鮮質量分別比對照增加48.17%、3.62%、111.25%和53.03%,葉綠素含量比對照增加27.84%(表1);在開花期,黃瓜株高、莖粗、葉片數、葉面積和開花數分別比對照增加27.57%、13.63%、22.35%、36.64%和23.42%(表2)。同時,A21-4處理顯著提高了黃瓜各生育期的根系活力,在苗期、開花期、初果期、盛果期和采收后期,分別比對照提高70.83%、40.50%、73.58%、112.61%和50.00%(表3)。
2.2 A21-4對黃瓜產量和果實品質相關指標的影響
A21-4顯著提高了黃瓜產量,每667 m2產量達到2 512.74 kg,比對照增產32.22%(表4)。同時,A21-4顯著增加了黃瓜果實的蛋白質、可溶性糖和VC含量,在黃瓜初果期、盛果期和采收后期,蛋白質含量分別比對照增加150.51%、17.51%和25.65%,可溶性糖含量分別比對照增加1.07%、3.51%和13.75%,VC含量分別比對照增加123.44%、11.76%和59.06%(表5)。

表1 A21-4對黃瓜苗期生育指標和葉綠素含量的影響

表2 A21-4對黃瓜開花期生育指標的影響

表3 A21-4對黃瓜根系活力的影響

表4 A21-4對黃瓜產量的影響
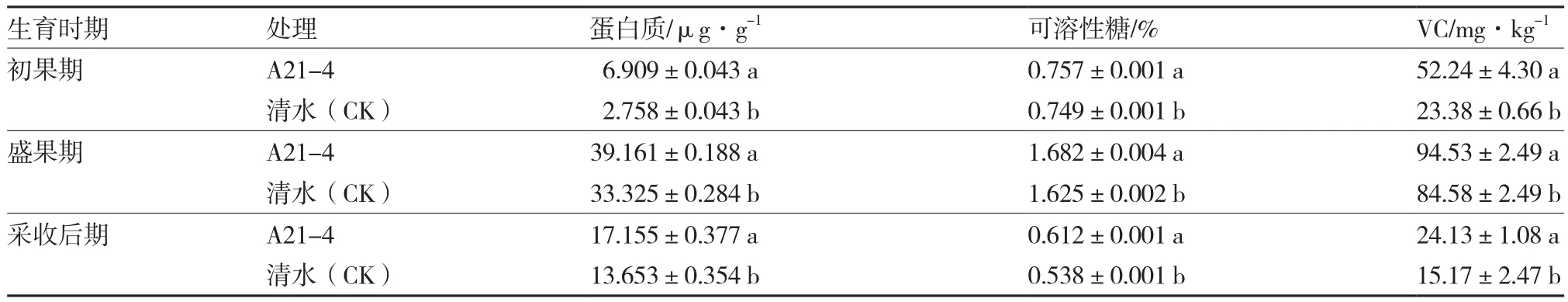
表5 A21-4對黃瓜果實品質相關指標的影響
2.3 A21-4對黃瓜根際土壤酶活性的影響
A21-4顯著提高了黃瓜根際土壤酶活性。在黃瓜開花期、初果期、盛果期和采收后期,A21-4處理的黃瓜根際土壤脲酶活性分別比對照提高15.05%、20.05%、14.37%和29.29%,磷酸酶活性分別比對照提高36.28%、57.77%、146.02%和115.74%,蔗糖酶活性分別比對照提高10.26%、25.69%、208.33%和55.56%,過氧化氫酶活性分別比對照提高70.00%、62.50%、14.77%和20.97% (圖1)。
2.4 A21-4對黃瓜根際土壤微生物數量的影響
A21-4能顯著增加黃瓜根際土壤細菌(采收后期除外)和放線菌的數量,顯著減少真菌的數量。在黃瓜開花期、初果期、盛果期和采收后期,A21-4處理的黃瓜根際土壤細菌的數量分別比對照增加25.75%、26.19%、18.31%和10.49%,放線菌的數量分別比對照增加63.00%、64.86%、11.66%和106.75%,而真菌的數量分別比對照減少36.40%、36.81%、26.55%和45.81%(表6)。
2.5 A21-4對黃瓜根際土壤速效氮、磷、鉀含量的影響
A21-4顯著增加了黃瓜根際土壤速效氮(開花期除外)、磷和鉀的含量(圖2)。在黃瓜開花期、初果期、盛果期和采收后期,A21-4處理的黃瓜根際土壤速效氮含量分別比對照增加1.47%、8.86%、61.12%和22.59%,速效磷含量分別比對照增加35.16%、26.94%、6.98%和10.02%,速效鉀含量分別比對照增加27.84%、9.66%、13.71%
和29.33%。
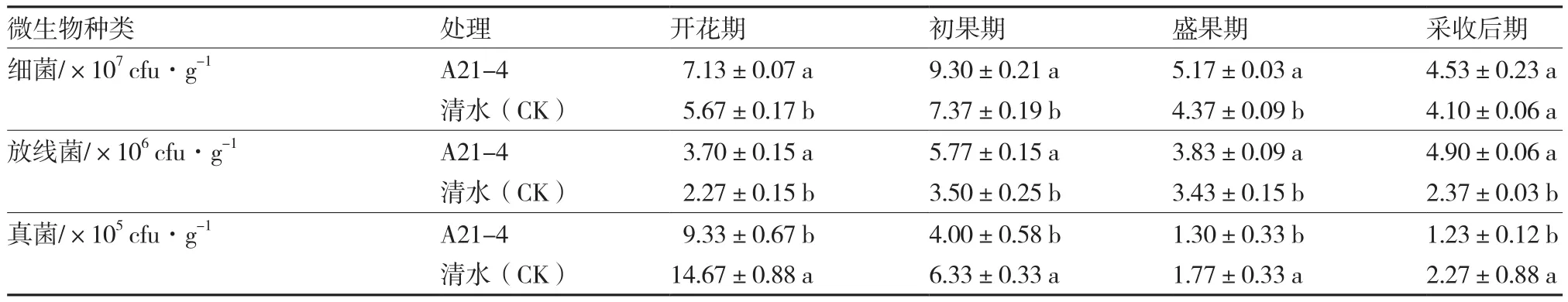
表6 A21-4對黃瓜根際土壤微生物的影響
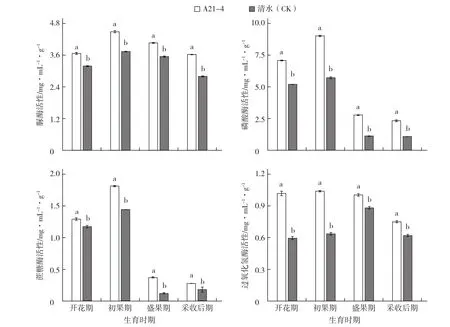
圖1 A21-4對黃瓜根際土壤酶活性的影響
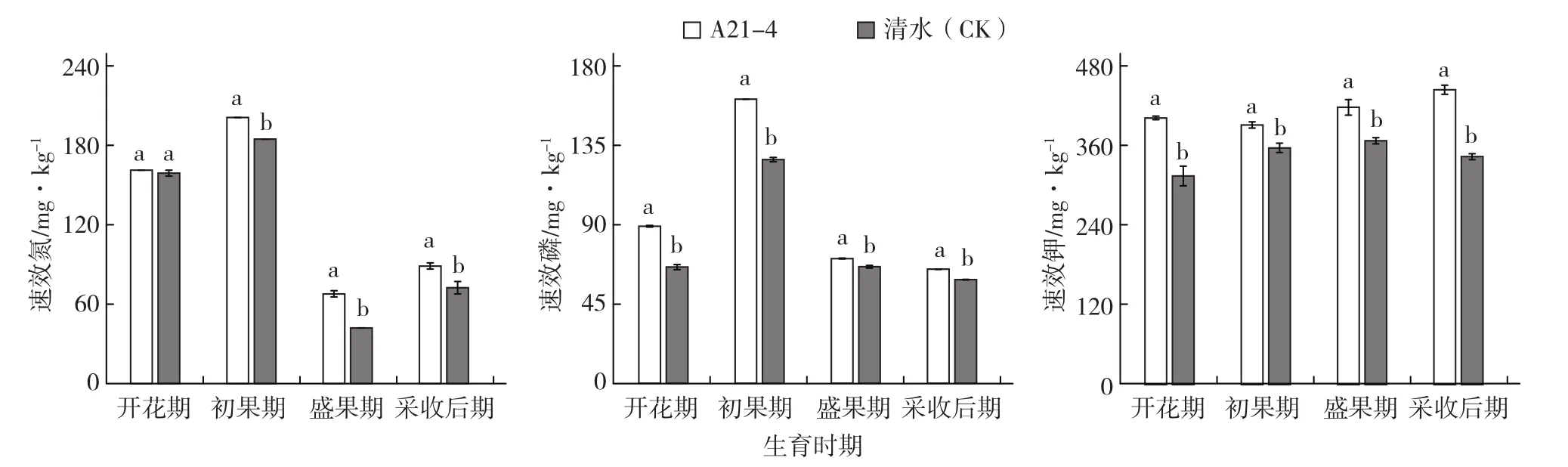
圖2 A21-4對黃瓜根際土壤速效氮、磷、鉀含量的影響
3 結論與討論
PGPR是定殖于植物根際環境中的一類能夠促進植物生長、提高作物產量和減輕植物病害等的有益細菌。一般認為,PGPR菌株通過溶磷、固氮、分泌生長激素等直接作用促進植物生長,也通過抑制有害微生物而間接促進植物生長(田婧 等,2016)。李想等(2017)的研究表明,枯草芽孢桿菌LX-4、地衣芽孢桿菌LX-5和解淀粉芽孢桿菌LX-7不僅能通過產生生長素、細胞分裂素和赤霉素等有效促進煙草的生長,還具有廣譜抑菌效果。環狀芽孢桿菌XD-K-2能通過解鉀作用顯著促進小白菜地上部生長,同時增加根際土壤中全鉀含量(陳易 等,2016)。多黏類芽孢桿菌Cp-S316能夠通過產生肽類活性物質強烈抑制煙草赤星病菌菌絲生長,進而促進煙草的健康生長(王智文 等,2007)。A21-4對辣椒具有促生長和增產效果,同時能改善辣椒根際土壤微生態環境,并有效防治辣椒疫病的發生(呂雅悠 等,2016)。本試驗結果表明,A21-4對黃瓜生長同樣具有顯著的促進效果,可以提高黃瓜品質、調節黃瓜根際土壤微生態環境,是具有應用潛力的微生物資源。另外,之前的室內試驗結果表明,A21-4具有解磷和產生吲哚乙酸的功能(張維娜,2013),能降低黃瓜根際土壤疫霉菌和腐霉菌的密度,但A21-4發揮促生作用的具體機制及其應用技術還需要進一步探討。
植物根際土壤酶活性、土壤微生物、土壤理化性質與寄主植物生長有密切關系。土壤酶活性反映了土壤的健康狀況,土壤過氧化氫酶能轉化土壤中有機質,土壤脲酶能促進氮素循環,土壤磷酸酶與土壤有機磷的轉化有關。土壤速效養分可直接被植物吸收利用,與土壤酶活性密切相關(陳志芳 等,2014)。本試驗中,A21-4顯著提高了黃瓜根際土壤過氧化氫酶、蔗糖酶、脲酶和磷酸酶的活性,進而提高了辣椒根際土壤速效氮、磷和鉀含量。另外,土壤微生物也直接參與植物根際有機質的分解和養分的轉化,且和土壤酶活性密切相關。吳傳萬等(2014)的研究結果表明,土壤磷酸酶活性與細菌和放線菌數量具有顯著正相關;脲酶、蔗糖酶和過氧化氫酶活性與真菌數量極顯著負相關,并與放線菌數量極顯著正相關。本試驗結果表明,A21-4提高了黃瓜根際土壤細菌和放線菌的數量,而減少了真菌的數量,這與土壤酶活性和速效氮、磷、鉀含量的提高具有一定的正相關關系。A21-4對土壤酶活性、土壤速效養分和土壤微生物的具體影響,及其相關性有待進一步研究。
鮑士旦.1999.土壤農化分析.北京:中國農業出版社.
蒼晶,趙會杰.2013.植物生理學實驗教程.北京:高等教育出版社.
陳易,程永毅,郭濤,申鴻.2016.一株具紫色土親和性解鉀菌的篩選及促生效應.西南大學學報:自然科學版,38(5):58-65.
陳志芳,劉金福,吳則焰.2014.不同海拔土壤理化性質與酶活性研究.河北北方學院學報:自然科學版,30(1):38-42.
高俊鳳.2006.植物生理學實驗指導.北京:高等教育出版社.
關蔭松.1986.土壤酶及其研究方法.北京:中國農業出版社.
胡青平,徐建國,程麗萍,田呈瑞.2011.枯草芽胞桿菌QM3防治番茄早疫病和促進幼苗生長的研究.植物保護,37(4):95-100.
李冰,龔文秀,李清,孫樂妮,曹媛媛,唐欣昀.2015.植物根際促生菌株對小麥根系發育的影響.安徽農業大學學報,42(2):276-282.
李想,劉艷霞,夏范講,蔡劉體,張恒,石俊雄.2017.煙草根際促生菌(PGPR)的篩選、鑒定及促生機理研究.中國煙草學報,23(3):111-118.
劉麗,馬鳴超,姜昕,關大偉,杜秉海,曹鳳明,李俊.2015.根瘤菌與促生菌雙接種對大豆生長和土壤酶活的影響.植物營養與肥料學報,21(3):644-654.
呂雅悠,于迪,丁方麗,樸鳳植,申順善.2016.促植物生長根際細菌A21-4對田間辣椒生長及根際土壤微生態環境的影響.中國生物防治學報,32(1):86-92.
邱勤,張磊,韓光,石杰,胡正峰.2011.使用PGPR菌劑及苜蓿培肥新墾地土壤研究.西南大學學報:自然科學版,33(5):109-115.
田婧,李邵,連青龍,魯少尉,馬寧,鮑順淑.2016.植物根際促生菌在蔬菜種植中的應用進展.北方園藝,(6):181-185.
王智文,劉訓理,何亮,夏尚遠,崔萍,吳凡.2007.Cp-S316菌株發酵培養基的優化及其對煙草赤星病菌的抑制作用.農業環境科學學報,26(2):723-728.
吳傳萬,杜小鳳,顧大路,楊文飛,文廷剛,王偉中.2014.植物源藥肥對溫室黃瓜生長發育和土壤環境的影響.江蘇農業學報,30(1):92-99.
張維娜.2013.普城沙雷菌A21-4誘導辣椒抗性作用及其機理的初步研究〔碩士論文〕.鄭州:河南農業大學.
張楊,文春燕,趙買瓊,張苗,高琦,李榮,沈其榮.2015.辣椒根際促生菌的分離篩選及生物育苗基質研制.南京農業大學學報,38(6):950-957.
Kloepper J W,Leong J,Teintze M,Schroth M N.1980.Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria.Nature,286(2):885-886.
Jung H K,Kim J R,Woo S M,Kim S D.2007.Selection of the auxin,siderophore,and cellulose-producing PGPR,Bacillus licheniformisK11 and its plant growth promoting mechanisms.Journal of the Korean Society for Applied Biological Chemistry,50(1):23-28.
Shen S S,Choi O H,Park S H,Kim C G,Park C S.2005.Root colonizing and biocontrol competency ofSerratia plymuthicaA21-4 against Phytophthora blight of pepper.Plant Pathology Journal,21(1):64-67.

