轉錄因子HY5在植物光形態建成和氮代謝中的調控作用
王志冉 王紅艷 鄧海峰 許傳強
(沈陽農業大學園藝學院,設施園藝省部共建教育部重點實驗室,環渤海灣地區設施園藝蔬菜優質高效生產協同創新中心,遼寧沈陽110866)
轉錄因子HY5(ELONGATED HYPOCOTYL5)是亮氨酸拉鏈(bZIP)類的轉錄因子,它能通過不同的感受光信號接收光信號,并將光信號傳遞給下游作用元件,進而調控植物的生長發育。研究發現,植物的光形態建成(photomorphogenesis)和氮素的吸收同化都會受到HY5轉錄因子的調控,而且這些調控方式都會受光照的誘導(Chen et al.,2016;Li & He,2016)。HY5是調控光形態建成的重要因子。植物光形態建成的表型,如幼苗下胚軸的伸長、植株的黃化與去黃化等與HY5的表達具有密切關系。此外,HY5也會啟動光形態建成下游的光敏色素、隱花色素、UV-B光感受器(Casal,2013),進而調控植物基本的發育進程,例如細胞的分裂與伸長,葉綠體的發育和營養元素的吸收同化等(Oyama et al.,1997)。近期的一項研究證明HY5也是調控植物氮碳平衡的重要因子。HY5在光照條件下積累,促進光合產物從地上部移動到根,同時HY5也是長距離運輸的信號分子,它能夠促進主根的生長,同時誘導硝酸鹽從根系向地上部運輸,從而調節了植物的碳氮平衡(Chen et al.,2016)。可見,轉錄因子HY5在植物光形態建成、內源激素信號轉導、氮代謝及碳氮平衡方面具有重要調控作用。
1 轉錄因子HY5在光介導的信號轉導中的調控作用
HY5是定位到細胞核內的組成型蛋白質,由168個氨基酸組成,分子量為18.5 kDa(Oyama et al.,1997),是第1個被發現參與光形態建成并進行深入研究的轉錄因子(Ang et al.,1998;Li et al.,2010)。光是植物生長發育所必需的,能夠調節幼苗光形態建成和種子萌發等過程(Jiao et al.,2007)。光照條件下生長的擬南芥,在種子破土到幼苗生長的過程中,植株主要表現出下胚軸縮短、子葉展開、根和莖的頂端分生組織細胞的數量調控,同時葉綠體迅速積累,植株呈現出去黃化(de-etioletion)的現象,這些都是光形態建成的具體表現;相反,在黑暗中生長的幼苗呈現的表型叫做暗形態建成(skotomorphogenesis),其代表性的特征主要是:細長的下胚軸,兩片子葉未展開,頂端形成彎彎的勾狀結構,葉綠體發育不完全并呈現出黃化的表型等(Srivastava et al.,2015;Gangappa &Botto,2016;Li & He,2016)。光照是調控植物光形態建成最重要的環境因子之一,決定了植物種子的萌發、幼苗的去黃化、器官發育、開花和種子發育等生長發育進程(Kircher & Schopfer,2012)。不同的光感受器吸收光并將光信號傳遞給HY5轉錄因子,進一步響應特異性的激素、養分吸收、非生物脅迫(冷害、高鹽)和新陳代謝等生命活動涉及的信號通路以適應植物的生長與發育(Kircher &Schopfer,2012)。
在可見光和UV-B的光照條件下,HY5能夠激活自身基因的轉錄,促進基因的表達(Abbas et al.,2014;Binkert et al.,2014)。COP1(constitutive photomorphogeneic 1)是光信號轉導因子中非常重要的一個蛋白,稱為光形態建成調控因子。它對紅光、遠紅光和藍光信號都能做出反應,對光信號的轉導起限速作用,是光受體信號轉導中的關鍵因子(Hardtke et al.,2000)。研究發現HY5能夠與COP1相互作用,黑暗條件下COP1在細胞核內積累,HY5與COP1的N末端結合,使HY5泛素化并降解,負調控HY5下游光形態建成下游基因的表達(Holm et al.,2002;Yoon et al.,2006;Cloix et al.,2012);在光照條件下,COP1移動到細胞核外,不能與HY5相互作用,HY5大量積累,促進了HY5轉錄因子下游信號的傳遞,加快反應進程(Osterlund et al.,2000;Huang et al.,2012)。這一原理可以解釋光照條件下幼苗的去黃化現象。
在可見光或UV-B的光照條件下,HY5能夠通過誘導色素生物合成關鍵基因的表達來調控色素的合成與積累(Holm et al.,2002;Shin et al.,2007;Stracke et al.,2010)。花青素是黃酮類化合物,可以保護植物組織免受許多環境脅迫,花青素的生物合成與溫度的變化密切相關,能夠增強脅迫條件下植物的生存能力(Pastore et al.,2017)。花青素生物合成早期基因包括查爾酮合成酶基因CHS(chalcone synthase)、查爾酮異構酶基因CHI(chalcone isomerase)等,轉錄因子HY5與光誘導型基因CHS的啟動子直接結合,進行轉錄水平的調控(Ang et al.,1998;Shin et al.,2007),HY5 還能夠與CHI基因的啟動子結合,也能夠促進花青素的生物合成。HY5和它的同源基因HYH在低溫條件下誘導CHS和CHI基因的表達,誘導花青素的積累主要依賴于光信號的轉導增加HY5的蛋白水平來實現的(Zhang et al.,2011)。研究表明,高溫能夠抑制植物花青素的生物合成,甚至在一些成熟果實(如蘋果和葡萄)的果皮中,花青素的含量也會減少(Mori et al.,2007;Lin-Wang et al.,2011;Movahed et al.,2016)。高溫抑制花青素的生物合成是通過E3泛素連接酶COP1與花色素苷的正調控因子HY5共同調控的。與低溫(17 ℃)條件相比,高溫(28 ℃)條件下擬南芥花色素苷的含量顯著升高,原因是環境溫度的升高會降低花青素生物合成基因的表達量,然而在cop1與hy5突變體中花青素的合成與積累不受溫度變化的影響(Kim et al.,2017)。總之,高溫條件下抑制花青素的生物合成是通過COP1-HY5信號途徑完成的。研究表明,PSY(phytoene synthase)是八氫番茄紅素合成酶基因,是調控類胡蘿卜素生物合成的關鍵基因,HY5能誘導PSY基因的表達(Toledo-Ortiz et al.,2014)。HY5參與光信號轉導在調控植物體內色素合成過程中發揮著重要的作用。
HY5轉錄因子是光照在晝夜交替過程中一個重要的信號轉換集成點(Zhang et al.,2011),植株地上部接收的光信號能夠經過莖并傳遞到根系,激活根系中的光敏色素(Lee et al.,2016)。HY5能夠在擬南芥根細胞的所有組織中表達,而HYH在根系的木質部細胞中表達。將在黑暗條件下生長的hy5突變體、hyh突變體與hy5 hyh雙突變體給予一定的光照干擾,hy5突變體的根系生長就會受到阻礙,而hyh突變體與hy5 hyh雙突變體的根系生長不會受到光照的干擾,這說明了HY5在光控制的根系的光形態建成中起著重要的作用(Zhang et al.,2017)。
2 轉錄因子HY5在激素信號轉導途徑中的調控作用
植物激素作為植物體內的痕量信號分子,對于調節植物的生長發育過程和對環境的應答具有十分重要的意義(康云艷 等,2007)。赤霉素(GA)、脫 落 酸(ABA)、 生 長 素(auxin,IAA)、 乙 烯(ethylene)、細胞分裂素(cytokinin)等激素的生物合成信號轉導都會受到HY5的調控,HY5位于調控網絡的中心位置(Gangappa & Botto,2016),與多種激素信號通路相偶聯共同調控植物的光形態建成(圖1)。
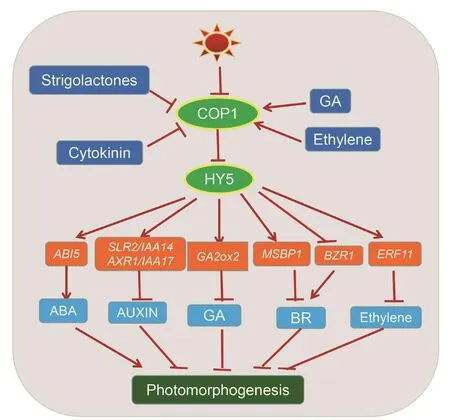
圖1 HY5通過不同激素信號轉導途徑調控植物光形態建成(Gangappa & Botto,2016)
2.1 生長素
hy5突變體在幼苗生長過程中表現出下胚軸細長的表型,產生這一現象的部分原因是由于HY5通過改變植物體內生長素和細胞分裂素之間的平衡,影響了信號轉導。通過基因芯片技術和半定量RT-PCR技術篩選出2個生長素信號的負調控因子AXR2(IAA7)和SLR(IAA14),這2個基因在hy5突變體中都上調表達(Cluis et al.,2004)。Sibout等(2006)同樣發現HY5通過抑制生長素信號的傳遞抑制下胚軸的伸長。HY5調控植物根系的表型還會受到氮素供應水平和供應形式的影響,這也是由HY5與生長素之間的信號交流進行調控的(Huang et al.,2015)。研究發現,植物能夠感知來自周圍環境中的遠紅光信號,遠紅光信號的改變使紅光與遠紅光的比例(R∶FR)發生改變,光敏色素接收信號,同時傳遞給光敏色素依賴型轉錄因子HY5,HY5通過減少根系表皮細胞質膜上的PIN3與LAX3生長素運輸蛋白的豐度調控根系的生長。環境中遠紅光的增加,降低了根系表皮細胞生長素的信號強度,從而使側根原基發生減少,根系密度降低(van Gelderen et al.,2018)。HY5作為長距離運輸的信號分子,與生長素之間的信號交流主要是將地上部接收的光照信號傳遞到根系,在植物幼苗根系的生長發育和根系系統結構表型方面發揮重要的作用。
2.2 油菜素內酯
油菜素內酯(BR)是植物體內必不可少的激素,在植物生長發育過程中發揮著重要的作用,BR能夠促進植物細胞的伸長,提高抗逆性與抗病能力(Oyama et al.,1997)。研究表明,在黑暗中生長的雙子葉植物幼苗會在下胚軸的頂端形成一個鉤狀結構,鉤狀結構的形成依賴于生長素濃度梯度,其他激素與光照條件也參與了鉤狀結構的形成(Sun et al.,2010)。光照與BR參與調控子葉的開放以及頂端鉤狀結構的形成,在種子從土壤中萌發沖破土壤的過程中,有利于植物保護莖尖分生組織不被破壞(Li & He,2016)。無鉤突變體在種子埋入土壤時不能順利萌發(Oyama et al.,1997)。光照能夠調控HY5轉錄因子,BR能夠調控BR合成抑制劑因子BZR1(brassinazole 1)轉錄因子,HY5能夠和BZR1相互作用調控擬南芥幼苗的光形態建成。HY5與BZR1蛋白互作,使BZR1發生磷酸化導致活性降解,從而在擬南芥種子破土后,促進兩片子葉展開,而頂端勾狀結構也隨之消失,調控了植物的光形態建成(Li & He,2016)。膜類固醇結合蛋白MSBP1(membrane steroid binding protein 1)可與類固醇激素在體外結合,負調控BR信號,調控細胞的分裂和伸長(Yang et al.,2005;Song et al.,2009)。在油菜素內酯信號轉導途徑中,HY5還能夠直接誘導BR信號轉導途徑中的負調控因子MSBP1基因的表達(Shi et al.,2011)。總之,HY5抑制油菜素內酯信號途徑的傳導,在BR信號轉導途徑中起負調控作用,促進植物光形態建成表型的產生。
2.3 赤霉素
GA是光形態建成中的負調控因子,其中一個作用是能夠抑制HY5蛋白的積累(Gar cí a-Martinez &Gil,2001;Alabad?′ et al.,2004), 還 有 研 究 表明GA主要通過COP1對HY5蛋白進行調控(Yu et al.,2013)。GA能夠抑制HY5的積累,HY5也能夠調控GA的含量。DELLA蛋白是GA信號通路中的一個重要的蛋白結構域,光照通過抑制GA的生物合成同時增強DELLA的活性來抑制GA的信號轉導(Achard et al.,2007),通過 ChIP-Seq分析,HY5能夠作用于許多GA代謝過程中的相關基因(Lee et al.,2016)。HY5能夠調控GA降解水平基因GA2ox2的表達(Weller et al.,2009),同時GA2ox2酶活性的增加能夠提高DELLA的活性,使GA大量降解(Achard et al.,2007)。以目前的結論推測HY5與GA信號之間可能存在著反饋調節機制,GA負調控HY5的積累,同時HY5也促進GA的降解,它們之間的相互作用也是調控植物光形態建成進程的一條信號通路。
2.4 乙烯
內源激素乙烯能夠使植物發生典型的“三重反應”,使幼苗的根系縮短變粗,對乙烯信號相關基因突變體和hy5突變體進行表型分析,發現乙烯對于幼苗下胚軸生長的促進作用在突變體中被抑制了,確定了HY5是乙烯調控擬南芥幼苗下胚軸生長的關鍵因子(于延文,2013)。同時光照也是調控擬南芥下胚軸生長的關鍵因素,光照促進下胚軸生長,黑暗抑制下胚軸生長。在光照條件下,乙烯能夠促進光敏色素互作因子PIF3的表達,同時抑制HY5蛋白的降解,從而促進下胚軸生長,然而在黑暗條件下,ERF1與WDL5能夠被乙烯誘導,抑制下胚軸的生長(Yu & Huang,2017)。ERF11(ethylene response factor 11)是乙烯的生物合成抑制子,通過抑制乙烯合成基因ACS2/5的表達調控乙烯的生物合成。HY5也能夠啟動ERF11基因的表達,抑制乙烯的信號轉導(Li et al.,2011)。在擬南芥幼苗的去黃化過程中,HY5能夠與ERF4(ethylene responsive element binding protein 4)基因的啟動子結合。ERF4也是活性氧響應的基因,它能夠抑制活性氧的積累,在低溫條件下保護光系統減少光抑制(Chen et al.,2013)。HY5在乙烯信號轉導途徑中不僅調控了植物光形態建成的表型,而且也參與了植物對逆境的響應。植物在抵抗強光等逆境時,HY5與乙烯信號通路集成起到了重要的調控作用。
2.5 脫落酸
光照是調控植物生長的重要環境因子,植物激素脫落酸調節植物生長發育的各個方面,在植物對環境脅迫的適應性反應中起著至關重要的作用,也是調節氣孔開度的關鍵(Cutler et al.,2010;Nakashima & Yamaguchi-Shinozaki,2013)。植物能夠將外界的光照信號與內源的ABA通路結合起來,以便更好地適應和生存。BBX21是一類B-box蛋白,能夠正調控植物的光形態建成,也參與ABA信號轉導。BBX21通過干擾HY5轉錄因子與ABA上游不敏感基因ABI5的啟動子結合負調控ABI5基因的表達,這一過程將光照與ABA信號相偶聯,調節整個轉錄協調工作(Chen et al.,2008)。HY5將光信號與ABA信號相偶聯,調控種子的萌發,HY5能夠與ABA信號的正向調控的轉錄因子ABI5基因的啟動子結合,進行轉錄水平的調控,抑制種子的萌發(Chen et al.,2008)。HY5調控ABI5基因的表達影響植物的耐鹽性,ABA也能通過其信號轉導途徑影響HY5,從而抑制ABI5基因的表達,提高高鹽條件下種子的萌發率(李卓夫,2011)。可見HY5與ABA信號轉導途徑偶聯,并有可能存在著反饋調節機制。HY5與ABA相偶聯與乙烯相似,也在植物光形態建成和抗逆方面發揮重要作用。
3 HY5在氮代謝和碳氮平衡中的調控作用
植物對氮素的吸收、轉運、同化受光照和養分有效性的影響。植物根系吸收硝酸鹽后運輸到地上部的葉片、種子等器官中主要是通過硝酸轉運蛋白(nitrate transporter,NRT)實現的。依據吸收硝酸鹽濃度的不同可以分為高親和轉運蛋白和低親和轉運蛋白,它們是吸收硝酸鹽的主要載體(Dechorgnat et al.,2010)。兩個bZIP類型的轉錄因子HY5和HYH都可能是光誘導的硝酸還原酶基因NIA2(nitrate reductase 2)表達的直接誘導因子,無論是在擬南芥幼苗中還是蓮座時期,HY5和HYH對氮代謝關鍵酶硝酸還原酶基因NR的高表達具有關鍵作用(Jonassen et al.,2008;Lillo,2008)。在擬南芥hy5 hyh雙突變體中,光依賴型NIA2的轉錄水平受到抑制,表明HY5和HYH調節光誘導的NIA2基因的表達(Jonassen et al.,2009a)。但是HY5與HYH具有功能冗余現象,這2個蛋白共同發揮作用還是每個蛋白發揮了不同的作用尚不明確。
無論在不同的硝酸鹽供應水平下還是在不同的光照條件下,HY5都正調控亞硝酸還原酶基因NIR1的表達,負調控銨鹽轉運基因AMT1;2(ammonium transporter1;2)的表達,同時在不同氮素形式(硝態氮、銨態氮和硝酸銨3種形式的氮)和不同氮素濃度供應的條件下也會影響其他氮代謝相關基因的表達(Jonassen et al.,2009b)。HY5需要光照誘導NIR1、AMT1;2和亞硝酸還原酶(nitrite reductase)基因NIA的表達,而且在氮素和光照適宜的條件下,NIR1、AMT1;2和NIA基因的表達量也明顯提高。在持續的低氮濃度條件下,HY5缺失突變體的根系系統結構發生變化,硝酸還原酶活性顯著降低,銨鹽含量顯著增加(Huang et al.,2015)。可見HY5參與擬南芥氮素同化吸收的過程十分復雜。光感受器感應到光會誘導氮同化基因的表達,然而在信號級聯放大中的轉換元件中這些基因的功能還不清楚。
HY5不僅能夠誘導氮代謝相關基因的表達,促進植物對氮素的吸收運轉,還促進了地上部光合產物的形成以及向地下部的運輸。在擬南芥中碳素的固定主要是光合產物以蔗糖的形式從韌皮部轉移到植物的庫組織中(Chen et al.,2012)。研究發現HY5能夠調控蔗糖的代謝途徑,能與編碼海藻糖-6-磷酸合酶基因TPS1結合控制其轉錄水平,同時還能夠誘導蔗糖轉運蛋白(sugar transporter,SWEET11、SWEET12) 轉 錄 促 進 蔗糖從葉片中輸出,運輸到地下部(Chen et al.,2016)。同時,HY5也能夠從地上部運輸到根系。地上部的HY5與根系中的基因結合,將地上部接收的光信號傳遞至根系,實現光信號的放大。運輸到根系的蔗糖也可以作為信號分子,誘導HY5轉錄因子與根系中的硝酸轉運蛋白基因NRT2.1結合,促進NRT2.1的表達。HY5將地上部碳素的同化與根系中氮素的吸收連接,實現了地上部與地下部之間的信息交流,促進了植物碳氮原狀平衡(圖 2)。
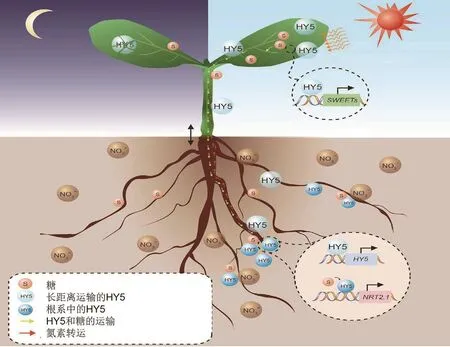
圖2 HY5調控碳氮平衡模式圖(Chen et al.,2016)
4 展望
綜上所述,轉錄因子HY5不僅促進植物光形態建成和幼苗生長,在激素和代謝途徑中的響應作用表明HY5具有多種功能。越來越多的研究結果表明,HY5與其他的激素信號通路集成啟動植物光形態建成。并且,HY5也是從莖運輸到根的信號分子,調控地上部碳素同化和蔗糖積累,增強了根系對HY5依賴型氮素的吸收,不僅促進了根系對的吸收與轉運,而且促進了碳氮平衡。我國在蕪菁(周波 等,2008)、油菜(郭繼平,2013)、番茄(張田田,2016)中也開展了有關轉錄因子HY5在光形態建成、逆境等方面的調控作用研究。沈陽農業大學設施蔬菜栽培與生理課題組目前也正在從事轉錄因子HY5調控嫁接甜瓜氮代謝和碳氮平衡方面的研究工作,結果發現嫁接能夠極顯著地提高甜瓜幼苗葉片中HY5基因表達。這些研究對進一步探析不同物種中轉錄因子HY5功能具有十分重要的意義和作用。近年來,伴隨著分子生物學技術的成熟發展,利用高通量測序技術、代謝組學和蛋白質組學等技術,可為進一步探究轉錄因子HY5在植物生長發育過程中的功能及其調控網絡提供技術保障。同時,轉錄因子HY5功能的解析對進一步調控植物生長發育也提供了新的思路和方向。
郭繼平.2013.油菜HY5基因的電子克隆及生物信息學分析.北方園藝,(23):116-118.
康云艷,郭世榮,段九菊.2007.新型植物激素與蔬菜作物抗逆性關系研究進展.中國蔬菜,(5):39-42.
李卓夫.2011.轉錄因子HY5在擬南芥乙烯生物合成及信號轉導中的功能分析〔博士論文〕.北京:中國農業科學院.
于延文.2013.乙烯調控擬南芥HY5蛋白穩定性和幼苗下胚軸生長〔碩士論文〕.北京:中國農業科學院.
張田田.2016.番茄SlHY5基因在低溫脅迫中的作用〔碩士論文〕.楊凌:西北農林科技大學.
周波,王宇,孫梅,李玉花.2008.津田蕪菁bZIP蛋白HY5 cDNA的克隆及表達特性.分子植物育種,6(1):59-64.
Abbas N,Maurya J P,Senapati D,Gangappa S N,Chattopadhyay S.2014.ArabidopsisCAM7 and HY5 physically interact and directly bind to theHY5promoter to regulate its expression and thereby promote photomorphogenesis.The Plant Cell,26:1036-1052.
Achard P,Liao L,Jiang C,Desnos T,Bartlett J,Fu X,Harberd N P.2007.DELLAs contribute to plant photomorphogenesis.Plant Physiology,143:1163-1172.
Alabad í D,Gil J,B lá zquez M A,Gar cí a-Mar tí nez J L.2004.Gibberellins repress photomorphogenesis in darkness.Plant Physiology,134:1050-1057.
Ang L H,Chattopadhyay S,Wei N,Oyama T,Okada K,Batschauer A,Deng X W.1998.Molecular interaction between COP1 and HY5 defines a regulatory switch for light control ofArabidopsisdevelopment.Molecular Cell,1(2):213-222.
Binkert M,Kozma-Bogn á r L,Terecskei K,de Veylder L,Nagy F,Ulm R.2014.UV-B-responsive association of theArabidopsisbZIP transcription factor ELONGATED HYPOCOTYL5 with target genes,including its own promoter.The Plant Cell,26:4200-4213.
Casal J J.2013.Photoreceptor signaling networks in plant responses to shade.Annual Review of Plant Biology,64:403-427.
Chen H,Zhang J,Neff M M,Hong S W,Zhang H,Deng X W,Xiong L.2008.Integration of light and abscisic acid signaling during seed germination and early seedling development.Proceedings of the National Academy of Sciences,105:4495-4500.
Chen L Q,Qu X Q,Hou B H,Sosso D,Osorio S,Fernie A R,Frommer W B.2012.Sucrose efflux mediated by SWEET proteins as a key step for phloem transport.Science,335:207-211.
Chen D,Xu G,Tang W,Jing Y,Ji Q,Fei Z,Lin R.2013.Antagonistic basic helix-loop-helix/bZIP transcription factors form transcriptional modules that integrate light and reactive oxygen species signaling inArabidopsis.The Plant Cell,25:1657-1673.
Chen X,Yao Q,Gao X,Jiang C,Harberd N P,Fu X.2016.Shootto-root mobile transcription factor HY5 coordinates plant carbon and nitrogen acquisition.Current Biology,26:640-646.
Cloix C,Kaiserli E,Heilmann M,Baxter K J,Brown B A,O’Hara A,Jenkins G I.2012.C-terminal region of the UV-B photoreceptor UVR8 initiates signaling through interaction with the COP1 protein.Proceedings of the National Academy of Sciences,109:16366-16370.
Cluis C P,Mouchel C F,Hardtke C S.2004.TheArabidopsistranscription factor HY5 integrates light and hormone signaling pathways.The Plant Journal,38:332-347.
Cutler S R,Rodriguez P L,Finkelstein R R,Abrams S R.2010.Abscisic acid:emergence of a core signaling network.Annual Review of Plant Biology,61:651-679.
Dechorgnat J,Nguyen C T,Armengaud P,Jossier M,Diatloff E,Filleur S,Daniel-Vedele F.2010.From the soil to the seeds:the long journey of nitrate in plants.Journal of Experimental Botany,62:1349-1359.
Gangappa S N,Botto J F.2016.The multifaceted roles of HY5 in plant growth and development.Molecular Plant,9:1353-1365.
Gar cí a-Martinez J L,Gil J.2001.Light regulation of gibberellin biosynthesis and mode of action.Journal of Plant Growth Regulation,20:354-368.
Hardtke C S,Gohda K,Osterlund M T,Oyama T,Okada K,Deng X W.2000.HY5 stability and activity inArabidopsisis regulated by phosphorylation in its COP1 binding domain. The EMBO Journal,19:4997-5006.
Holm M,Ma L G,Qu L J,Deng X W.2002.Two interacting bZIP proteins are direct targets of COP1-mediated control of lightdependent gene expression inArabidopsis.Genes & Development,16:1247-1259.
Huang X,Ouyang X,Yang P,Lau O S,Li G,Li J,Deng X W.2012.ArabidopsisFHY3 and HY5 positively mediate induction of COP1 transcription in response to photomorphogenic UV-B light.The Plant Cell,24:4590-4606.
Huang L,Zhang H,Zhang H,Deng X W,Wei N.2015.HY5 regulates nitrite reductase 1(NIR1)and ammonium transporter1;2(AMT1;2)inArabidopsisseedlings.Plant Science,238:330-339.
Jiao Y,Lau O S,Deng X W.2007.Light-regulated transcriptional networks in higher plants.Nature Reviews Genetics,8:217-230.
Jonassen E M,Lea U S,Lillo C.2008.HY5andHYHare positive regulators of nitrate reductase in seedlings and rosette stage plants.Planta,227:559-564.
Jonassen E M,Sandsmark B A,Lillo C.2009a.Unique status ofNIA2in nitrate assimilation:NIA2expression is promoted by HY5/HYH and inhibited by PIF4.Plant Signaling & Behavior,4(11):1084-1086.
Jonassen E,S é vin D C,Lillo C.2009b.The bZIP transcription factors HY5 and HYH are positive regulators of the main nitrate reductase gene inArabidopsisleaves,NIA2,but negative regulators of the nitrate uptake geneNRT1.1.Journal of Plant Physiology,166:2071-2076.
Kim S,Hwang G,Lee S,Zhu J Y,Paik I,Nguyen T T,Oh E.2017.High ambient temperature represses anthocyanin biosynthesis through degradation of HY5.Frontiers in Plant Science,8:doi:10.3389/fpls.2017.01787.
Kircher S,Schopfer P.2012.Photosynthetic sucrose acts as cotyledonderived long-distance signal to control root growth during early seedling development inArabidopsis.Proceedings of the National Academy of Sciences,109:11217-11221.
Lee H J,Ha J H,Kim S G,Choi H K,Kim Z H,Han Y J,Hyeon T.2016.Stem-piped light activates phytochrome B to trigger light responses inArabidopsis thalianaroots.Sci Signal,9:ra106.
Li J,Li G,Gao S,Martinez C,He G,Zhou Z,Wang H.2010.Arabidopsistranscription factor ELONGATED HYPOCOTYL5 plays a role in the feedback regulation of phytochrome A signaling.The Plant Cell,22:3634-3649.
Li Q F,He J X.2016.BZR1 interacts with HY5 to mediate brassinosteroid-and light-regulated cotyledon opening inArabidopsisin darkness. Molecular Plant,9:113-125.
Li Z,Zhang L,Yu Y,Quan R,Zhang Z,Zhang H,Huang R.2011.The ethylene response factor AtERF11 that is transcriptionally modulated by the bZIP transcription factor HY5 is a crucial repressor for ethylene biosynthesis inArabidopsis.The Plant Journal,68:88-99.
Lillo C.2008.Signalling cascades integrating light-enhanced nitrate metabolism.Biochemical Journal,415:11-19.
Lin-Wang K U I,Micheletti D,Palmer J,Volz R,Lozano L,Espley R,Iglesias I.2011.High temperature reduces apple fruit colour via modulation of the anthocyanin regulatory complex.Plant,Cell & Environment,34:1176-1190.
Mori K,Goto-Yamamoto N,Kitayama M,Hashizume K.2007.Loss of anthocyanins in red-wine grape under high temperature.Journal of Experimental Botany,58:1935-1945.
Movahed N,Pastore C,Cellini A,Allegro G,Valentini G,Zenoni S,Filippetti I.2016.The grapevineVviPrx31peroxidase as a candidate gene involved in anthocyanin degradation in ripening berries under high temperature.Journal of Plant Research,129:513-526.
Nakashima K,Yamaguchi-Shinozaki K.2013.ABA signaling in stress-response and seed development.Plant Cell Reports,32:959-970.
Osterlund M T,Hardtke C S,Wei N,Deng X W.2000.Targeted destabilization of HY5 during light-regulated development ofArabidopsis.Nature,405:462-466.
Oyama T,Shimura Y,Okada K.1997.TheArabidopsisHY5gene encodes a bZIP protein that regulates stimulus-induced development of root and hypocotyl.Genes & Development,11:2983-2995.
Pastore C,Dal Santo S,Zenoni S,Movahed N,Allegro G,Valentini G,Tornielli G B.2017.Whole plant temperature manipulation affects flavonoid metabolism and the transcriptome of grapevine berries.Frontiers in Plant Science,8:929-936.
Shi Q M,Yang X,Song L,Xue H W.2011.ArabidopsisMSBP1is activated by HY5 and HYH and is involved in photomorphogenesis and brassinosteroid sensitivity regulation.Molecular Plant,4:1092-1104.
Shin J,Park E,Choi G.2007.PIF3 regulates anthocyanin biosynthesis in an HY5-dependent manner with both factors directly binding anthocyanin biosynthetic gene promoters inArabidopsis.The Plant Journal,49:981-994.
Sibout R,Sukumar P,Hettiarachchi C,Holm M,Muday G K,Hardtke C S.2006.Opposite root growth phenotypes ofhy5versushy5 hyhmutants correlate with increased constitutive auxin signaling.PLoS Genetics,2:1898-1911.
Song L,Shi Q M,Yang X H,Xu Z H,Xue H W.2009.Membrane steroid-binding protein 1(MSBP1)negatively regulates brassinosteroid signaling by enhancing the endocytosis of BAK1.Cell Research,19:864-876.
Srivastava A K,Senapati D,Srivastava A,Chakraborty M,Gangappa S N,Chattopadhyay S.2015.Short Hypocotyl in White Light1 interacts with Elongated Hypocotyl5(HY5)and Constitutive Photomorphogenic1(COP1)and promotes COP1-mediated degradation of HY5 duringArabidopsisseedling development.Plant Physiology,169:2922-2934.
Stracke R,Favory J J,Gruber H,Bartelniewoehner L,Bartels S,Binkert M,Ulm R.2010.TheArabidopsisbZIP transcription factor HY5 regulates expression of thePFG1/MYB12gene in response to light and ultraviolet-B radiation.Plant,Cell &Environment,33:88-103.
Sun Y,Fan X Y,Cao D M,Tang W,He K,Zhu J Y,Patil S.2010.Integration of brassinosteroid signal transduction with the transcription network for plant growth regulation inArabidopsis.Developmental Cell,19:765-777.
Toledo-Ortiz G,Johansson H,Lee K P,Bou-Torrent J,Stewart K,Steel G,Halliday K J.2014.The HY5-PIF regulatory module coordinates light and temperature control of photosynthetic gene transcription.PLoS Genetics,10:e1004416.
van Gelderen K,Kang C,Paalman R,Keuskamp D H,Hayes S,Pierik R.2018.Far-red light detection in the shoot regulates lateral root development through the HY5 transcription factor.The Plant Cell,tpc-00771.
Weller M,Felsberg J,Hartmann C,Berger H,Steinbach J P,Schramm J,Heese O.2009.Molecular predictors of progression-free and overall survival in patients with newly diagnosed glioblastoma:a prospective translational study of the German Glioma Network.Journal of Clinical Oncology,27:5743-5750.
Yang X H,Xu Z H,Xue H W.2005.Arabidopsismembrane steroid binding protein 1 is involved in inhibition of cell elongation.The Plant Cell,17:116-131.
Yoon M K,Shin J,Choi G,Choi B S.2006.Intrinsically unstructured N-terminal domain of bZIP transcription factor HY5. Proteins:Structure,Function,and Bioinformatics,65:856-866.
Yu Y,Wang J,Zhang Z,Quan R,Zhang H,Deng X W,Huang R.2013.Ethylene promotes hypocotyl growth and HY5 degradation by enhancing the movement of COP1 to the nucleus in the light.PLoS Genetics,9:e1004025.
Yu Y,Huang R.2017.Integration of ethylene and light signaling affects hypocotyl growth inArabidopsis.Frontiers in Plant Science,8:doi:10.3389/fpls.2017.00057.
Zhang Y,Zheng S,Liu Z,Wang L,Bi Y.2011.Both HY5 and HYH are necessary regulators for low temperature-induced anthocyanin accumulation inArabidopsisseedlings.Journal of Plant Physiology,168:367-374.
Zhang Y,Li C,Zhang J,Wang J,Yang J,Lyu Y,Wang G.2017.Dissection ofHY5/HYHexpression inArabidopsisreveals a rootautonomous HY5-mediated photomorphogenic pathway.PLoS One,12:e0180449.

