高糖高脂抑制成骨細胞增殖及促進凋亡*
吳 娟 邱綺虹 楊驥鋒 梁 敏
慢性牙周炎是口腔科常見疾病之一,牙槽骨破壞是其重要病理特征,最終導致牙松動、脫落。局部菌斑微生物是牙周炎的始動因子,而全身性因素如糖尿病、代謝綜合征等系統疾病可促進牙周炎發展[1,2]。近年來研究表明,代謝綜合征可加重牙周炎癥狀,增加失牙風險[3-6]。代謝綜合征以腹型肥胖、高血壓及糖脂代謝紊亂為特征,糖脂代謝紊亂常誘發高血糖高血脂[7]。Gong等發現高糖高脂通過抑制成骨分化相關基因的表達,削弱成骨細胞分化能力[8,9],并增強破骨細胞骨吸收水平[10]。健康牙周狀況下,成骨細胞介導的骨形成和破骨細胞介導的骨吸收處于平衡狀態,維持牙槽骨的正常形態與功能。在實驗性牙周炎動物模型中,成骨細胞凋亡增多導致新骨形成減少,影響牙槽骨的修復重建,加重牙槽骨缺失及牙周炎病情[11]。高糖高脂條件下,胰島β細胞、心肌細胞及血管內皮細胞增殖活性下降,凋亡增加[12-15],但鮮有文獻報道,高糖高脂是否影響成骨細胞增殖及凋亡。我們前期實驗發現,高糖高脂引起成骨細胞正常形態的改變,在此基礎上進一步研究高糖高脂對成骨細胞增殖及凋亡的影響,為探討代謝綜合征促進牙周炎癥加重的可能原因提供新思路。
1.材料與方法
1.1 實驗材料 棕櫚酸(PA)粉末(MPBiomedicals,美國),D-葡萄糖(Sigma,美國),小鼠顱頂前骨細胞亞克隆14(MC3T3-E1 Subclone 14,中國科學院細胞庫提供),胎牛血清(Gibco,美國),青霉素鏈霉素雙抗(Gibco,美國),α-MEM培養基(含D-glucose5.6mM,Gibco,美國),CCK-8(Dojindo,日本),Annexin V-FITC/PI雙染試劑盒(Biosciences,美國),RIPA裂解液、BCA蛋白定量試劑盒、小鼠β-actin一抗及氧化物酶標記山羊抗小鼠IgG二抗(上海碧云天),小鼠cleaved caspase-3、caspase-3一抗(Cell Signaling Technology,美國)。
1.2 高糖高脂溶液的配置 根據文獻報道,研究者通常采用11mM-30mM糖濃度及或0.4mM棕櫚酸處理肝細胞、巨噬細胞、肝癌細胞等,構建代謝綜合征高糖高脂細胞模型[16-19]。稱量棕櫚酸(PA)粉末及NaOH共同溶于雙蒸水,使NaOH終濃度為0.01M,棕櫚酸終濃度為20.0mM,混勻后于70℃水浴30min得到PA/NaOH溶液。配置30%BSA溶液(w/v,溶于PBS),按照BSA溶液和PA/NaOH溶液的體積比為33∶40混合得到PA/BSA的穩定儲備液,存放于-20℃[20]。使用時,每2ml完全培養基加入5.2mg的D-glucose及73uL的PA/BSA儲存液,0.22μm濾器除菌,最終得到D-glucose 20.0mM,PA 0.4mM,BSA 0.5%的高糖高脂溶液。
1.3 細胞培養 成骨細胞MC3T3-E1在含有10%胎牛血清、1%青霉素鏈霉素雙抗的α-MEM培養基中于5%CO2、37℃條件下培養,待細胞生長至80%-90%融合后傳代進行實驗。細胞培養分為兩組:實驗組使用含D-glucose 20.0mM,PA 0.4mM,BSA 0.5%的高糖高脂溶液,對照組使用含0.5%BSA的完全培養基(含D-glucose5.6mM)。
1.4 細胞形態觀察 實驗組(D-glucose 20.0mM,PA 0.4mM,BSA 0.5%)及對照組(D-glucose 5.6mM,BSA 0.5%)細胞培養24h、36h、48h后,分別在倒置相差顯微鏡(Axiovert 40,美國)下觀察細胞形態學變化。
1.5 CCK-8檢測細胞增殖 成骨細胞以1500個/孔接種至96孔板,培養24h后加入完全培養基或高糖高脂溶液處理0、12、24、36、48h,每組設5個復孔,每孔100ul培養基。將培養基和CCK-8按照體積比9∶1混合,去除處理液后每孔加入CCK-8混合液100uL,37℃避光孵育2h,450nm波長下檢測吸光度值。實驗獨立重復3次。
1.6 Annexin V/PI雙染流式檢測細胞凋亡 成骨細胞以2×105個/瓶接種于25cm2培養瓶,每瓶3ml培養基,培養36h后高糖高脂(D-glucose 20.0mM,PA 0.4mM,BSA 0.5%)處理細胞 0、24、30、36h,依據Annexin V-FITC/PI雙染試劑盒說明書,收集細胞,用1×Binding Buffer重懸調整細胞濃度至1×109/L,加入Annexin V和PI染液室溫避光孵育15 min,流式細胞儀檢測,凋亡率=C4早期凋亡細胞率+C2晚期凋亡細胞率。實驗獨立重復3次。
1.7 Western blotting檢測cleaved caspase3和caspase-3的表達 成骨細胞以2×105個/瓶接種于25cm2培養瓶,每瓶3ml培養基,培養36h后高糖高脂(D-glucose 20mM,PA 0.4mM,BSA 0.5%)處理細胞 0、6、12、24、36h,RIPA 裂解液提取細胞總蛋白,BCA蛋白定量試劑盒檢測樣本蛋白濃度,按照每泳道35ug總蛋白,10%SDS-聚丙烯酰氨凝膠電泳分離蛋白,轉至聚偏氟乙烯(PVDF)膜,5%脫脂牛奶室溫封閉1h,4℃孵育小鼠 cleaved caspase-3、caspase-3(1∶1000)及小鼠β-actin一抗(1∶1000)16至18h,常溫孵育氧化物酶標記山羊抗小鼠IgG二抗(1∶1000)1h,Image Auant Las4000mini超靈敏化學發光成像儀(GE Healthcare,瑞典)檢測,Image J軟件(美國國立衛生研究院)進行條帶灰度值檢測與分析。目的蛋白相對表達量=目的條帶灰度值/內參條帶灰度值,其中β-actin為內參。實驗獨立重復3次。
1.8 統計學分析 采用統計學軟件SPSS19.0進行數據分析,統計數據采用均數±標準差(x±s)表示。組間比較采用單因素方差分析(one w ay ANOVA),LSD法進行兩兩比較,以雙側p<0.05為具有統計學意義。
2.結果
2.1 高糖高脂引起成骨細胞形態改變 倒置相差顯微鏡下觀察,對照組成骨細胞輪廓清晰,呈梭形或多角形,細胞間呈鋪路石樣緊密連接(圖1A-圖1C)。高糖高脂培養24h時觀察到細胞變得稀疏,形態皺縮,胞間間隙增寬,且隨培養時間延長,該現象更加明顯(圖1D-圖1F),提示高糖高脂可改變成骨細胞正常形態。
2.2 高糖高脂抑制成骨細胞增殖 圖2所示,培養成骨細胞0、12、24、36、48h,CCK-8檢測發現對照組細胞呈指數式增殖,高糖高脂組24h時吸光度值(0.065±0.013)較同時刻對照組(0.237±0.048)降低,差異有統計學意義(F24h=24.489,P=0.001),36、48h分別降低至0.032±0.022和0.027±0.022,與同時刻對照組相比差異更顯著(F36h=124.319,p<0.001;F48h=272.440,p<0.001),提示高糖高脂呈時間依賴性抑制細胞增殖。
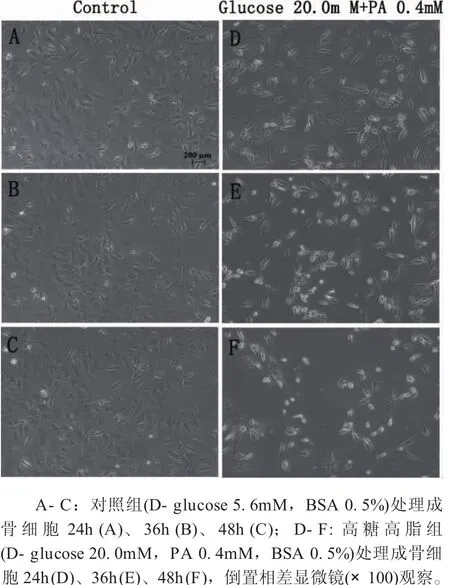
圖1 高糖高脂處理24、36、48h后成骨細胞的形態變化
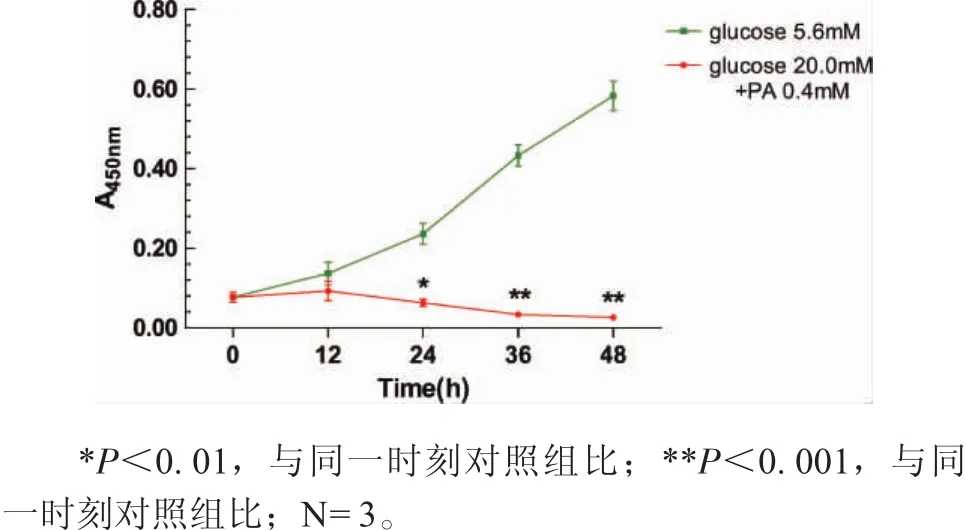
圖2 高糖高脂處理成骨細胞0-48h后的增殖活性
2.3 高糖高脂促進成骨細胞凋亡 高糖高脂處理成骨細胞0、24、30、36h后,Annexin V/PI雙染流式檢測細胞凋亡,凋亡率=C4早期凋亡細胞率+C2晚期凋亡細胞率(圖3A)。圖3B所示,高糖高脂組24h時凋亡率(9.68%±3.33%)與對照組(1.96%±1.32%)相比差異有統計學意義(F=6.274,P=0.022),36h時凋亡率(12.89%±3.40%)上升至對照組6.6倍(P=0.004),提示高糖高脂呈時間依賴性促進成骨細胞凋亡。
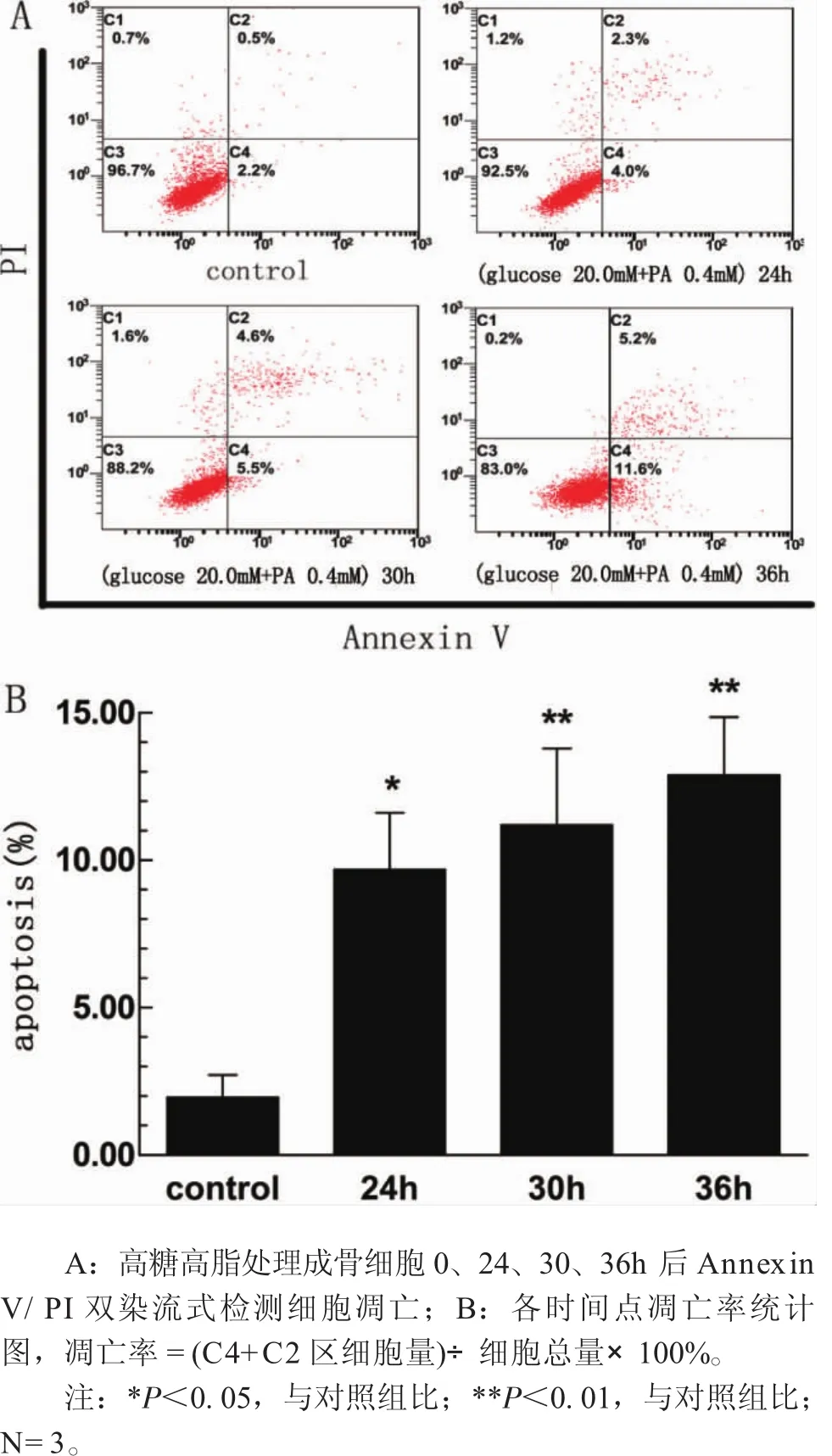
圖3 高糖高脂培養0-36h后成骨細胞凋亡情況
2.4 高糖高脂上調cleaved caspase-3蛋白水平 Western blotting結果顯示,健康成骨細胞表達caspase-3,在相對分子量為35k Da處可見清晰條帶,但極少表達活化的cleaved caspase-3;高糖高脂時間依賴性上調cleaved caspase-3蛋白水平,在17k Da處可見逐漸增強的條帶,caspase-3蛋白水平不變(圖4A)。圖4B所示,高糖高脂處理成骨細胞24h后,cleaved caspase-3相對表達量(0.349±0.068)較對照組(0.146±0.033)升高約2.4倍(F=9.603,P=0.016),36h時蛋白水平(0.468±0.136)約為對照組的3.2倍,差異更顯著(F=9.603,P=0.001),提示高糖高脂呈時間依賴性上調cleaved caspase-3表達,與細胞凋亡相呼應。
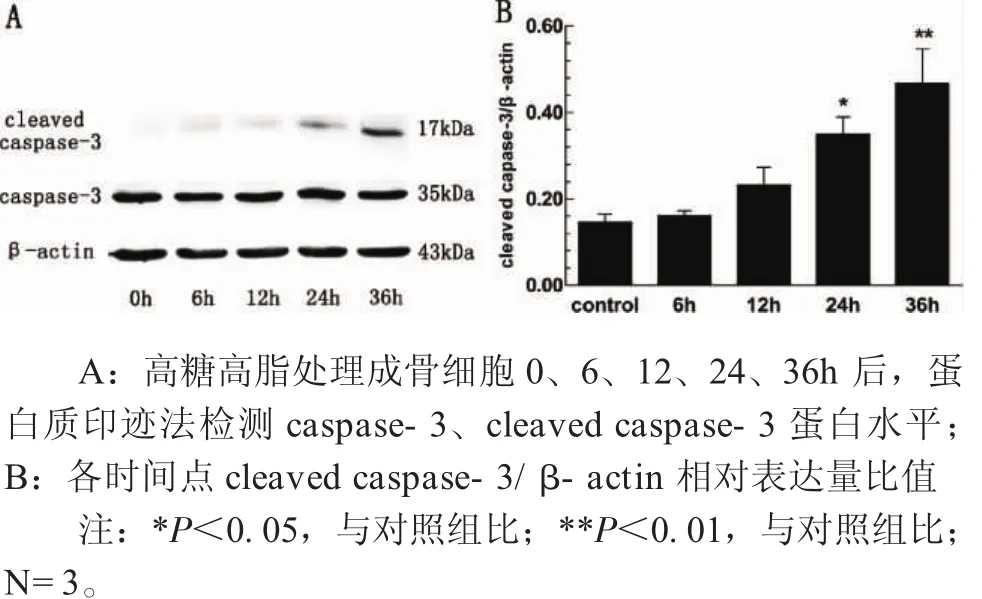
圖4 高糖高脂處理成骨細胞0-36h后caspase-3、cleaved caspase-3蛋白水平
3.討論
大量研究表明,代謝綜合征與牙周炎相互影響。Iwasaki等發現,代謝綜合征可增加牙周炎的發病風險[5]。高密度脂蛋白膽固醇降低、空腹血糖升高及腹部肥胖這三項危險因素與牙周疾病密切相關,牙周炎患者合并有代謝綜合征時,牙周袋加深,附著喪失加重[3]。同時,牙周健康狀況與代謝綜合征的發生相關。縱向觀察顯示,深牙周袋患者有更高幾率出現代謝綜合征臨床癥狀[21]。維持良好的口腔衛生有助于降低罹患代謝綜合征的風險[22]。因此,探討代謝綜合征與牙周疾病關系的機制具有臨床價值。
糖脂代謝紊亂是代謝綜合征的重要臨床特征,表現為高糖高脂血癥[7]。高血脂最常見類型是總甘油三酯和低密度脂蛋白膽固醇水平升高,伴高密度脂蛋白膽固醇水平下降[23],其中引起細胞毒性的脂質有甘油三酯、游離膽固醇、游離脂肪酸等。代謝綜合征患者靜脈血游離脂肪酸濃度為(0.40±0.10)mM[24],棕櫚酸屬于游離飽和脂肪酸,體外實驗常用0.4mM棕櫚酸作為高脂培養條件[15,16,25]。Ying等發現0.4mM棕櫚酸作用心肌細胞24h后細胞增殖活性受抑制,凋亡率上升[25]。臨床上暫無文獻報道齦溝液中游離脂肪酸的濃度,但有學者發現齦溝液中可檢測到載脂蛋白B,其濃度約為靜脈血的25倍[26],載脂蛋白B是低密度脂蛋白膽固醇的主要結構蛋白,它的測定可直接反應低密度脂蛋白膽固醇的水平。研究表明,齦溝探診出血及指尖采血的血糖濃度在個體內均有高度相關性,提示口腔微環境與全血血糖濃度相近[27]。體外實驗構建高糖細胞模型時常采用11mM-30mM糖濃度,研究高糖環境對血管內皮細胞、胰島β細胞、成骨細胞等的作用[12,17,18,28,29]。Sidarala等發現20.0mM葡萄糖可激活胰島β細胞線粒體凋亡通路[28]。
我們發現20.0mM葡萄糖及0.4mM棕櫚酸培養成骨細胞24h時,細胞開始出現皺縮、脫落,胞間間隙增寬,此時細胞增殖活性較同時刻對照組降低(F24h=24.489,P=0.001),凋亡率上升至對照組的5倍(F=6.274,P=0.022),且高糖高脂對成骨細胞增殖的抑制及凋亡的促進呈時間依賴性。高糖高脂可影響細胞多種生物學特性,如增殖、凋亡、細胞形態等。胰島β細胞在高糖高脂作用下,細胞周期抑制劑p16、p18表達增加,阻礙D-cyclins調控作用,細胞增殖能力下降[15];且高糖高脂可促進胰島β細胞釋放ATP,ATP在胞外降解為ADP并與嘌呤能受體P2Y13結合,活化caspase-3,誘導細胞凋亡[30]。Caspase-3是凋亡通路中關鍵蛋白,經上游蛋白酶剪切為cleaved caspase-3活化,可降解細胞骨架蛋白、核蛋白等,引起細胞形態學變化,還可降解MEK激酶、PKA2促進凋亡[31]。我們實驗結果顯示,高糖高脂處理成骨細胞24h后,cleaved caspase-3蛋白水平顯著增高,且相對表達量呈時間依賴性上調,與凋亡吻合。Pacios等在大鼠實驗性牙周炎模型中發現,成骨細胞凋亡增加導致新骨形成減少,使用半胱天冬酶-3(caspase-3)抑制劑可減少成骨細胞凋亡、促進新骨形成,說明cleaved caspase-3參與成骨細胞的凋亡過程[11]。
綜合我們實驗結果及前人研究,顯示高糖高脂從多個方面影響骨組織的改建,表現為:①高糖高脂呈時間依賴性抑制成骨細胞增殖,促進凋亡,引起細胞數量減少;②成骨細胞在高糖高脂環境中堿性磷酸酶活性下降,Runx2、COL1α的mRNA及蛋白水平下調,礦化結節數量減少,成骨能力減弱[8,9];③高糖或高脂可增強破骨細胞骨吸收水平[10]。綜上,高糖高脂通過減少成骨細胞數量、削弱成骨分化能力、提高破骨吸收水平,打破骨形成與吸收的平衡狀態,影響牙槽骨的修復重建,可能是代謝綜合征加重牙周炎癥的原因之一。探討高糖高脂環境下保護成骨細胞的有效方法,并促進成骨分化及抑制破骨細胞骨吸收,對臨床治療牙周炎有重要意義。
[1] GJL,A L,FA S.Periodontal systemic associations:review of theevidence[J].JClin Periodontol,2013:8-19
[2] 劉玉鳳,柯 杰,趙桂芝.牙周病與糖尿病關系的研究進展[J].中華老年口腔醫學雜志,2010,8(3):180-183
[3] Shimazaki Y,Saito T,Yonemoto K,et al.Relationship of metabolic syndrome to periodontal disease in Japanese women:the Hisayama Study[J].JDent Res,2007,86(3):271-275[4]Minagaw a K,Iw asaki M,Ogaw a H,et al.Relationship between metabolic syndrome and periodontitis in 80-year-old Japanesesubjects[J].JPeriodontal Res,2015,50(2):173-179
[5] Iw asaki M,Sato M,Minagaw a K,et al.Longitudinal Relationship Betw een Metabolic Syndrome and Periodontal Disease Among Japanese Adults Aged≥70 Years:The Niigata Study[J].Journal of Periodontology,2015,86(4):491-498
[6]Furuta M,Liu A,Shinagawa T,et al.Tooth lossand metabolic syndrome in middle-aged Japanese adults[J].J Clin Periodontol,2016,43(6):482-491
[7] Eckel R H,Grundy S M,Zimmet P Z.The metabolic syndrome[J].Lancet,2005,365(9468):1415-1428
[8] Gong K,Qu B,Liao D,et al.MiR-132 regulates osteogenic differentiation via dow nregulating Sirtuin1 in a peroxisome proliferator-activated receptor β/δ-dependent manner[J].Biochemical and Biophysical Research Communications,2016,478(1):260-267
[9]Gong K,Qu B,Wang C,et al.Peroxisome Proliferator-Activated Receptor alpha Facilitates Osteogenic Differentiation in MC3T3-E1 Cells via the Sirtuin 1-Dependent Signaling Pathw ay[J].Mol Cells,2017,40(6):393-400
[10]Williams JP,Blair H C,McDonald JM,et al.Regulation of osteoclastic bone resorption by glucose[J].Biochem Biophys Res Commun,1997,235(3):646-651
[11]Pacios S,Andriankaja O,Kang J,et al.Bacterial Infection Increases Periodontal Bone Lossin Diabetic Ratsthrough Enhanced Apoptosis[J].The American Journal of Pathology,2013,183(6):1928-1935
[12]Su J,Zhou H,Tao Y,et al.HCdc14A isinvolved in cell cycle regulation of human brain vascular endothelial cells following injury induced by high glucose,free fatty acids and hypoxia[J].Cell Signal,2015,27(1):47-60
[13]Wang H J,Lee E Y,Han S J,et al.Dual pathw ays of p53 mediated glucolipotoxicity-induced apoptosis of rat cardiomyoblast cell:activation of p53 proapoptosis and inhibition of Nrf2-NQO1 antiapoptosis[J].Metabolism,2012,61(4):496-503
[14]Tan C,Voss U,Svensson S,et al.High glucoseand freefatty acidsinducebeta cell apoptosisvia autocrineeffectsof ADP acting on the P2Y(13)receptor[J].Purinergic Signal,2013,9(1):67-79
[15]Pascoe J,Hollern D,Stamateris R,et al.Free Fatty Acids Block Glucose-Induced-Cell Proliferation in Mice by Inducing Cell Cycle Inhibitors p16 and p18[J].Diabetes,2012,61(3):632-641
[16]Sharifnia T,Antoun J,Verriere T G C,et al.Hepatic TLR4 signaling in obese NAFLD[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2015,309(4):G270-G278
[17]Masur K,Vetter C,Hinz A,et al.Diabetogenic glucose and insulin concentrations modulate transcriptom and protein levelsinvolved in tumour cell migration,adhesion and proliferation[J].British Journal of Cancer,2011,104(2):345-352
[18]Chen W M,Sheu W H,Tseng PC,et al.Modulation of microRNA Expression in Subjectsw ith Metabolic Syndromeand Decrease of Cholesterol Efflux from Macrophages via microRNA-33-Mediated Attenuation of ATP-Binding Cassette Transporter A1 Expression by Statins[J].PLoSOne,2016,11(5):e154672
[19]Shao D,Fry JL,Han J,et al.A Redox-resistant Sirtuin-1 Mutant Protectsagainst Hepatic Metabolic and Oxidant Stress[J].Journal of Biological Chemistry,2014,289(11):7293-7306
[20]Martinez SC,Tanabe K,Cras-Meneur C,et al.Inhibition of Foxo1 protects pancreatic islet beta-cells against fatty acid and endoplasmic reticulum stress-induced apoptosis[J].Diabetes,2008,57(4):846-859
[21]Morita T,Yamazaki Y,Mita A,et al.A Cohort Study on the Association Betw een Periodontal Disease and the Development of Metabolic Syndrome[J].Journal of Periodontology,2010,81(4):512-519
[22]Kobayashi Y,Niu K,Guan L,et al.Oral Health Behavior and Metabolic Syndrome and Its Components in Adults[J].Journal of Dental Research,2012,91(5):479-484
[23]李成琳,陳書蘭,于新波.牙周病與高脂血癥關系的研究進展[J].中華老年口腔醫學雜志,2015(2):109-112
[24]Favre J,Y?ld?r?m C,Leyen T A,et al.Palmitic acid increases pro-oxidant adaptor protein p66Shc expression and affects vascularization factors in angiogenic mononuclear cells:Action of resveratrol[J].Vascular Pharmacology,2015,75:7-18
[25]Ying Y,Zhu H,Liang Z,et al.GLP1 protects cardiomyocytesfrom palmitate-induced apoptosisvia Akt/GSK3b/bcatenin pathw ay[J].Journal of Molecular Endocrinology,2015,55(3):245-262
[26]Sakiyama Y,Kato R,Inoue S,et al.Detection of oxidized low-density lipoproteins in gingival crevicular fluid from dental patients[J].JPeriodontal Res,2010,45(2):216-222
[27]Beikler T,Kuczek A,Petersilka G,et al.In-dental-office screening for diabetesmellitus using gingival crevicular blood[J].JClin Periodontol,2002,29(3):216-218
[28]Sidarala V,Veluthakal R,Syeda K,et al.Phagocyte-like NADPH oxidase(Nox2)promotes activation of p38MAPK in pancreaticβ-cells under glucotoxic conditions:Evidence for a requisiteroleof Ras-related C3 botulinum toxin substrate1(Rac1)[J].Biochemical Pharmacology,2015,95(4):301-310
[29]Feng Z P,Deng H C,Jiang R,et al.Involvement of AP-1 in p38MAPK signaling pathw ay in osteoblast apoptosis induced by high glucose[J].Genet Mol Res,2015,14(2):3149-3159
[30]Tan C,Voss U,Svensson S,et al.High glucoseand freefatty acids induce beta cell apoptosis via autocrine effects of ADP acting on the P2Y13 receptor[J].Purinergic Signalling,2013,9(1):67-79
[31]Saikumar P,Dong Z,Mikhailov V,et al.Apoptosis:definition,mechanisms,and relevance to disease[J].Am J Med,1999,107(5):489-506

