基于iTRAQ技術探討心肌梗死小鼠重構期蛋白表達特點
王媛 尤宏釗 任璐 馬友才 王綠婭 王雪 杜杰
心肌梗死(myocardial infarction,MI)是心血管病中危重的急性事件,近年來發病率有上升趨勢[1]。大量研究證明,急性心肌梗死會導致心室結構和生物力學改變,包括心肌細胞凋亡、膠原沉積、肥大等,這些改變的機制尚未明確[2]。動物模型在研究急性心肌梗死中起到橋梁作用。研究發現,小鼠心肌梗死建模后14d所在分期對應急性心肌梗死后重構期,并且認為重構期在急性心肌梗死后的心臟修復中起到重要作用[3]。但是,既往研究較多關注在急性心肌梗死早期病理變化情況,而對心肌梗死損傷重構期分子表達水平,特別是是重構期心臟組織的蛋白質組學研究甚少[4]。準確描述急性心肌梗死后重構期蛋白譜的變化,不僅對探究病理生理學過程尤為重要,還可為篩選潛在的藥物治療靶點提供分子學信息。蛋白質組學(proteomics)是研究某類組織中所有蛋白質組成和功能的科學。傳統蛋白質組學通常用雙向凝膠電泳圖譜分析(2-dimensional polyacrylamide gel electrophoresis,2DPAGE)技術進行研究[5],這種方法鑒定的蛋白質數量有限且不能精確定量,介于上述缺陷,我們采用新近報道的同位素標記相對和絕對定量(iTRAQ)技術[6],本技術優點在于吞吐量高,穩定性高,不受樣本屬性限制[7]。研究應用iTRAQ技術對急性心肌梗死重構期心臟組織蛋白進行定量分析,在結合生物信息學的基礎上,分析差異蛋白所涉及的生物學進程,并探討涉及的信號通路。
材料與方法
1.動物選擇及分組 健康雄性,C57小鼠,18只,體質量18~20g,由北京安貞醫院動物實驗中心提供。所有小鼠術前禁食6h。本實驗利用隨機數字表法將18只小鼠分為兩組(n=9):分別為對照組(Sham組),心肌梗死組(MI 14d組)。
2.材料及試劑 Q-Exactive質譜儀購自Thermo Finnigan(美國)。安捷倫常規液相,戴安納升液相,布魯克Ultraflex,蛋白濃度測定試劑盒購自 ThermoFisher(美國)。胰蛋白酶、SiTRAQ-plex標記試劑盒及緩沖液購自Applied Biosystems(美國)。
3.方法 (1)心肌梗死動物模型制備過程如本研究室前文所述[8]。將各組小鼠放入氣體麻醉機chamber中麻醉后固定在鼠板上,迅速打開左前胸暴露心臟,用6-0proline絲線結扎冠脈,進針深度約1mm,觀察左心室前壁顏色由鮮紅變暗紫至蒼白色,快速將心臟推入胸腔。擠出胸內氣體,迅速縫合關胸。SHAM組穿線不結扎動脈,余步驟同MI組。兩組術后均給予正常飼料飲水,兩組小鼠術后14d后處死并檢測蛋白表達水平。(2)小鼠心臟組織制備:各組取3只小鼠,MI組取小鼠左心室結扎線以下組織,Sham組正常摘取心臟,用液氮迅速冰凍并放入-80℃冰箱保存。(3)酶解及肽段定量標記:各取200μg樣品分別加入DTT至終濃度為100mM,沸水浴5min,冷卻至室溫,加200μL UA buffer(8M Urea,150mM TrisHCl pH8.0)混勻,轉入 10kd超濾離心管,之后進行梯度離心。各組樣品肽段分別去約100μg,按照 AB公司試劑盒:iTRAQ Reagent-8plex Multiplex Kit(AB SCIEX)說明書進行標記。
4.質譜分析 質譜分析原始數據用軟件Proteome Discoverer 1.3進行查庫鑒定及定量分析,采集的質譜數據用(Proteome Discoverer 1.3,Thermo Fisher Scientific)進行分析,數據庫為Swissprot_mus庫,采用mascot進行檢索,檢索的肽段和譜圖匹配(PSM),q值<1%(1%的FDR)。檢索后的肽段利用嚴格的最大簡約原則合并成蛋白。
5.生物信息學分析分析 結果如本研究室前文所述[9]。為了降低物種間蛋白質異質性,所有差異蛋白首先利用Uniprot比對了人和小鼠中表達量的差異(www.uniprot.org),使用AgriGO進行gene ontology(GO)注釋和富集分析。GO項目描述了蛋白質在三個領域中的作用:生物過程,細胞成分和分子功能。在注釋和注解增加之后,在“Kyoto Encyclopedia of Genes and Genomes”(KEGG,http://www.genome.p/kegg/)中依次將酶映射到注釋序列和代謝途徑[10]。
6.統計學方法 采用SPSS 21.0軟件分析數據。計量資料以均數±標準差表示,兩組間比較采用t檢驗或采用秩和檢驗。計數資料以率或構成比表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
結 果
1.蛋白質的鑒定和定量結果 基于iTRAQ的定量蛋白質組學,本研究解釋了心肌梗死過程中心肌重構期差異表達的蛋白。利用質譜技術,共鑒定了10 324種獨特的肽,對應1 551種蛋白質。
2.重構期心肌梗死蛋白表達譜 為了篩選與正常對照組有差異的蛋白,我們定義兩組之間差異倍數>1.2,或0.8,P<0.05為差異蛋白,并且同時應滿足所選肽鏈>1、置信區間>95%[11]。在鑒定到的蛋白中,MI組/SHAM組共有383個蛋白上調,有309個蛋白下調。進一步取差異蛋白的交集,我們繪制了上下調蛋白中前20的顯著差異表達譜(圖1)。
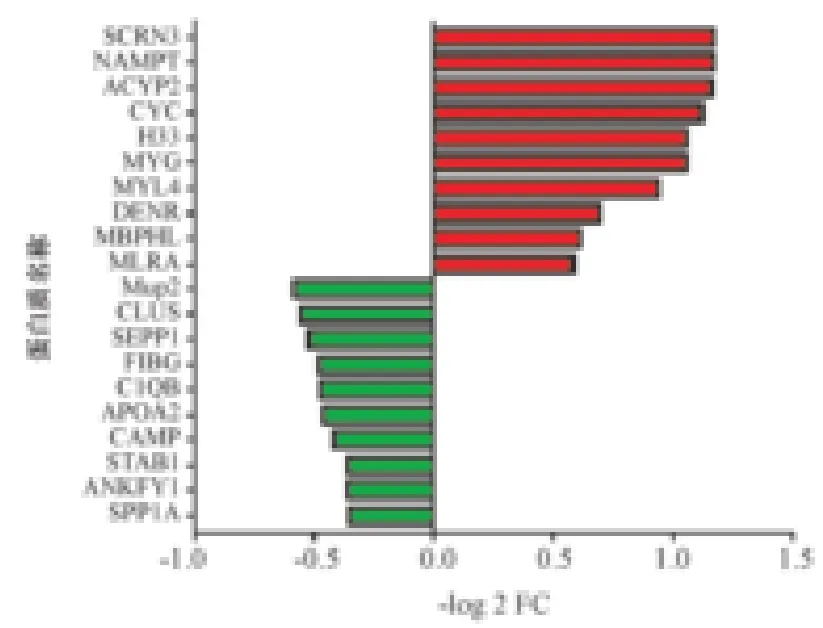
圖1 前20上下調蛋白顯著差異表達譜
3.差異蛋白的生物信息學分析和信號通路 為研究差異蛋白的總體趨勢和功能學分類,我們用Gene Ontology(GO)對不同組別的差異表達蛋白共計692個進行了富集分析。差異蛋白的GO分析由生物過程(BP)、細胞組成(CC)和分子功能(MF)三個部分組成。主要結果分別呈現在圖2~3中。
在生物過程中,MI組與Sham組相比,差異表達蛋白中上調蛋白主要涉及到通路集中在補體和凝血級聯反應、免疫調控和炎癥反應上(圖2 A),差異表達蛋白中下調蛋白主要涉及葡萄糖代謝、己糖分解代謝及氧化還原反應(圖3A)。在細胞成分上,上調差異蛋白主要集中在細胞外區域及細胞內無膜結構,下調差異蛋白主要集中在線粒體和肌凝蛋白復合體等細胞成分(圖2 B、圖3 B)。在分子功能上,兩組之間的差異表達蛋白主要涉及在肌動蛋白結合、細胞骨架連接、軸因子結合和運動活性上。
4.差異蛋白所涉及的信號通路研究 為探究所涉及的信號通路,我們采用KEGG分析鑒定了差異蛋白,心肌梗死后14d的心臟組織的蛋白表達主要涉及的信號通路是免疫反應和糖代謝通路。
討 論
急性心肌梗死起病急,恢復慢且病死率高。在減少心肌壞死的基礎上對心肌梗死后的心臟進修復可有效改善預后,提高生存質量[11]。重構期作為心肌梗死后心臟重構的關鍵時期,了解蛋白變化及機制對疾病的干預治療有重要意義[12]。目前有關MI研究主要集中在急性期蛋白表達情況,對于心肌重構期蛋白譜的變化研究相對較少。為了探究重構期所涉及的蛋白變化,我們運用iTRAQ技術首次定量檢測心肌梗死重構期差異表達的蛋白,結合生物信息學和公共數據庫,描繪差異蛋白譜,發現其中主要涉及的病理過程是免疫反應和糖類代謝。
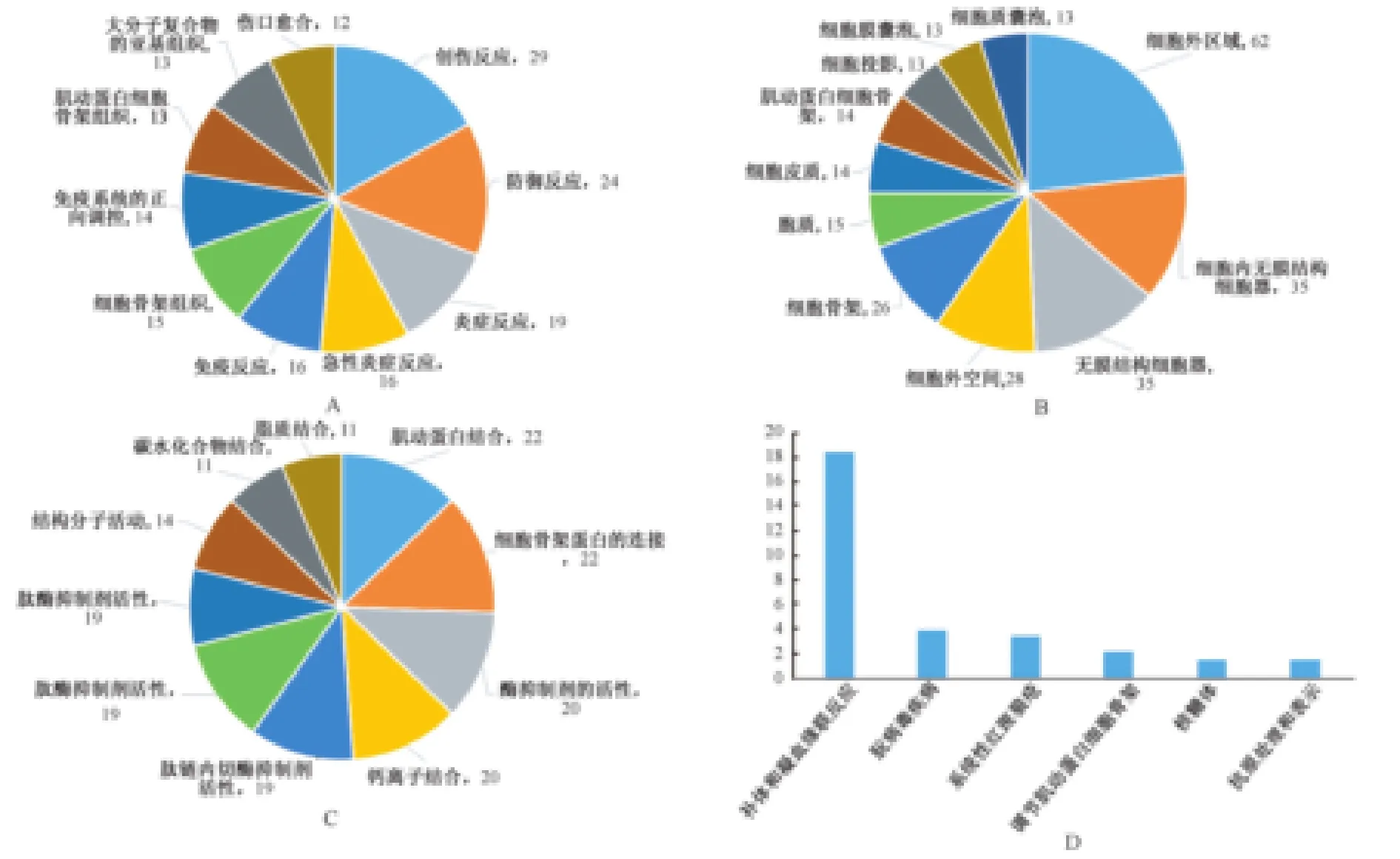
圖2 急性心肌梗死重構期差異表達上調的蛋白生物信息學分析 A:SHAM/MI 14天組上調蛋白生物進程分析;B:SHAM/MI 14天組上調蛋白細胞成分預測;C:SHAM/MI 14天組上調蛋白分子功能預測;D:SHAM/MI 14天組上調蛋白信號通路分析
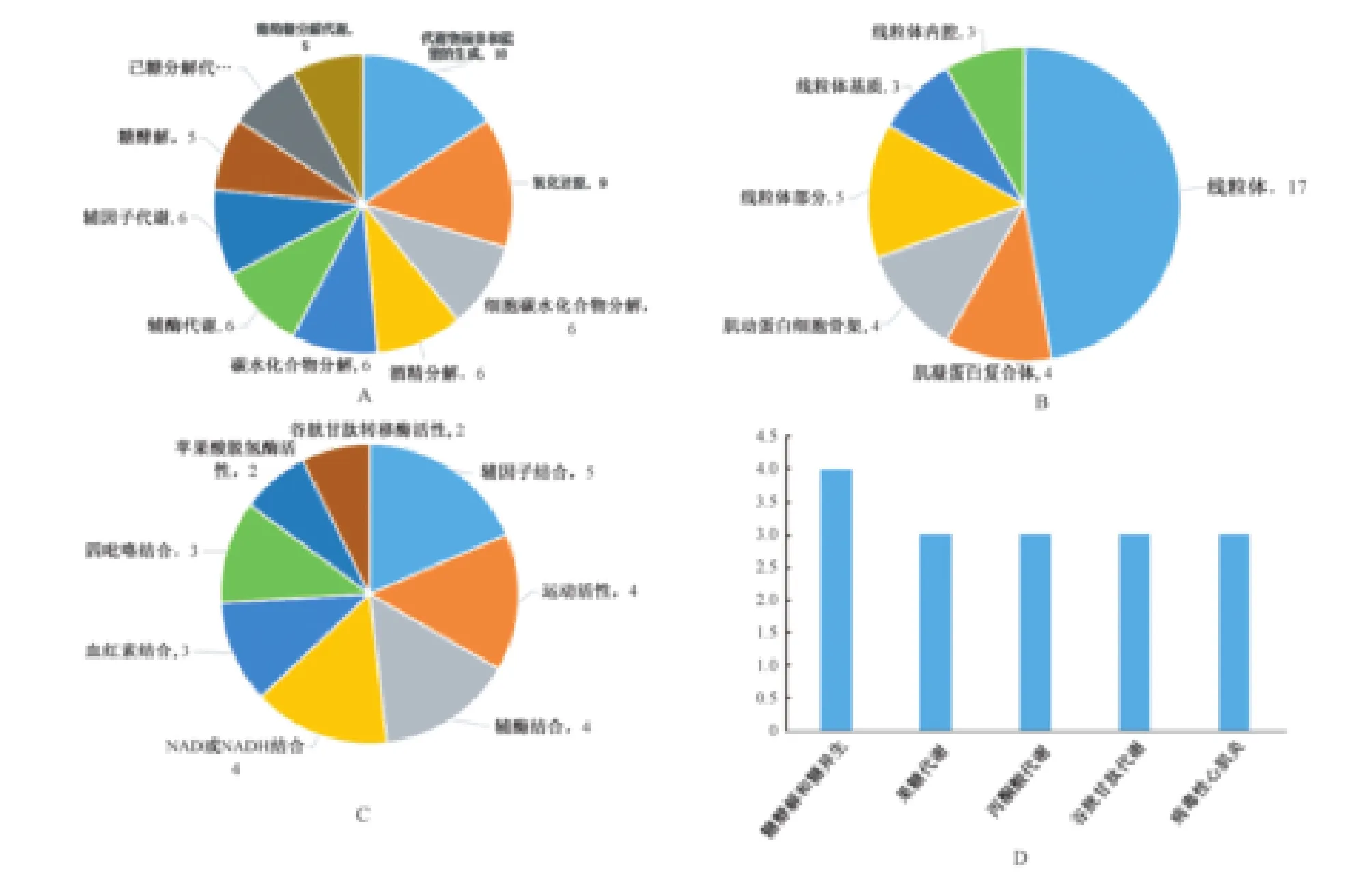
圖3 急性心肌梗死重構期差異表達上調的蛋白生物信息學分析 A:SHAM/MI 14天組下調蛋白生物進程分析;B:SHAM/MI 14天組下調蛋白細胞成分預測;C:SHAM/MI 14天組下調蛋白分子功能預測;D:SHAM/MI 14天組下調蛋白信號通路分析
早期研究發現,在大鼠心肌梗死模型中,心肌損傷可激活補體級聯反應,富含線粒體的亞細胞成分釋放觸發級聯早期作用成分C1~C4的釋出[13-14]。補體系統在活化過程中產生具有生物活性的蛋白片段,在中期持續升高會影響心肌梗死的恢復[12]。C4d、Bb分別是補體的經典和替代激活途徑的產物。本項研究中發現心肌梗死重構期補體C5的水平顯著升高,這與既往研究結果一致。C5b-9組成攻膜復合物(membrane attack complex,MAC),具有溶細胞作用[15],在AMI患者血漿中MAC升高導致死亡率和心血管事件發生率升高[16]。既往動物研究中發現,利用抗-C5補體Pexelizumab輔助治療可減少急性心肌梗塞后再灌注損傷,并在II期臨床研究中證實了在急性冠脈綜合征患者中獲益[17]。此外,國內外的研究中也表明采用補體抑制劑抑制補體系統,可有效減輕心肌的缺血性損傷,縮小梗死面積。其次,缺血心肌細胞在調節因子的作用下產生炎癥反應[18]。大量實驗表明熱休克蛋白、ATP、線粒體在心肌受損后刺激炎癥級聯反應,這些危險信號通過刺激Toll樣受體家族成員發揮抗炎作用[19]。細胞基質蛋白凝血酶敏感蛋白(TSP)-1作為縮血管蛋白,在缺血過程中從內皮和心肌細胞中釋放,促進血小板在動脈粥樣硬化病變的內皮下層粘附聚集,在心肌缺血過程中,TSP-1通過激活CD47和CD36破壞NO信號通路和VEGF信號通路,干擾局部微循環,最終導致梗死后的過度纖維化。研究表明,TSP-1在心肌梗死后恢復有抑制作用[20]。
蛋白和糖代謝正常心臟可以利用多種底物產生能量,如脂肪酸、酮體、葡萄糖等[21]。心肌缺血時,心肌供氧不足,抑制脂肪酸的有氧氧化,無氧糖酵解增加,此時葡萄糖成為心肌主要能量來源[22]。有研究發現:能量代謝障礙發生后心肌細胞的基因結構及表達均受到影響,且心肌細胞內ATP水平與其凋亡壞死密切相關[23]。在心肌細胞中,線粒體作為最復雜的細胞器之一,承擔有眾多細胞功能包括脂肪酸代謝、能量產生和糖代謝等,前人研究證明在MI中心肌細胞線粒體活性與正常心肌相比下降嚴重[24],這也從側面印證了我們的研究結果。更為重要的是,既往研究發現及時糾正代謝異常可以有效地減少MI范圍,我們的研究為進一步揭示了糖代謝在心肌梗死重構期的作用機制及尋找潛在的干預靶點提供了組學數據。
本研究首次利用相對定量的方法,探究了與正常心臟相比,心肌梗死14d后小鼠心臟組織蛋白表達的差異,并結合生物信息學,對差異蛋白進行了GO分析和通路分析,為探究蛋白表達水平在急性MI重構期的變化以及尋找潛在治療靶點提供了結果支持。研究仍存在局限,iTRAQ實驗在蛋白定量過程中并不是鑒定到的所有肽段均參與蛋白定量過程,可能在篩選過程中會出現遺漏情況;雖然在公共數據庫中比對了人和鼠間差異,但仍做不到全部排除不同物種間異質性。
綜上所述,定量蛋白質組學技術可用于組織蛋白鑒定和相對定量,利于更全面的了解蛋白與MI重構期的病理變化關系。本項研究的結果為探究急性MI重構期心臟組織蛋白所涉及的病理過程和潛在的治療靶點提供了新的觀點和證據。

