利拉魯肽治療背景期糖尿病視網膜病變的療效及對血管內皮生長因子和胰島素樣生長因子-1水平的影響
高麗華,劉旭陽,張紅博,朱亞軍
(1. 解放軍第252醫院,河北 保定 071000;2. 河北省人民醫院,河北 石家莊 050000)
隨著人民生活水平的提高,我國糖尿病患者日漸增多,而糖尿病視網膜病變(DR)是糖尿病最常見的微血管并發癥,其發病機制十分復雜。近年來隨著分子生物學的發展,許多研究發現血管內皮細胞生長因子(VEGF)和胰島素樣生長因子(IGF-1)在DR的發生發展中發揮重要作用[1],利拉魯肽是胰升血糖素樣肽-1(GLP-1)類似物,具有葡萄糖依賴性的胰島素促分泌作用,同時也能夠抑制胰高血糖素的分泌,近年來被廣泛用于2型糖尿病(T2DM)患者的降糖治療[2]。動物實驗表明,GLP-1受體(GLP-1R)的激活可能很好地維持和保護DR的功能[3]。本研究將探討GLP-1R激動劑利拉魯肽治療背景期糖尿病視網膜病變(BDR)的療效,并且觀察利拉魯肽對此期患者血清VEGF及IGF-1濃度的影響,現報道如下。
1 臨床資料
1.1一般資料選擇2015年6月—2016年5月解放軍第252醫院收治的BDR患者80例,其中糖尿病診斷標準參照1999年WHO中的糖尿病標準;DR診斷符合2014年中國糖尿病視網膜病變臨床診療指南。DR分期標準采用第三屆全國眼科學術會議制定的分期標準。排除增殖期糖尿病視網膜病變者、白內障以及其他非糖尿病性視網膜病變者(如視網膜脫離、青光眼、葡萄膜炎、視神經疾病等);急性感染性疾病以及心力衰竭、嚴重肝腎功能不全者;已行手術治療者,妊娠或哺乳期婦女,有藥物過敏史者,近1個月內參加其他藥物臨床試驗者。將患者隨機分為2組:觀察組40例,男22例,女18例;年齡43~70(55.4±2.3)歲;病程10~62(38.8±1.2)個月。對照組40例,男21例,女19例;年齡42~70(54.3±1.3)歲;病程12~60(40.2±1.4)個月。2組一般資料比較差異均無統計學意義(P均>0.05),具有可比性。研究獲解放軍第252醫院科學與倫理委員會批準,所有治療均獲得患者或親屬知情同意,簽署知情同意書。
1.2治療方法對照組給予口服降糖藥物聯合胰島素皮下注射的方案進行降糖治療,根據血糖水平調節口服藥物及胰島素的劑量,所用口服降糖藥物包括二甲雙胍、阿卡波糖,所用胰島素制劑包括甘精胰島素注射液、賴脯胰島素注射液、門冬胰島素注射液。觀察組在常規降糖方案治療的基礎上加用利拉魯肽,起始劑量0.6 mg/次,1次/d,皮下注射,1周后加量至1.2 mg/次,1次/d,皮下注射,連續治療24周后評估療效。
1.3臨床指標檢測方法采用放射免疫法測定空腹血糖(FPG)、餐后2 h血糖(2hPG)、空腹血胰島素(FINS)的含量,根據穩態模型計算胰島素抵抗指數(HOMA-IR);采用酶聯免疫吸附試劑盒測定VEGF、IGF-1水平變化。
1.4療效評定標準參考2014年我國DR臨床診療指南[4]。顯效:微血管瘤及眼底水腫、出血、滲出中≥2項癥狀明顯減輕或消失,視力提高3行以上,眼底熒光血管造影檢查顯示血管滲漏顯著減少或消失。有效:微血管瘤及眼底水腫、出血、滲出中≥1項癥狀明顯減輕或消失,視力提高1行以上, 眼底熒光血管造影檢查顯示黃斑水腫、血管壁滲漏減輕或消失。無效:上述指標無明顯變化甚至出現惡化。總有效率=顯效率+有效率。
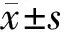
2 結 果
2.12組血糖代謝指標比較2組治療后FPG、2hPG以及HOMA-IR較治療前均下降(P均<0.05),觀察組血清FPG、2hPG以及HOMA-IR均顯著低于對照組(P均<0.05)。見表1。
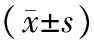
表1 2組治療前后代謝指標比較
注:①與治療前比較,P<0.05;②與對照組比較,P<0.05。
2.22組血清VEGF、IGF-1指標比較2組治療后血清VEGF、IGF-1水平均較治療前下降(P均<0.05),且觀察組改善情況明顯優于對照組(P均<0.05)。見表2。
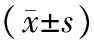
表2 2組血清VEGF和IGF-1的比較
注:①與治療前比較,P<0.05;②與對照組比較,P<0.05。
2.32組臨床療效比較治療后,觀察組總有效率顯著高于對照組(P<0.05)。見表3。
2.42組不良反應發生情況比較觀察組在治療期間偶有一過性胃腸道不良反應,包括惡心和腹瀉,無其他不良反應。對照組出現一過性輕微低血糖反應2例,低血糖反應發作時血糖值為2.9~3.6mmol/L,表現為頭暈、心悸、出汗,少量飲食或休息后緩解。

表3 2組臨床療效比較 例(%)
注:①與對照組比較,2=6.885,P<0.05。
3 討 論
BDR的眼底表現主要是視網膜內屏障遭到破壞,毛細血管閉塞,閉塞區附近產生微血管瘤、視網膜靜脈充盈擴張、小片狀出血,深層或淺層出血、滲出、棉絮斑,后級部視網膜水腫,進一步發展,視網膜和視乳頭上出現廣泛的新生血管,并有結締組織增殖,視網膜反復出血,棉絮狀滲出增多,嚴重損害視力。DR發病與糖尿病病程關系密切[5]。對于BDR患者,臨床上主要以控制血糖治療為主。通過控制患者的血糖水平來預防并發癥的發生,并改善機體的高糖環境,消除對血管造成的損傷。但部分患者存在血糖控制不佳或血糖波動等,使得視網膜病變呈進行性發展,因此及早治療可降低患者的視力損害,提高患者的生活質量。由于其發病機制的復雜性,目前還缺乏有效的防治措施。
GLP-1是腸道L細胞分泌的一種腸促胰素,與胰腺β細胞上GLP-1R特異性結合后,促進胞內胰島素合成分泌,實現葡萄糖依賴性的血糖調節。研究發現不僅在胰腺β細胞上,而且在神經系統、眼、腎等組織中都有GLP-1R的表達,提示GLP-1可能對糖尿病微血管并發癥(如周圍神經病變、視網膜病和腎病)有潛在的治療意義[6-7]。利拉魯肽是一類新型降糖藥物,屬于GLP-1R激動劑,能夠以葡萄糖濃度依賴性的方式促進胰島素的釋放、抑制胰高血糖素的釋放,在有效降低血糖的同時不會加重胰島素抵抗[8]。本研究發現,在利拉魯肽作用下,T2DM合并早期DR患者的FPG、2hPG以及HOMA-IR水平顯著降低,無低血糖發生,說明應用利拉魯肽不僅可以良好地控制血糖,增加胰島素敏感性,而且能夠減少血糖的波動性。
動物研究顯示,exendin-4可以防止糖尿病大鼠視網膜細胞的損失和維持正常視網膜的厚度[9]。但是,目前關于利拉魯肽治療糖尿病視網膜病變的療效尚未見明確報道。有個案報道應用艾塞那肽注射液有效控制糖代謝的同時,可以逆轉DR[10]。與上述研究相似,本研究發現觀察組總有效率顯著高于對照組,說明利拉魯肽能夠改善早期DR患者的臨床癥狀,提高視力水平。
DR是糖尿病微血管損害的表現,微血管形成是糖尿病視網膜病變發病的中心環節[11]。DR病變時視網膜缺氧缺血,釋放出來血管源性因子導致視網膜新生血管生成。VEGF是與血管增殖有關、調控血管生成中重要細胞因子。在正常狀態下,VEGF在眼部組織中呈低表達狀態。當視網膜缺氧缺血時,視網膜組織中VEGF水平明顯升高[12]。VEGF可以增加毛細血管通透性、刺激內皮細胞增生,加速細胞外基質沉積,促進毛細血管生長。IGF-1高表達時可以增加細胞合成 DNA的能力,同時易于趨化單核細胞侵入到眼內和視網膜上,局部IGF-1分泌過量后引起新生血管形成、內皮細胞的廣泛增殖和纖維組織的增生[13-14]。T2DM患者血清中 VEGF 及 IGF-1 水平隨著 DR 的發生、黃斑水腫以及 DR 的加重而逐漸升高,因此減少VEGF 和IGF-1的表達可以減少新生血管的形成,緩解視網膜病變病情。本研究發現,在GLP-1R激動劑作用下,BDR患者的VEGF 和IGF-1水平顯著降低,表明利拉魯肽可能通過降低血清VEGF 和IGF-1水平來發揮其對于視網膜微血管抑制作用。此外GLP-1可通過減少人視網膜上皮色素細胞(HRPE)上晚期糖基化產物(AGEs)受體及血液循環中黏附因子(ICAM-1和VCAM-1)的表達發揮對視網膜的保護作用[15]。Fu等[16]發現exendin-4可通過影響促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的表達來實現視網膜神經節細胞的保護作用。
綜上所述,利拉魯肽能夠有效控制血糖,增加胰島素敏感性,明顯改善臨床癥狀,提高視力水平,降低血清VEGF 和IGF-1水平,延緩DR的進程,無嚴重的不良反應發生。由于入選本研究的患者例數較少,觀察時間短,其對于視網膜微血管抑制作用機制尚待進一步研究深入,可能為其在DR治療中的應用提供新的思路。
[參考文獻]
[1]Leon Fernandez OS,Pantoja M,Diaz Soto MT,et al. Ozone oxidative post-conditioning reduces oxidative protein damage in patients with disc hernia[J]. Neurol Res,2012,34(1):59-67
[2]Gough SC,Jain R,Woo VC. Insulin degludec/liraglutide (IDeg-Lira) for the treatment of type 2 diabetes[J]. Expert Rev Endocrinol Metab,2016,11(1):7-19
[3]金興倩,李強. 胰高血糖素樣肽1與糖尿病微血管病變[J]. 中華糖尿病雜志,2015,7(11):712-714
[4]中華醫學會眼科學會眼底病學組. 我國糖尿病視網膜病變臨床診療指南(2014年)[J]. 中華眼科雜志,2014,50(11):851-865
[5]胡利,李東豪,陳慧. 糖尿病患者血糖控制相關因素與糖尿病視網膜病變發生的關系[J]. 中華眼底病雜志,2011,27(3):210-213
[6]Chilton R,Wyatt J,Nandish S,et al. Cardiovascular comorbidities of type 2 diabetes mellitus:defining the potential of glucagonlike peptide-1-based therapies[J]. Am J Med,2011,124,(Suppl): S35-53
[7]Anagnostis P,Athyros VG,Adamidou F,et al. Glucagon-like peptide-1-based therapies and cardiovascular disease: looking beyond glycaemic control[J]. Diabetes Obes Metab,2011,13(4):302-312
[8]Vanderheiden A,Harrison LB,Warshauer JT,et al. Mechanisms of action of liraglutide in patients with type 2 diabetes treated with high-dose insulin[J]. J Clin Endocrinol Metab,2016,101(4):1798-1806
[9]Zhang Y,Wang Q,Zhang J,et al. Protection of exendin-4 analogue in early experimental diabetic retinopathy[J]. Graefes Arch Clin Exp Ophthalmol,2009,247(5):699-706
[10] 徐靜,宋曉燕. 艾塞那肽注射液有效控制代謝同時逆轉糖尿病視網膜病變1例報告[J]. 中國實用內科雜志,2012,32(S2):58-59
[11] Soliman AZ,Silva PS,Aiello LP,et al. Ultra-wide field retinal imaging in detection, classification, and management of diabetic retinopathy[J]. Semin Ophthalmol,2012,27(5/6):226-232
[12] Wakabayashi Y,Usui Y,Okunuki Y,et al. Intraocular VEGF level as a risk factor for postoperative complications after vitrectomy for proliferative diabetic retinopathy[J]. Invest Ophthalmol Vis Sci,2012,53(10):6403-6410
[13] 劉波,林海,史紀文. 細胞因子VEGF、IGF-1與2型糖尿病視網膜病變的相關性研究[J]. 中國實驗診斷學,2012,16(7):1206-1208
[14] Sengupta N,Afzal A,Caballero S,et al. Paracrine modulation of CXCR4 by IGF-1 and VEGF: implications for choroidal neovascularization[J]. Invest Ophthalmol Vis Sci,2010,51(5):2697-2704
[15] Dorecka M,Siemianowicz K,Franeuz T,et al. Exendin-4 and GLP-1 decreases induced expression of ICAM-1, VCAM-l and RAGE in human retinal pigment epithelial cells[J]. Pharmacol Rep,2013,65(4):884-890
[16] Fu Z,Kuang HY,Hao M,et al. Protection of exenatide for retinal ganglion cells with different glucose concentrations[J]. Peptides,2012,37(1):25-31

