結球甘藍小孢子培養條件優化及高代自交系胚狀體誘導研究
蘇賀楠 韓風慶 楊麗梅 莊 木 張揚勇 王 勇 李占省 方智遠 呂紅豪
(中國農業科學院蔬菜花卉研究所,農業部園藝作物生物學與種質創制重點實驗室,北京100081)
結球甘藍(Brassica oleraceaL. var.capitataL.)是世界各地廣泛種植的十字花科蕓薹屬蔬菜作物,在我國的年栽培面積已達到90萬hm2(楊麗梅 等,2016)。結球甘藍具有明顯的雜種優勢,目前生產上的主栽品種幾乎均為一代雜種,雜交育種已成為結球甘藍育種的主要方式(楊麗梅 等,2003)。培育一代雜種,首先要獲得遺傳穩定的高代自交系,傳統育種需要7~8 a的時間,而利用小孢子培養可以在2 a內獲得純合的育種材料,加速自交系的選育過程;同時,隱性性狀易于表達,豐富了育種資源。
游離小孢子培養技術是在花藥培養的基礎上發展而來的一種單倍體誘導技術,減少了花藥壁和絨氈層對培養結果的影響,培養出的單倍體植株經自然加倍或者秋水仙素誘導加倍形成純合的雙單倍體植株(double haploid,DH)(Yuan et al.,2015)。DH群體是進行遺傳分析、圖譜構建和基因定位的理想材料,而經過鑒定獲得的優良DH系也為雜交育種提供了良好的材料基礎(孫繼峰 等,2012;Lv et al.,2014a,2014b;Liu et al.,2017)。自Lichter首次在油菜中利用小孢子培養獲得單倍體植株以來,在隨后的30 a間各國學者對這一技術進行了深入的研究,并已在多數十字花科蔬菜包括大白菜、結球甘藍中獲得了胚狀體(Lichter,1982;Takahata et al.,1991;Ver ó nica et al.,2015;Mukhlesur & Monika,2016)。
在結球甘藍中,近幾年國內外學者從基因型(Takahashi et al.,2012;Shumilina et al.,2015)、供體植株的生長環境、小孢子發育時期(王五宏等,2013;王玉書 等,2015)、預處理條件(張振超 等,2013;Shmykova et al.,2016)、培養條件(戴希剛 等,2012)、植株再生、倍性鑒定及染色體加倍(程芳芳 等,2015;祁魏崢 等,2015)等方面對游離小孢子培養技術進行了研究和改進,使得一部分基因型的小孢子出胚率在原有基礎上得到了提高。然而,結球甘藍小孢子培養仍存在一些問題:頑固難出胚基因型材料依然較多,因而培養條件和體系仍有待優化;研究材料大多集中在一代雜種上,關于高代自交系出胚的研究很少,因而利用差異大的高代自交系材料構建群體、挖掘出胚相關基因的研究鮮見報道。
本試驗擬通過對25份結球甘藍材料的花蕾長度及形態參數、花期和活性炭等影響小孢子胚狀體發生因素和雄配子發育過程進行研究,進一步優化小孢子培養體系;對高代自交系進行小孢子培養,篩選出胚率差異較大的親本材料,為下一步構建分離群體、挖掘出胚率相關基因和相關分子機制奠定基礎。
1 材料與方法
1.1 試驗材料
參試材料為中國農業科學院蔬菜花卉研究所甘藍青花菜課題組提供的25份結球甘藍材料,包括一代雜種5份、高代自交系20份,材料名稱及類型詳見表1。
2016年8月20日在本所試驗基地大棚內穴盤播種育苗,11月10日將半成株囤到陽畦越冬春化,2017年2月25日定植到日光溫室中,常規栽培管理;2017年4月上旬至5月上旬花期取材培養。
1.2 小孢子分離與培養
小孢子的分離與培養參照袁素霞(2009)和呂紅豪(2011)的方法并加以改進。① 取材:分別取長度為3.0~3.5 mm的花蕾,先用70%酒精滅菌30 s,再用7%次氯酸鈉滅菌12 min,無菌水清洗3次,每次3 min。② 游離:把滅過菌的花蕾放入10 mL玻璃試管內,加入少量經高溫高壓滅菌的B5培養基(購自Phytotechnology Laboratories)后研磨,使小孢子游離出來,用孔徑45 μm的尼龍篩網過濾到離心管中。再添加適量B5培養基,800 r?min-1離心5 min,棄上清液;重復3次。加入適量經抽濾滅菌的NLN培養基(購自Phytotechnology Laboratories,pH=5.9),用血球計數板調整小孢子懸浮液濃度為1×105個?mL-1。③ 培養:將小孢子懸浮液分裝進規格為60 mm×15 mm的培養皿中,每個培養皿3 mL,加入1滴經高溫高壓滅菌的0.5 g?L-1活性炭,封口并在黑暗條件下32 ℃熱激24 h,隨后在25 ℃、黑暗條件下培養。④ 出胚:經過21 d左右,小孢子出胚,統計出胚率(個?蕾-1)。每份材料設置3次重復,每重復3個培養皿。
1.3 花蕾形態參數與游離小孢子發育時期的關系
以01-88為試驗材料觀察結球甘藍花粉配子體發育過程。選取不同長度(2.5、3.0、3.5、4.0、5.0 mm)的花蕾放入FAA固定液中,32 h之后進行石蠟切片,觀察花粉配子體發育過程。① 脫水:50%、70%、85%、95%、100%乙醇,處理時間分別為 0.5 h、0.5 h、0.5 h、0.5 h、20 min。② 透明:將脫水后的材料依次置于1/2二甲苯+1/2無水乙醇、純二甲苯、純二甲苯中,處理時間分別為0.5 h、1.0 h、0.5 h。③ 透蠟:將透明好的材料放入少量二甲苯,加入石蠟蠟屑,放入37 ℃恒溫箱,過夜,敞口放置,使其中的二甲苯慢慢揮發。④ 換蠟:第2天倒出石蠟、二甲苯混合液,在65 ℃烘箱中進行,加入已經熔化的純蠟,間隔2 h換1次,共換2次。⑤ 包埋:在60 ℃烘箱中進行,將融化的石蠟倒入預熱的紙盒內,將透好蠟的材料擺放在熔蠟中,輕輕將蠟盒平移到室溫環境中,待紙盒內底層蠟稍凝固,用預熱的鑷子將材料直立整齊地排列在軟蠟層上,待材料固定不再飄動后,將蠟盒平移到冷水中待完全凝固。⑥ 切片:用Leica輪轉式切片機切片,厚度為10 μm。⑦ 貼片與烘片:用玻璃棒輕蘸1小滴粘片劑,涂抹均勻,貼片時蒸餾水用量為1~2滴,烘片臺溫度設置為39 ℃。⑧ 脫蠟:把烘干的切片放入二甲苯中,每次5 min,共2次。⑨ 甲苯胺藍染色,顯微鏡照相觀察。設置3次重復,每次選取3個花蕾。
以中甘628和01-88為試驗材料,分別選取主花序,將花蕾依照長度(2.5、3.0、3.5、4.0、5.0 mm)分為5個組別,每個組別中隨機選取3個花蕾,測定花蕾長度,計算花藥長度/花瓣長度的比值;用小鑷子挑開花蕾,小心擠出少量花粉,均勻鋪平于載玻片上,利用顯微鏡觀察小孢子的發育時期與花蕾長度的相關性。
1.4 基因型對游離小孢子培養出胚率的影響
在相同適宜條件下(pH值為5.9的NLN培養基,32 ℃熱激24 h,0.5 g?L-1的活性炭1滴)對25份結球甘藍材料進行游離小孢子培養,21 d后統計出胚率。設置3次重復,每重復3個培養皿。
1.5 不同花期與游離小孢子培養出胚率的關系
以中甘628和01-88為試驗材料,分別于初花期、盛花期和末花期取花蕾進行游離小孢子培養(pH值為5.9的NLN培養基,32 ℃熱激24 h,0.5 g?L-1的活性炭1滴),21 d后統計出胚率。設置3次重復,每次每份材料選取3個花蕾。
初花期是指主枝的花朵開放時期(3月下旬至4月上旬),盛花期是指大部分側枝頂部花朵開放時期(4月上旬至4月下旬),末花期指側枝花朵全開放至花蕾停止發育(4月下旬至5月中旬)。
1.6 活性炭濃度對游離小孢子培養出胚率的影響
以中甘628和01-88為試驗材料,在相同適宜條件下(pH值為5.9的NLN培養基,32 ℃熱激24 h)分別添加0.25、0.50 g?L-1活性炭,以不添加活性炭的處理為對照,進行游離小孢子培養,21 d后統計出胚率。設置3次重復,每處理3個培養皿。
1.7 數據處理
試驗數據采用SPSS 17.0軟件進行統計分析,利用Excel 2007軟件進行數據處理和圖表繪制。
2 結果與分析
2.1 基因型對結球甘藍游離小孢子培養出胚率的影響
由表1和圖1可以看出,供試的25份結球甘藍材料中,有11個基因型產生了胚狀體,都是春甘藍圓球類型,而秋甘藍扁球類型均未出胚。一代雜種中,中甘628為最易出胚材料,平均出胚率高達19.8個?蕾-1,極顯著高于其他品種;中甘828、中甘23、中甘192未有胚狀體產生。在20份高代自交系中,01-88為最易出胚材料,平均出胚率高達47.5個?蕾-1,極顯著高于其他自交系;084、96-100-312等11份材料未出胚。
中甘628是高代自交系87-534與SG643的雜交F1,其出胚率為19.8個?蕾-1,極顯著高于兩個親本自交系的出胚率(0.3、2.6個?蕾-1);中甘828是高代自交系87-534與96-100-312的雜交F1,其出胚率為0個?蕾-1,其親本自交系的出胚率為0.3、0個?蕾-1。由此可見,不同結球甘藍材料中胚誘導相關基因的遺傳和分子機制可能不同。
2.2 花蕾長度及形態參數與結球甘藍小孢子發育時期的關系
由圖2可知:花粉母細胞經過減數分裂后形成四分體(圖2-a);早期小孢子體積增大,顏色加深,細胞核位于中央,屬于單核早期(圖2-b);隨后,細胞核移向細胞壁,花粉萌發溝清晰可見,此時呈不明顯的三棱狀,此階段是單核靠邊期(圖2-c);小孢子細胞核進行1次有絲分裂,形成1個生殖核和1個營養核,進入雙核期(圖2-d)。

表1 不同基因型對結球甘藍游離小孢子培養出胚率的影響

圖1 部分結球甘藍游離小孢子培養出胚情況
花粉的發育時期是影響小孢子最終出胚量的關鍵因素之一,花粉發育時期的選擇與植株花蕾的長度及形態參數密切相關,單核靠邊期即單核晚期是結球甘藍小孢子培養的最適時期,此時小孢子形態呈現出不明顯三棱狀。切片后在顯微鏡下觀察結球甘藍不同大小花蕾的花粉細胞發育時期,結果發現兩個不同基因型中甘628和01-88表現相似。由表2可知,當花蕾長度在3.0~3.5 mm之間、花藥長度∶花瓣長度為3∶2至2∶1時,處于單核靠邊期的小孢子占67%~71%,利于游離小孢子培養出胚。

圖2 01-88花粉配子體發育途徑

表2 結球甘藍不同長度花蕾中單核靠邊期小孢子的比例
2.3 不同花期對結球甘藍游離小孢子培養出胚率的影響
由表3可知,兩種不同基因型的結球甘藍出胚率最高時的取蕾時期不同,其中一代雜種中甘628在初花期的出胚率最高,達19.8個?蕾-1,自交系01-88在盛花期的出胚率最高,達47.5個?蕾-1;兩種基因型出胚率最低的取蕾時期都在末花期,分別為0.3、0.7個?蕾-1;初花期和盛花期取蕾的出胚率極顯著高于末花期,說明初花期和盛花期是游離小孢子培養的適宜時期。
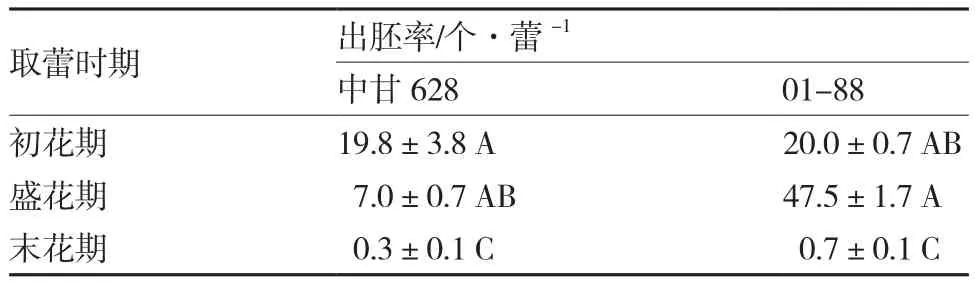
表3 取蕾時期對結球甘藍游離小孢子培養出胚率的影響
2.4 活性炭濃度對結球甘藍游離小孢子培養出胚率的影響
從表4可以看出,對兩種不同基因型結球甘藍來說,在培養基中加入0.25、0.50 g?L-1的活性炭后,游離小孢子出胚率都極顯著提高,中甘628出胚率分別達到12.0、19.8個?蕾-1,01-88出胚率分別達到35.3、47.5個?蕾-1;兩種不同濃度的活性炭處理之間游離小孢子出胚率差異未達極顯著水平,說明適當濃度的活性炭可以提高結球甘藍小孢子胚誘導率。

表4 不同濃度活性炭對結球甘藍游離小孢子培養出胚率的影響
3 結論與討論
游離小孢子培養是提高育種效率、豐富育種資源的重要手段,獲得的DH群體也是進行遺傳分析、圖譜構建和基因定位的理想材料。近年來,結球甘藍游離小孢子培養技術取得了較大進展,但仍存在一些問題,如培養體系不夠完善、胚誘導的相關分子機制尚不明確等,阻礙了小孢子培養技術在育種中的進一步應用。
在培養體系方面,研究表明影響小孢子培養成胚的關鍵因素包括基因型、取蕾時期、活性物質等。基因型是影響小孢子培養出胚的關鍵因素,不同基因型之間出胚率差異較大,供體植株的基因型不僅影響小孢子的產胚率,而且也影響胚的質量(王超楠 等,2010;顧祥昆 等,2013)。以往有關研究著重介紹了一代雜種的出胚率,桑玉芳等(2007)比較分析了19個結球甘藍一代雜種游離小孢子的出胚情況,結果發現出胚率>1個?蕾-1的品種只有10個;關于自交系材料研究較少,楊安平等(2009)分別用25份結球甘藍F1及其50份親本,產胚困難的22份結球甘藍F1及其相應的F2,1份產胚能力強的結球甘藍與22份產胚困難材料的正、反交后代,在同等條件下進行小孢子培養,結果發現結球甘藍F1較其親本產胚能力強,對產胚困難的結球甘藍F1,以其F2為試材可誘導產胚或提高胚產量,用產胚能力強的結球甘藍作親本與產胚困難的材料雜交,正、反交均能明顯提高產胚困難材料的產胚能力。本試驗以25份不同基因型結球甘藍為試材(其中有20份高代自交系),在相同適宜培養條件下進行游離小孢子培養,結果發現共有11個基因型(2份一代雜種和9份高代自交系)產生了胚狀體,且不同材料之間小孢子出胚率差異顯著,中甘628的出胚率極顯著高于兩個親本自交系87-534與SG643,可見以產胚率較高的結球甘藍作親本與產胚困難的材料雜交,能明顯提高雜交后代的產胚能力,這與前人的研究結果相似。
在十字花科蔬菜花藥和游離小孢子培養中,單核期和雙核早期通常認為是小孢子最適培養的時期(星曉蓉,2011),而不同花蕾的大小對應著小孢子不同的發育時期,選擇最佳花蕾長度非常關鍵。因此,本試驗采用石蠟切片技術對結球甘藍配子體發育進行了詳細觀察,分別觀察到四分體時期、單核早期、單核晚期、雙核期,并明確了關鍵時期(單核期和雙核早期)與花蕾長度和花藥、花瓣長度比值之間的對應關系,為選取取樣最適時期的花蕾提供了細胞學依據。曾愛松等(2015)利用DAPI染色對甘藍花粉發育途徑進行觀察,發現6個品種的花蕾長度基本在3.5~4.5 mm范圍內處于單核靠邊期的小孢子比例最高。本試驗對2個易出胚的甘藍材料進行觀察,發現花蕾長度在3.0~3.5 mm之間,且花藥長度∶花瓣長度為3∶2至2∶1時,處于單核靠邊期的小孢子比例最高,該結果中適宜的花蕾長度較前人研究中的稍短,可能與基因型不同有關。
取蕾時期也是影響結球甘藍小孢子出胚率的重要因素之一。馮輝等(2007)對羽衣甘藍的研究發現,盛花期是最適宜的取蕾時期;曾愛松等(2010)研究認為,結球甘藍取蕾時期對易出胚和難出胚的材料影響不一致,對于易出胚材料,花期對胚胎發生影響不大,出胚率都基本穩定,對于難出胚材料,開花初期至盛花中期取樣培養易獲得成功,而末花期很少有胚狀體產生。本試驗利用2個易出胚基因型進行花期對小孢子培養出胚率影響的研究,結果表明2個基因型出胚率最高的花期不同,一代雜種中甘628在初花期出胚率最高,達19.8個?蕾-1,高代自交系01-88在盛花期出胚率最高,達47.5個?蕾-1,二者出胚率最低時期一致。
在培養基中添加一些活性成分會影響小孢子的產胚能力。蔣武生等(2008)在大白菜游離小孢子培養中發現添加活性炭(0.5 mg?L-1)較未添加活性炭的對照培養效果好,兩個處理小孢子胚誘導率相差4~17倍;韓陽等(2006)在大白菜游離小孢子培養中發現100、200 mg?L-1活性炭對大白菜小孢子的胚胎發生有抑制作用。本試驗結果表明,加入0.25、0.50 g?L-1活性炭均有利于結球甘藍胚狀體發生,這可能與活性炭能吸附培養過程中的部分有害物質有關。
目前,關于小孢子培養出胚相關分子機制的研究很少,Malik等(2007)通過構建cDNA文庫從甘藍型油菜0 h(晚無核到早期雙核小孢子)、3 d(32℃熱激處理誘導小孢子)、5 d(分裂小孢子)和7 d(胚性小孢子)小孢子中分離出來LEC1、LEC2、BBM,這3個基因在小孢子胚胎形成時起著重要的作用。Kitashiba等(2016)利用高出胚大白菜品種Ho-Me和低出胚大白菜品種CR-Seiga構建小孢子群體,利用偏分離確定與小孢子胚胎發生相關的基因位點,確定了3個與小孢子培養胚產量相關物理位置。然而在結球甘藍中還未見與小孢子胚胎發生相關的基因及分子機制研究,本試驗得到的高、低出胚自交系材料為下一步開展甘藍小孢子培養出胚機制的研究打下了基礎。
本試驗從基因型、取蕾時期、活性物質等方面進一步探討和優化了結球甘藍小孢子培養的條件;獲得的純合DH系為育種提供了材料;獲得的出胚率差異大的自交系也為下一步構建群體、挖掘胚誘導相關基因及分子機制的研究做好了鋪墊,進一步的工作正在開展中。
程芳芳,張恩慧,楊安平,程永安,許忠民,董韓,霍柳青.2015.甘藍小孢子單倍體植株加倍技術探討.西北農林科技大學學報:自然科學版,43(6):167-173.
戴希剛,施雪萍,包滿珠.2012.基因型與培養條件對羽衣甘藍小孢子胚胎發生的影響.植物生理學報,48(11):1113-1119.馮輝,姜鳳英,馮建云,王超楠.2007.羽衣甘藍游離小孢子培養技術研究及應用.園藝學報,34(4):1019-1022.
顧祥昆,李菲,張淑江,章時蕃,張慧,孫日飛.2013.芥菜游離小孢子培養技術研究.中國蔬菜,(12):23-30.
韓陽,葉雪凌,馮輝.2006.大白菜小孢子培養影響因素研究.中國蔬菜,(7):16-18.
蔣武生,姚秋菊,張曉偉,原玉香,耿建峰.2008.活性炭和振蕩培養對提高大白菜胚誘導率的影響.中國瓜菜,21(4):1-3.
呂紅豪.2011.甘藍枯萎病抗源篩選和抗性遺傳研究〔碩士論文〕.北京:中國農業科學院.
祁魏崢,頡建明,郁繼華,康俊根.2015.甘藍游離小孢子培養及再生植株倍性鑒定研究.西南農業學報,28(6):2381-2388.
桑玉芳,張恩慧,楊安平,馬超,許忠民,程永安,白延紅.2007.甘藍游離小孢子培養中影響胚狀體形成的主要因素.西北農業學報,16(2):125-129.
孫繼峰,劉玉梅,方智遠,劉二艷,袁素霞,李占省,楊麗梅,莊木,張揚勇,孫培田.2012.青花菜相同親本的DH與F2群體遺傳多樣性的比較.園藝學報,39(6):1090-1098.
王超楠,聞鳳英,劉曉暉,羅智敏,趙冰.2010.球莖甘藍小孢子培養中影響胚誘導的幾個因素.中國蔬菜,(10):35-39.
王五宏,葉國銳,李必元,岳智臣,鐘新民.2013.結球甘藍小孢子胚誘導與植株再生.核農學報,27(6):715-722.
王玉書,王歡,范震宇,馮輝.2015.觀賞羽衣甘藍小孢子培養及再生植株倍性變異.核農學報,29(6):1037-1043.
星曉蓉.2011.白菜型油菜小孢子培養成胚率及植株再生的影響因素.西北農業學報,20(7):94-97.
楊安平,張恩慧,尚麗榮,朱守亮,李宏偉,許忠民,白延紅.2009.結球甘藍F1、F2、雙交種及其親本的游離小孢子胚胎發生能力分析.西北農林科技大學學報:自然科學版,37(8):171-176.
楊麗梅,方智遠,劉玉梅,莊木,張揚勇,孫培田.2003.利用小孢子培養選育甘藍自交系.中國蔬菜,(6):36-37.
楊麗梅,方智遠,莊木,張揚勇,呂紅豪,劉玉梅,李占省.2016.“十二五”我國甘藍遺傳育種研究進展.中國蔬菜,(11):1-6.
袁素霞.2009.甘藍和青花菜小孢子培養及早期胚胎形成相關基因差異表達分析〔博士論文〕.北京:中國農業科學院.
曾愛松,馮翠,高兵,宋立曉,嚴繼勇.2010.結球甘藍小孢子培養技術體系的優化研究.華北農學報,25(S2):40-44.
曾愛松,高兵,宋立曉,張云霞,李健綺,嚴繼勇.2015.耐寒結球甘藍小孢子培養及其發育過程.中國農業大學學報,20(2):86-92.
張振超,耿鑫鑫,戴忠良,潘躍平,王兵,許玲,顏志明,周偉軍.2013.甘藍類植物小孢子培養及植株再生研究.核農學報,27(7):929-937.
Kitashiba H,Taguchi K,Kaneko I,Inaba K,Yokoi S J,Takahata Y,Nishio T.2016.Identification of loci associated with embryo yield in microspore culture ofBrassica rapaby segregation distortion analysis.Plant Cell Report,35(10):2197-2204.
Lichter R.1982.Induction of haploid plants from isolated pollen ofBrassica napus.Zeitschrift F ü r Pflanzenphysiologie,105(5):427-434.
Liu X,Han F Q,Kong C C,Fang Z Y,Yang L M,Zhang Y Y,Zhuang M,Liu Y M,Li Z S,Lv H H.2017.Rapid introgression of the Fusarium wilt resistance gene into an elite cabbage line through the combined application of a microspore culture,genome background analysis,and disease resistance-specific marker assisted selection.Frontiers in Plant Science,8:1-11.
Lv H H,Wang Q B,Zhang Y Y,Yang L M,Fang Z Y,Wang X W,Liu Y M,Zhuang M,Lin Y,Yu H L,Liu B.2014a.Linkage map construction using InDel and SSR markers and QTL analysis of heading traits in cabbage.Molecular Breeding,34:87-98.
Lv H H,Wang Q B,Yang L M,Fang Z Y,Zhuang M,Zhang Y Y,Sun P T.2014b.Breeding of cabbage(Brassica oleraceaL. var.capitata)with Fusarium wilt resistance based on microspore culture and marker-assisted selection.Euphytica,200(3):465-473.
Malik M R,Wang F,Dirpaul J M,Zhou N,Polowick P L,Ferrie A M R,Krochko J E.2007.Transcript profiling and identification of molecular markers for early microspore embryogenesis inBrassica napus.Plant Physiology,144(1):134-154.
Mukhlesur R,Monika M.2016.Behind the scenes of microspore-based double haploid development inBrassica napus:a review.Journal of Plant Science & Molecular Breeding,5(1):1-9.
Shmykova E,Shumilina T,Suprunova P.2016.Doubled haploid production inBrassicaL. species.Russian Journal of Genetics Applied Research,6(1):68-77.
Shumilina N,Shmykova L,Bondareva T.2015.Effect of genotype and medium culture content on microspore-derived embryo formation in Chinese cabbage(Brassica rapassp.chinensis)cv. Lastochka.Biology Bulletin,42(4):302-309.
Takahashi Y,Shuji Y,Yoshihito T.2012.Effects of genotypes and culture conditions on microspore embryogenesis and plant regeneration in several subspecies ofBrassica rapaL.Plant Biotechnology Reports,6(4):297-304.
Takahata Y,Brown D,Keller W.1991.Effect of donor plant age and inflorescence age on microspore culture ofBrassica napusL.Euphytica,58(1):51-55.
Ver ó nica P V,Patricia C M,Alba R S,Segu í-Simarro J M.2015.Induction of embryogenesis inBrassica napusmicrospores produces a callosic subintinal layer and abnormal cell walls with altered levels of callose and cellulose.Frontiers in Plant Science,6:1-17.
Yuan S X,Su Y B,Liu Y M,Li Z S,Fang Z Y,Yang L M,Zhuang M,Zhang Y Y,Lv H H,Sun P T.2015.Chromosome doubling of microspore-derived plants from cabbage(Brassica oleraceavar.capitataL.)and broccoli(Brassica oleraceavar.italicL.).Frontiers in Plant Science,6:1-10.

