胃癌患者外周血常規指標與腫瘤淋巴結轉移關系分析*
鄧顯倫,馮立波,徐建偉,向繼勇,夏 冬△
(1.西南醫科大學附屬醫院普外科,四川瀘州 646000;2.中江縣人民醫院普外科,四川德陽 618100)
胃癌仍是我國最常見的惡性腫瘤之一,近年來發病率呈上升趨勢[1]。淋巴結轉移是影響胃癌患者預后及選擇治療方式的重要因素[2]。對于無淋巴結轉移的患者,過度的淋巴結清掃,不僅增加了手術的創傷也降低了患者術后的生存質量。因此如何在術前預測是否存在淋巴結轉移具有重要的臨床意義。國內外有大量研究證實一些臨床上常用的血常規指標如中性粒細胞/淋巴細胞比值(NLR)、血小板/淋巴細胞比值(PLR)等在胃癌患者明顯升高且與預后相關[3-4]。提示血常規指標可能與胃癌淋巴結轉移相關。故本研究回顧性全面分析了血常規指標與胃癌淋巴結轉移的關系,探討這些指標對胃癌淋巴結轉移的預測價值。
1 資料與方法
1.1一般資料 收集2014年7月至2016年4月于西南醫科大學附屬醫院普外科及中江縣人民醫院普外科住院的胃癌患者。所有入組患者均經手術治療,并且由病理組織學檢查明確診斷為原發性胃癌。排除標準:(1)近2個月內有活動性出血或者輸注血制品;(2)近2個月內接受過抗血小板治療、抗凝治療、升白細胞治療、升紅細胞治療;(3)合并嚴重感染;(4)伴發甲狀腺功能亢進或減退、結締組織病等影響血液系統的疾病;(5)伴有嚴重心、肝、腎等其他器官障礙。本研究為回顧性分析。最終入組病例共315例,其中男197例,女118例;平均年齡(55.37±10.07)歲。所有患者均進行標準的D2胃癌根治性切除術,術中所有患者淋巴結清掃數量不少于15枚。清掃淋巴結進行HE染色,由病理科醫生判斷是否有淋巴結轉移。按照第13版日本《胃癌處理規約》標準判斷患者淋巴結轉移情況。根據是否發生淋巴結轉移,將患者分為轉移組(n=231)和非轉移組(n=84)。 轉移組男143例,女88例,平均年齡(58.82±11.13)歲,非轉移組男54例,女30例,平均年齡(52.59±13.47)歲。
1.2方法 收集患者臨床資料,包括年齡、性別、腫瘤組織學分化程度、病理類型、發病部位等。術前清晨空腹采集患者外周靜脈血2 mL, 乙二胺四乙酸二鉀(EDTA-K2)抗凝,采用SYSMEX XE-2000血液細胞分析儀檢測白細胞計數(WBC)、中性粒細胞計數(NE)、淋巴細胞計數(LY)、紅細胞計數(RBC)、血紅蛋白(Hb)水平和血小板計數(PLT)。計算NLR和PLR。
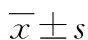
2 結 果
2.1兩組患者人口學及臨床特征 轉移組年齡(P=0.032)、低分化及未分化水平(P=0.019)、腫瘤浸潤深度(P=0.001)均高于非轉移組,腫瘤發生部位在兩組間差異無統計學意義(P=0.796),見表1。

表1 兩組患者人口學及臨床特征比較
2.2轉移組淋巴結轉移情況 有淋巴結轉移的231例胃癌患者中,發生第1站淋巴結轉移126 例,第1站淋巴結轉移以胃小彎淋巴結和胃短血管、胃網膜淋巴結轉移頻次最高,發生第2站淋巴結轉移105 例,第2站淋巴結轉移以胃左動脈淋巴結和肝總動脈前、后淋巴結轉移頻次最高。本文納入分析所有患者均未清掃第3站淋巴結。見表2。
2.3兩組患者血常規指標的比較 與非轉移組患者比較,轉移組患者WBC、NE、PLT、NLR及PLR均升高(P<0.05)。LY、RBC及Hb水平及在兩組間差異無統計學意義(P>0.05),見表3。
2.4血常規指標與腫瘤淋巴結轉移的關系 將上述兩組間差異有統計學意義的指標一起進行多因素Logistic 回歸分析,結果表明術前NLR(P=0.002,OR=3.681)和PLT計數(P=0.014,OR=0.841)是胃癌患者發生腫瘤轉移的獨立預測因素,見表4。

表2 轉移組患者淋巴結轉移情況(n)
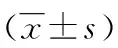
表3 兩組患者血常規指標比較

表4 胃癌患者血常規指標與淋巴結轉移多因素Logistic 回歸分析結果
3 討 論
胃癌是全球最常見的消化道惡性腫瘤,在導致癌癥相關性死亡疾病中排第3位[5]。近年來我國胃癌發病率呈上升趨勢,城鄉居民胃癌發病率為36.21/10萬[1]。大多數胃癌患者可出現淋巴轉移、血源轉移和直接侵襲等轉移,其中淋巴結轉移是胃癌最常見的轉移方式,可明顯影響治療方式的選擇、療效和預后[6]。而且近年來對于早期胃癌患者,內鏡下黏膜剝離術(ESD)和內鏡下黏膜切除術(EMR)日漸受到關注[7]。但對于存在淋巴結轉移的患者,這種微創手術存在復發風險,影響治療效果。故準確預測胃癌患者是否存在淋巴結轉移在目前日益重要。
近年來,炎癥和惡性腫瘤的關系逐漸被闡明。惡性腫瘤的表型異常及腫瘤引起的組織破壞可以引起廣泛的炎性反應,刺激炎細胞浸潤,故而惡性腫瘤患者,尤其是晚期腫瘤患者常常表現出NE增高,淋巴細胞相對減少[8]。惡性腫瘤也可以通過誘導促血板生成素(TPO)增加,產生IL-1等血小板激活物、釋放組織因子啟動外源性凝血系統等機制激活并誘導血小板聚集,從而在外周血中表現出血小板增加[9]。本研究發現,與非轉移組患者比較,轉移組患者WBC、NE、PLT、NLR和PLR均顯著升高。提示發生淋巴結轉移的胃癌患者對機體具有更強的侵襲能力,刺激較多的炎癥間質產生,從而引起NE、PLT等的增高。在本研究中轉移組患者和非轉移組患者間淋巴細胞計數無明顯差異,提示在淋巴結轉移的胃癌患者淋巴細胞只是相對減少。
惡性腫瘤的侵襲及轉移與腫瘤微環境密切相關,腫瘤微環境中的炎性細胞可以通過釋放炎癥介質介導細胞損傷、DNA突變等,改變腫瘤微環境,促進腫瘤細胞的增殖、侵襲、遷移及血管生成[10]。NE是循環中血管內皮細胞生長因子(VEGF) 的主要來源,VEGF是強烈的促進胃癌血管及淋巴管新生的因子[11]。NE升高導致VEGF表達增加,進而有利于促進胃癌細胞經淋巴管轉移。胃癌患者中性粒細胞的升高導致NLR升高,NLR可以更好地反映腫瘤患者體內炎癥和免疫狀態,NLR升高提示胃癌患者體內炎性反應增強,而抑制腫瘤能力相對低下。多項研究表明NLR是胰腺癌、肺癌、結直腸癌、乳腺癌等多種腫瘤的獨立預后因素[12-13]。李書梅等[3]發現外周血NLR在胃癌患者顯著升高,可能是影響胃癌患者預后的獨立因素。本研究的研究表明術前NLR是胃癌患者發生腫瘤轉移的獨立預測因素。提示術前NLR可以用于協助判斷胃癌患者是否存在淋巴結轉移。
本研究發現轉移組胃癌患者PLT計數較非轉移組患者明顯升高,且血小板計數是胃癌患者發生腫瘤轉移的獨立預測因素。近年來研究發現PLT在食管癌、結直腸癌、肺癌、肝癌等多種實體腫瘤中增高,并且是判斷癌癥預后的一個重要參考指標。沈淑蓉等[14]也證實在胃癌患者存在繼發性PLT增多,且與腫瘤直徑、浸潤深度、分期有關,PLT增多可以作為胃癌患者預后不良的參考指標。PLT可釋放轉化生長因子(TGF)、血小板衍化生長因子(PDGF)等[15],上述因子均可直接刺激腫瘤細胞生長。此外,PLT還可與纖維蛋白一起包裹腫瘤細胞,保護腫瘤細胞免予機體的免疫清除。血小板也可表達血管假性血友病因子、選擇素等多種黏附分子,這協助腫瘤細胞黏附于血管、淋巴管內皮形成癌栓[16]。故在胃癌患者PLT增加可以促進胃癌細胞的生長、增加淋巴結轉移的風險。
本研究表明術前NLR和PLT升高是胃癌患者發生腫瘤轉移的獨立預測因素。NLR和PLT是臨床上最常用的指標,廉價且易于獲得。故可方便地用于幫助臨床醫生術前判斷是否存在淋巴結轉移。
[1]陳萬青,張思維,鄭榮存,等.中國2009年惡性腫瘤發病和死亡分析[J].中國腫瘤,2013,22(1):7-8.
[2]AJANI J A,D′AMICO T A,ALMHANNA K,et al.Gastric cancer,version 3.2016,NCCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2016,14(10):1286-1312.
[3]李書梅,徐小莉,梁迪,等.外周血中性粒細胞與淋巴細胞比值以及血小板與淋巴細胞比值評估胃癌患者預后的價值[J].中華腫瘤雜志,2014,36(12):910-915.
[4]XU Z,XU W,CHENG H,et al.The prognostic role of the platelet-lymphocytes ratio in gastric cancer:A Meta-analysis[J].PLoS One,2016,11(9):e0163719.
[5]THRUMURTHY S G,CHAUDRY M A,HOCHHAUSER D,et al.The diagnosis and management of gastric cancer[J].BMJ,2013,4:347.
[6]ZHAO B W,CHEN Y M,JIANG S S,et al.Lymph node metastasis,a unique independent prognostic factor in early gastric cancer [J].PLoS One,2015,10(7):e0129531.
[7]OMAE M,FUJISAKI J,HORIUCHI Y,et al.Safety,efficacy,and long term outcomes for endoscopic submueosal dissection of early esophagogastric junction cancer [J].Gastric Cancer,2013,16(2):147-154.
[8]KAO S C,PAVLAKIS N,HARVIE R,et al.High blood neutrophil-to-lymphocyte ratio is an indicat or of poor prognosis in malignant mesothelioma patients undergoin systemic therapy[J].Clin Cancer Res,2010,16(23):5805-5813.
[9]GOUBRAN H A,STAKIW J,RADOSEVIC M,et al.Platelet-cancer interactions[J].Semin Thromb Hemost,2014,40(3):296-305.
[10]LJ G,WANG Z,YE J,et a1.Uncontrolled inflammation induced by AEG-1 promotes gastric cancer and poor prognosis [J].Cancer Res,2014,74(19):5541-5552.
[11]RAPISARDA A,MELILLO G.Role of the VEGF/VEGFR axis in cancer biology and therapy[J].Adv Cancer Res,2012,114:237-267.
[12]ASAOKA T,MIYAMOTO A,MAEDA S,et al.Prognostic impact of preoperative NLR and CA19-9 in pancreatic cancer[J].Pancreatology,2016,16(3):434-440.
[13]ZHANG H,ZHANG L,ZHU K,et al.Prognostic significance of combination of preoperative platelet count and neutrophil-lymphocyte ratio(COP-NLR) in patients with non-small cell lung cancer:based on a Large Cohort Study[J].PLoS One,2015,10(5):e0126496.
[14]沈淑蓉,鄭文球,黃穎鵬,等.胃癌伴繼發性血小板增多癥患者的臨床病理特征和生存分析[J].腫瘤學雜志,2014,20(10):823-828.
[15]HUANG F,WANG M,YANG T,et al.Gastric cancer-derived MSC-secreted PDGF-DD promotes gastric cancer progression[J].J Cancer Res Clin Oncol,2014,140(11):1835-1848.
[16]ULGER Z,AKSU S,AKSOY D Y,et al.The adhesion molecules of L-selectin and ICAM-1 in thrombocytosis and thrombocytopenia[J].Platelets,2010,21(1):49-52.

