磁共振擴散張量成像在大鼠C6腦膠質瘤分級中的應用研究*
李香營,蔣錫麗,楊 光,陳建強,戰躍福,唐少虎,韓向君
(中南大學湘雅醫學院附屬海口醫院/海口市人民醫院放射科,海口 570208)
膠質瘤是中樞神經系統最常見的原發性惡性腫瘤[1],術前準確評估膠質瘤的惡性程度對預測腫瘤生物學行為,制定手術方案至關重要。磁共振擴散張量成像(diffusion tensor imaging,DTI)作為一種新的成像方法,可以反映組織微觀結構變化,廣泛用于膠質瘤診斷、鑒別診斷、分級及手術方案的制訂[2-3]。本研究旨在探討臨床3.0T DTI在Wistar大鼠C6腦膠質瘤分級中的應用價值。
1 材料與方法
1.1材料 C6膠質瘤細胞株購于中國科學院上海生命科學研究院細胞所,復蘇后培養于10%胎牛血清、1%青鏈霉素混合液的RPMI-1640培養基中,傳代接種。采用隨機數字表將67只體質量215~330 g健康雌性Wistar大鼠分成實驗組57只,對照組10只。注射濃度大于1×106/10 μL,注射點位于bregma點前1 mm,矢狀縫右旁開3 mm處,注射方式采用硬腦膜下進6 mm,退1 mm,微量注射器注射速度為10 μL/min,整個過程緩慢進行,接種后大鼠先單籠喂養,記錄蘇醒時間、飲水進食及精神狀態等。對照組為假手術組,注射相同劑量不含C6膠質細胞的全培養基。
1.2方法
1.2.1DTI掃描及圖像處理 DTI掃描采用美國GE公司3.0T醫用掃描機,配備大鼠專用線圈,通道數目為8,所有成活大鼠分別在接種后第1~2周(22只)和3~4周(35只)行常規MRI及DTI檢查,增強方式采用尾靜脈注射釓噴替酸葡甲胺(Gd-DTPA,Mmagnevist,Schering,德國)2.5~3 mL/kg,增強序列為常規軸位T1WI和T1-3D-IR-FSPGR序列。 T2WI序列參數為TR 3 000 ms,TE 120 ms,層間距 0 mm,層厚 3 mm,矩陣 192×192。DTI采用自旋回波的回波平面成像(SE-EPI),15個非共線梯度方向,梯度擴散因子(b)值為0、800 s/mm2,TR 2 500 ms,TE 88.7 ms。
DTI原始數據均由GE公司ADW4.4后處理工作站的Function Tool軟件進行,首先消除圖像噪聲,經工作站自動計算產生部分各向異性分數(FA)圖,并進行圖像配準,獲得瘤體感興趣區(ROI)的FA 值。ROI選擇避開出血、壞死、腦溝裂池等影響測量結果的區域[4],以降低測量誤差。圖像分析由兩名高級職稱神經影像專家共同完成,在兩人達成共識的情況下確定瘤體及對側鏡像腦組織區各多個等大(2 mm2,9Pix)ROI,得到相應部位的FA值。
1.2.2HE染色和免疫組織化學檢查 所有接受DTI掃描的大鼠,1%戊巴比妥鈉(40 mg/kg)麻醉后經心臟灌注4%多聚甲醛固定全腦24~48 h切片,取瘤體最大層面做連續冠狀切片進行HE染色,光鏡下觀察接種腫瘤的分化程度,根據世界衛生組織(WHO)2002年中樞神級系統腫瘤的分類分級標準

A、B:T1增強及FA偽彩圖顯示右側大鼠大腦半球低級別C6膠質瘤。C、D:T1增強及FA偽彩圖顯示右側大鼠大腦半球高級別C6膠質瘤,瘤體內出現壞死
圖1不同級別C6腦膠質瘤T1增強和FA圖
確定膠質瘤分級,低級別膠質瘤為WHO Ⅰ~Ⅱ級,高級別膠質瘤為WHOⅢ~Ⅳ級。另取切片3張行GFAP免疫組織化學檢查,方法按試劑盒說明書完成。
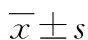
2 結 果
2.1MRI檢查結果 實驗組57只大鼠均成功完成MRI掃描,低級別膠質瘤體積相對較小,信號均勻,增強后多呈輕度均勻強化。高級別膠質瘤腫瘤體積多較大,信號不均勻,增強后多以明顯不均勻強化或環狀強化為主。DTI顯示瘤體高級別膠質瘤瘤體FA值為(0.167±0.035),低級別膠質瘤瘤體FA值為(0.147±0.015),差異有統計學意義(t=2.34,P<0.05),見圖1。10只對照組大鼠MRI掃描檢查未見異常信號。
2.2病理結果 本組研究57只荷瘤大鼠中,低級別膠質瘤(WHO Ⅰ~Ⅱ級)18只,高級別膠質瘤(WHO Ⅲ~Ⅳ級)39只,其中1~2周時,腫瘤級別Ⅰ~Ⅱ級18例,Ⅲ~Ⅳ級4例,接種3~4周,腫瘤級別Ⅲ級14例,Ⅳ級21例。HE染色顯示瘤體腫瘤細胞排列密集,以高級別更加明顯,伴有不同程度出血和壞死,細胞核異形性明顯。對照組大鼠均未見腫瘤生長。
3 討 論
膠質瘤是腦內最常見的惡性腫瘤,占原發性腦腫瘤的80%[3],術前準確評估膠質瘤的惡性程度對預測腫瘤生物學行為,制定手術方案及預測轉歸、評估預后至關重要[2,5]。由于腫瘤存在不同程度的異質性,根據活檢或手術切除標本的組織學特點進行分級存在一定缺陷[6]。DTI作為一種新的功能成像方法,可以反映水分子的彌散特點,評估組織微觀結構變化,廣泛用于膠質瘤診斷、鑒別診斷、分級及手術方案的制訂[1,7]。大鼠C6腦膠質瘤接近于人腦膠質瘤的生物學特性,并且實驗結果具備良好的可重復性,為此本研究通過建立鼠腦膠質瘤模型,旨在探討臨床3.0T DTI在Wistar大鼠C6腦膠質瘤分級中的應用價值。
本組實驗結果顯示C6細胞在接種1~2周時,腫瘤級別Ⅰ~Ⅱ級18例,Ⅲ~Ⅳ級4例,接種3~4周,腫瘤級別Ⅲ級14例,Ⅳ級21例,這與已有研究結果相似[8-9],也進一步證實了鼠腦膠質瘤的病理級別與C6細胞接種后處死的時間窗有關[10]。不過李明等[11]通過將C6細胞接種到SD大鼠,并在不同時間點掃描處死大鼠后發現腫瘤的病理級別在Ⅱ~Ⅲ級,推測可能與植入的細胞種類、動物個體間差異及接種后處理時間等因素有關。
本研究通過建立不同時間段大鼠C6腦膠質瘤模型后高級別膠質瘤瘤體FA值高于低級別膠質瘤,差異有統計學意義(P<0.05),這與國內外多項研究結果相似[12-13]。不過FA值在膠質瘤分級中的作用研究結果也存在一定爭議,EL-SEROUGY等[3]在一項35例膠質瘤患者的DTI研究中發現瘤體MD值聯合瘤周組織FA值對鑒別高級別膠質瘤和低級別膠質瘤有一定幫助,而瘤體FA值在膠質瘤分級中作用有限。這可能有兩方面原因:(1)FA值受多種因素影響,比如腫瘤細胞密度、細胞外聞隙、白質纖維髓鞘完整性等;(2)目前研究多針對DTI在膠質瘤患者分級中的應用,因不同患者存在異質性,缺乏實驗的可重復性,研究結果存在爭議。不過,本組研究采用接近人腦膠質瘤的大鼠膠質瘤模型,實驗結果具備良好的可重復性,降低了個體異質性造成的實驗偏倚。
綜上所述,通過建立C6大鼠腦膠質瘤模型發現,DTI參數FA值可以為術前膠質瘤分級提供準確可靠、無創的影像學信息。不過本研究也存在一些缺陷,首先本研究樣本量較少,無法確定膠質瘤分級的具體閾值,這也是以后研究的方向。另外臨床3.0T磁共振空間分辨力不足,不能滿足大鼠白質纖維示蹤,之后本課題組將進行更高場強MRI鼠腦膠質瘤分級研究。
[1]MOHAMMADZADEH A,MOHAMMADZADEH V,KOORAKI S,et al.Pretreatment evaluation of gioma[J].Neuroimaging Clin N Am,2016,26(4):567-580.
[2]PAPAGEORGIOU T S,CHOURMOUZI D,DREVELENGAS A,et al.Diffusion tensor imaging in brain tumors:A study on gliomas and metastases[J].Phys Med,2015,31(7):767-773.
[3]EL-SEROUGY L,ABDEL R A A,EZZAT A,et al.Assessment of diffusion tensor imaging metrics in differentiating low-grade from high-grade gliomas[J].Neuroradiol J,2016,29(5):400-407.
[4]WANG W,STEWARD C E,DESMOND P M.Diffusion tensor imaging in glioblastoma multiforme and brain metastases:the role of p,q,L,and fractional anisotropy[J].AJNR Am J Neuroradiol,2009,30(1):203-208.
[5]CHOI Y S,AHN S S,LEE S K,et al.Amide proton transfer imaging to discriminate between low- and high-grade gliomas:added value to apparent diffusion coefficient and relative cerebral blood volume[J].Eur Radiol,2017,27(8):3181-3189.
[6]CHAWALPARIT O,SANGRUCHI T,WITTHIWEJ T,et al.Diagnostic performance of advanced MRI in differentiating high-grade from low-grade gliomas in a setting of routine service[J].J Med Assoc Thai,2013,96(10):1365-1373.
[7]LIANG R,WANG X,LI M,et al.Potential role of fractional anisotropy derived from diffusion tensor imaging in differentiating high-grade gliomas from low-grade gliomas:a meta-analysis[J].Int J Clin Exp Med,2014,7(10):3647-3653.
[8]陳淑玲,郭子義,鐘小航.晚期鼠腦膠質瘤模型的建立與磁共振灌注成像研究[J].重慶醫學,2014,43(25):3317-3318,3321.
[9]李香營,魏曉,劉輝,等.Wistar大鼠C6腦膠質瘤晚期階段模型的建立及MR成像[J].實用放射學雜志,2012,28(3):461-464.
[10]魏曉,李香營,袁園,等.適于腦膠質瘤浸潤MRI研究的動物模型構建[J].中國醫學計算機成像雜志,2013,19(4):390-392.
[11]李明,馮華,李飛,等.大鼠C6腦膠質瘤模型的病理特征與MRI的觀察[J].中華神經外科雜志,2005,21(5):279-282.
[12]蔣玲,姚振威,馮曉源,等.DTI定量參數對膠質瘤分級與腫瘤增殖活性的評價[J].中國醫學計算機成像雜志,2013,19(2):106-110.
[13]SERVER A,GRAFF B A,JOSEFSEN R,et al.Analysis of diffusion tensor imaging metrics for gliomas grading at 3 T[J].Eur J Radiol,2014,83(3):156-165.

