高血壓對阿爾茨海默病患者腦結構和功能影響的MRI研究
張 斌,陳 靜,李艷捧,李曉東,郎曉燕,李嬌嬌
(河北北方學院附屬第一醫院醫學影像部,河北張家口 075000)
阿爾茨海默病(alzheimer′s disease,AD)是一種以進行性認知功能障礙和行為損害為特征的中樞神經系統變性病[1]。目前為止AD確切發病機制尚未明確,缺乏早期診斷指標,因此對AD危險因素進行早期干預具有實際臨床價值。眾所周知,高血壓是血管性癡呆的獨立危險因素,然而最近的研究發現,高血壓在AD病理生理機制中發揮著重要作用,可能通過腦小血管損害而增加AD發生風險[2]。筆者查閱文獻發現,既往研究者對于高血壓對AD患者腦結構和功能影響的關注較少,因此有必要進一步探討。
1 資料與方法
1.1一般資料 選取2013年1月至2016年8月于本院認知障礙門診就診或神經內科病房住院的AD患者40例,分為高血壓組和正常血壓組,各20例。其中高血壓組男12例,女8例,年齡65~80歲,平均年齡(73.5±6.3)歲;正常血壓組男9例,女11例,年齡64~79歲,平均年齡(74.6±4.7)歲。組間年齡、性別比例、文化程度及臨床癡呆評估量表(CDR)、簡易精神狀態評價量表(MMSE)、Hachinski缺血量表、Fazekas量表評分差異均無統計學意義(P>0.05)。納入標準:(1)符合2011版美國國立神經病語言障礙卒中研究所和AD相關疾病協會 (NINCDS-ADRDA)診斷“很可能AD癡呆”的標準;(2)CDR 1分;(3)年齡大于或等于60歲,右利手;(4)未接受過癡呆治療;(5)MMSE評分(文盲為小于或等于17分,小學為小于或等于20分,初中及以上為小于或等于24分);(6)高血壓1級。排除標準:(1)不能配合MRI檢查;(2)其他類型癡呆;(3)腦器質性疾病;(4)嚴重腦外傷;(5)神經精神疾病;(6)藥物、酒精等物質依賴;(7)繼發性高血壓;(8)長期服用降壓藥物;(9)其他心血管危險因素(肥胖、吸煙、糖尿病和高血脂癥等);(10)Hachinski缺血量表評分大于4分;(11)Fazekas量表評分大于2分。
1.2方法
1.2.1研究方法 由本院神經內科同一名高年資醫師對所有受試者進行神經認知功能測評,包括CDR、MMSE、Hachinski缺血量表、Fazekas量表;均行常規實驗室檢查,項目包括血壓、空腹血糖、血脂及肝腎功能等,高血壓診斷標準為非同日3次以上血壓測量值(未服用降壓藥物):收縮壓大于或等于140 mm Hg和(或)舒張壓大于或等90 mm Hg,高血壓1級診斷標準為:收縮壓140~159 mm Hg或舒張壓90~99 mm Hg[3]。
1.2.2數據采集 實驗設備采用Phillips 3.0T磁共振成像儀,掃描序列包括常規MRI、矢狀位3DT1WI(TFE)和靜息態功能磁共振(rs-fMRI)。囑受試者處于清醒平臥,閉眼,盡量放松并保持全身靜止不動,固定頭部,同時囑其避免任何系統性的思維活動。矢狀位3DT1WI序列掃描參數:TR 7.8 ms,TE 3.5 ms,翻轉角 8°,視野240 mm×240 mm,體素大小1 mm×1 mm×1 mm,層厚1 mm,層距0。rs-fMRI序列掃描參數:TR 3 000 ms,TE 35 ms,翻轉角80°,視野240 mm×240 mm,體素大小3 mm×3 mm×3 mm,層厚3 mm,層距0.5 mm,采集180個時間點。
1.2.3數據后處理
1.2.3.1TFE數據處理 基于Matlab R2012b操作界面,在統計參數圖(SPM8)中進行數據預處理,步驟如下:(1)組織分割;(2)配準和空間標準化;(3)空間平滑。
1.2.3.2rs-fMRI數據預處理 在MATLAB R2012b平臺上使用DPARSFA圖像數據按如下步驟進行預處理:(1)圖像轉換;(2)刪除前10個時間點圖像數據;(3)時間校正;(4)頭動校正;(5)空間配準;(6)空間平滑;(7)去除線性漂移;(8)帶通濾波。
1.2.3.3低頻振幅(ALFF) ALFF是針對腦部功能活動的局部特性進行振幅分析的一種方法。使用快速傅里葉變換算法將全腦時域信號轉化到頻域得到功率譜,峰下面積與信號能量大小成正比,功率譜的平方根就是ALFF。為了減少個體差異對結果的影響,對ALFF值進行標準化得到mALFF圖。
1.2.3.4局部一致性(ReHo) ReHo描述的是某個體素與相鄰若干體素時間序列的同步性,通過計算肯德爾系數實現,每個體素的系數值組成一個局部腦圖,為了減少個體差異對結果的影響,對ReHo值進行標準化得到mReHo圖。
1.3統計學處理 采用SPSS21.0統計軟件進行分析,計量資料采用獨立樣本t檢驗,計數資料采用χ2檢驗,檢驗水準α=0.05。采用REST V1.8軟件對兩組進行獨立樣本t檢驗比較灰質體積(GMV)差異,將全腦平均GMV作為協變量,對ALFF和ReHo再進行獨立樣本t檢驗獲得全腦差異功能腦區圖,顯著性閾值均為P<0.01(AlphaSim校正,體素數>18voxels)。
2 結 果
2.1基于體系的形態學分析(VBM) 與正常血壓組比較,高血壓組患者GMV減少的腦區位于雙側背外側前額葉、后扣帶回/楔前葉、頂下小葉和眶回(P<0.05),圖中藍色代表減低,見圖1、表1。
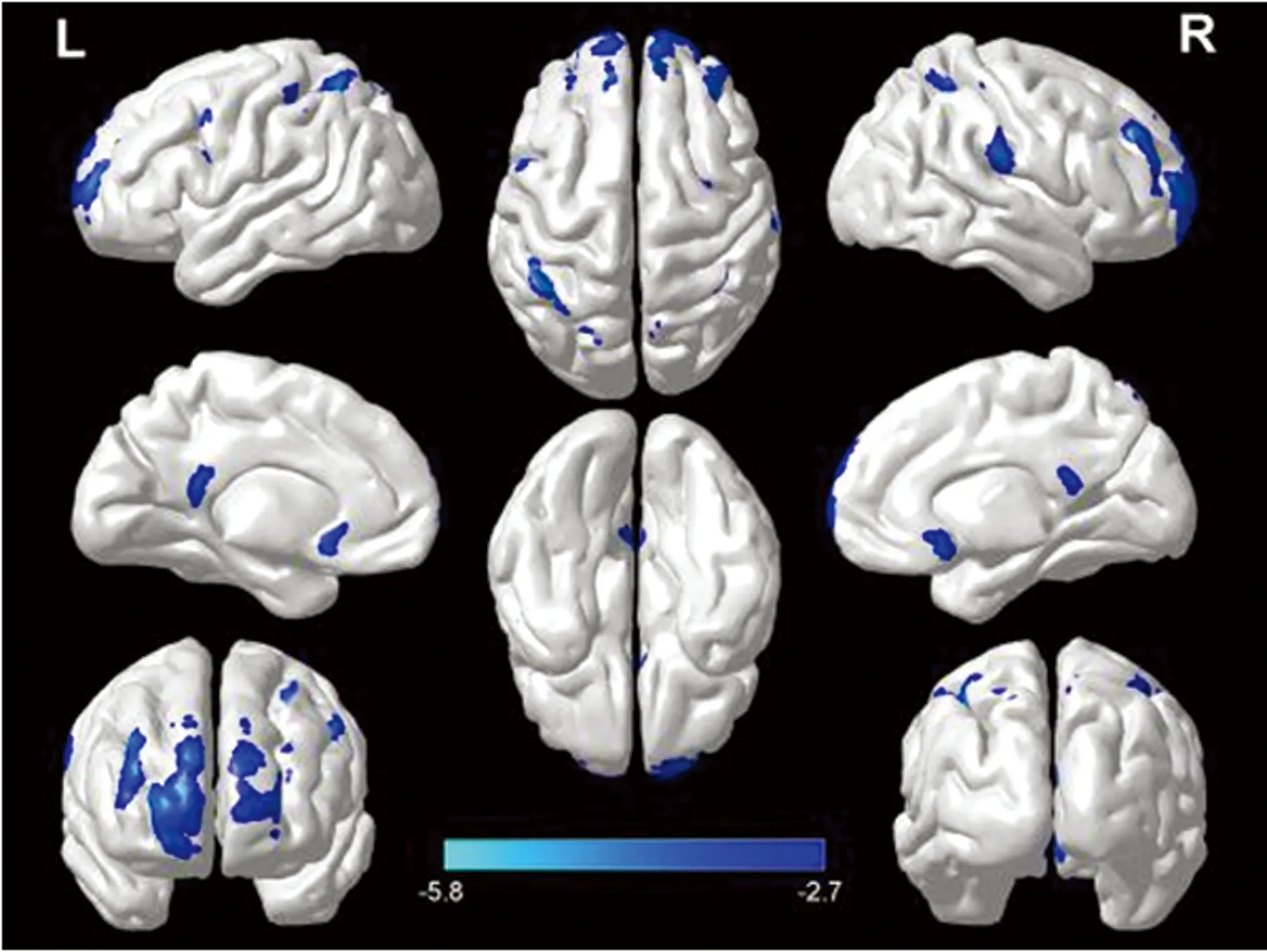
圖1 兩組患者GMV差異腦區圖
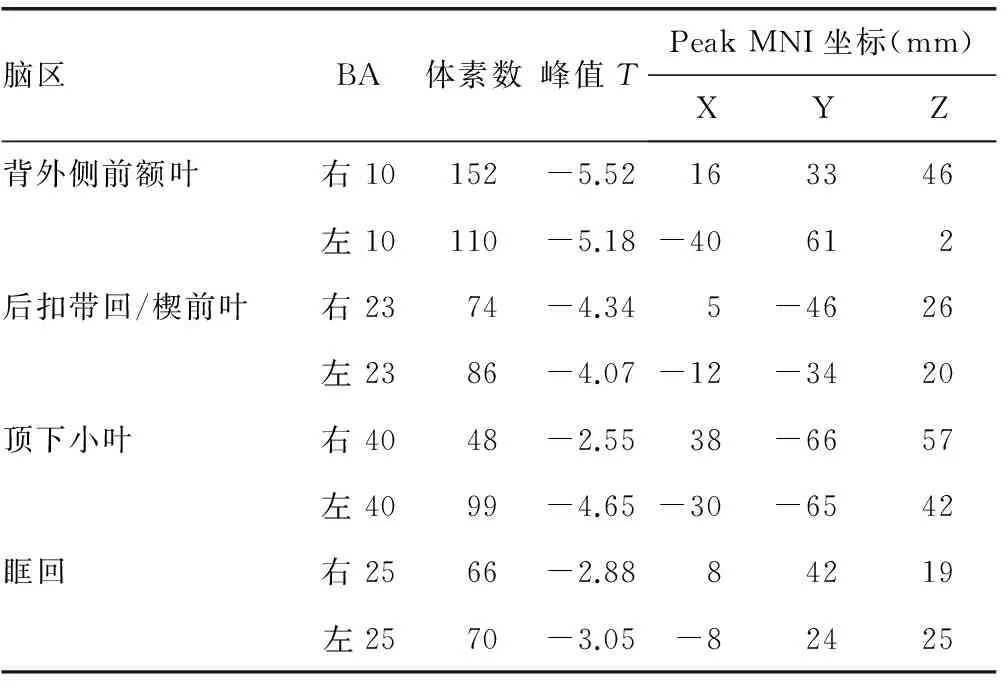
腦區BA體素數峰值TPeakMNI坐標(mm)XYZ背外側前額葉右10152-5.52163346左10110-5.18-40612后扣帶回/楔前葉右2374-4.345-4626左2386-4.07-12-3420頂下小葉右4048-2.5538-6657左4099-4.65-30-6542眶回右2566-2.8884219左2570-3.05-82425
BA:布羅德曼分區
2.2ALFF分析 與正常血壓組比較,高血壓組患者ALFF減低的腦區位于雙側背外側前額葉、后扣帶回/楔前葉、頂下小葉和右側顳上回;增高的腦區位于右側海馬、海馬旁回、島葉和雙側前扣帶回(P<0.05),圖中藍色代表減低,紅色代表增高,見圖2、表2。
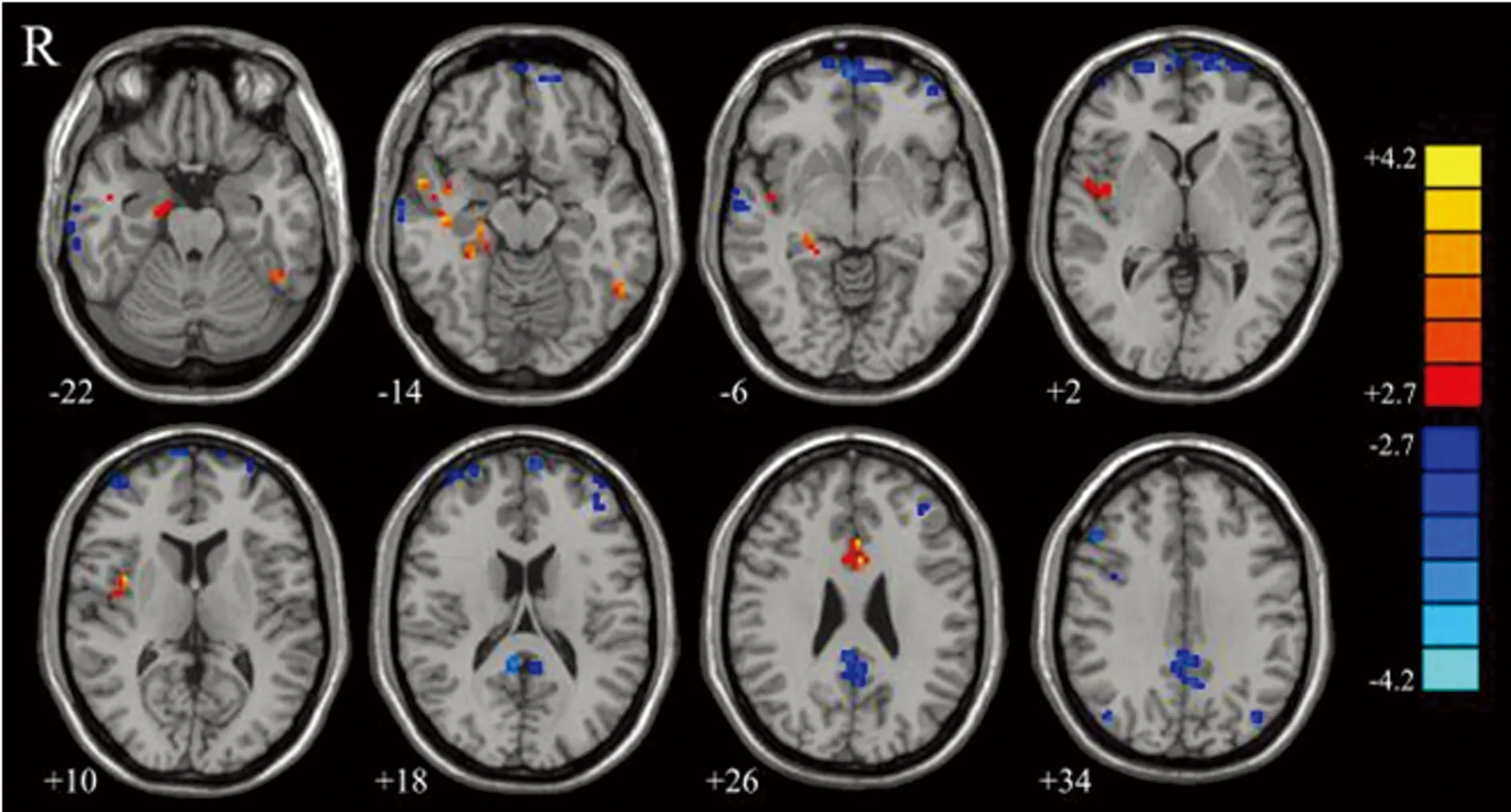
圖2 兩組患者ALFF差異腦區圖
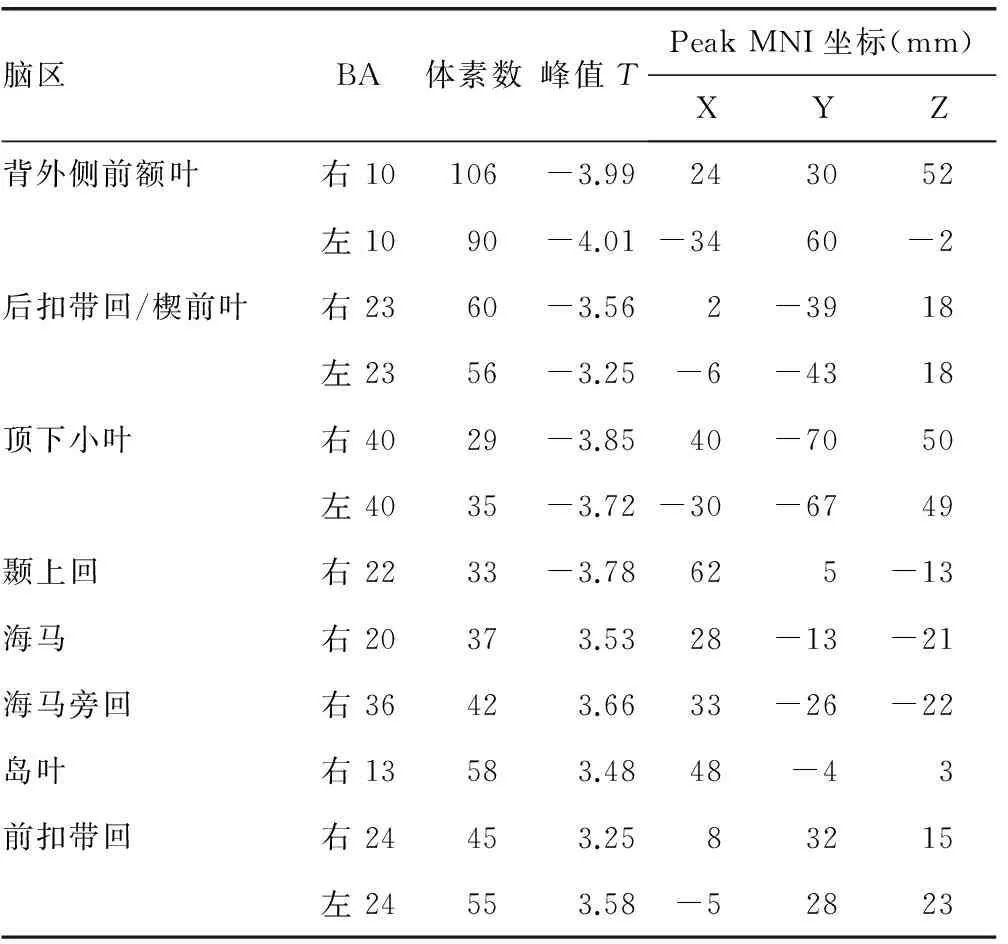
腦區BA體素數峰值TPeakMNI坐標(mm)XYZ背外側前額葉右10106-3.99243052左1090-4.01-3460-2后扣帶回/楔前葉右2360-3.562-3918左2356-3.25-6-4318頂下小葉右4029-3.8540-7050左4035-3.72-30-6749顳上回右2233-3.78625-13海馬右20373.5328-13-21海馬旁回右36423.6633-26-22島葉右13583.4848-43前扣帶回右24453.2583215左24553.58-52823
BA:布羅德曼分區
2.3ReHo分析 與正常血壓組比較,高血壓組患者ReHo減低的腦區位于左側背外側前額葉、內側前額葉、頂下小葉、雙側后扣帶回/楔前葉和右側島葉;增高的腦區位于左側顳上回、右側海馬、雙側海馬旁回和前扣帶回(P<0.05),圖中藍色代表減低,紅色代表增高,見圖3、表3。
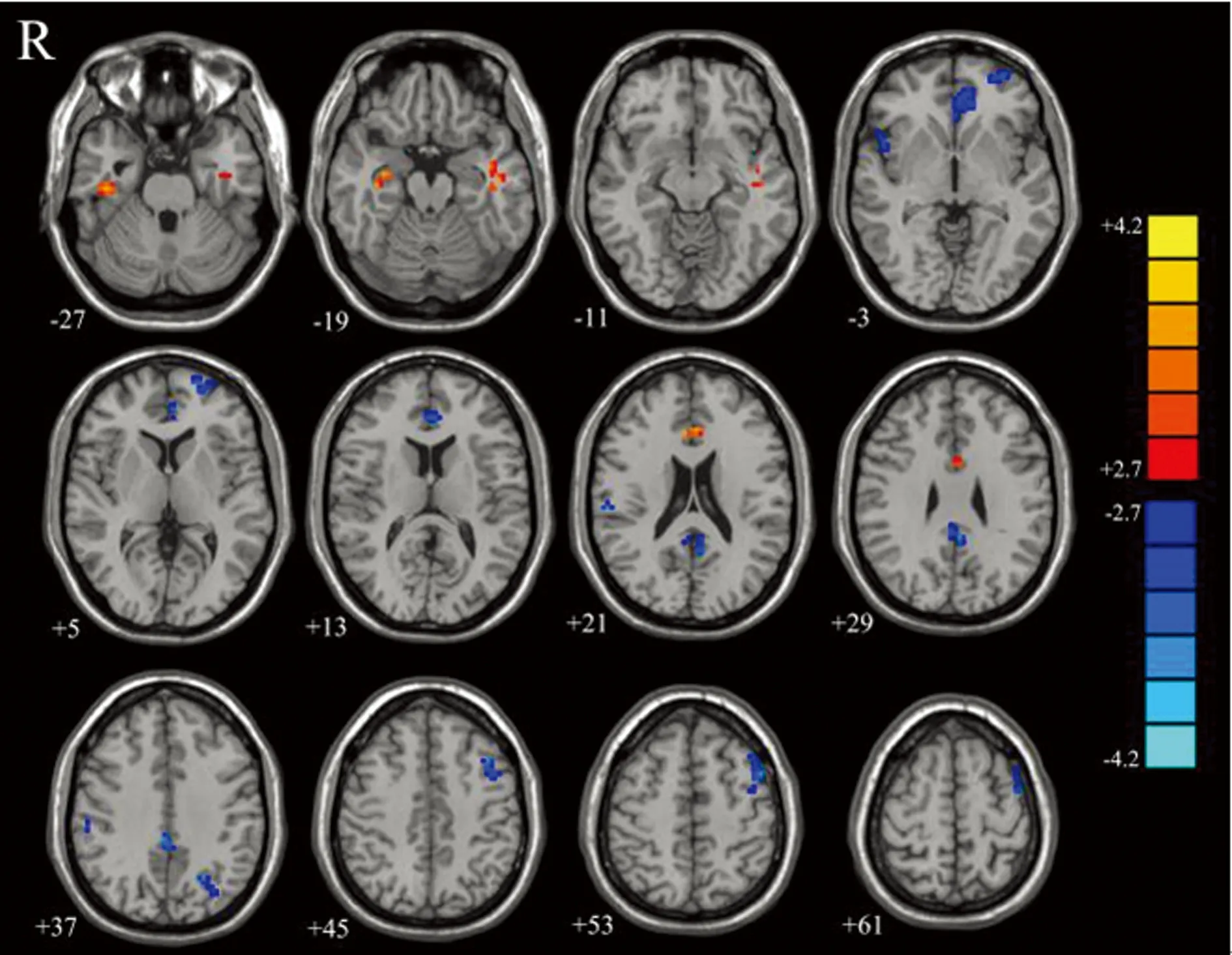
圖3 兩組患者ReHo差異腦區圖
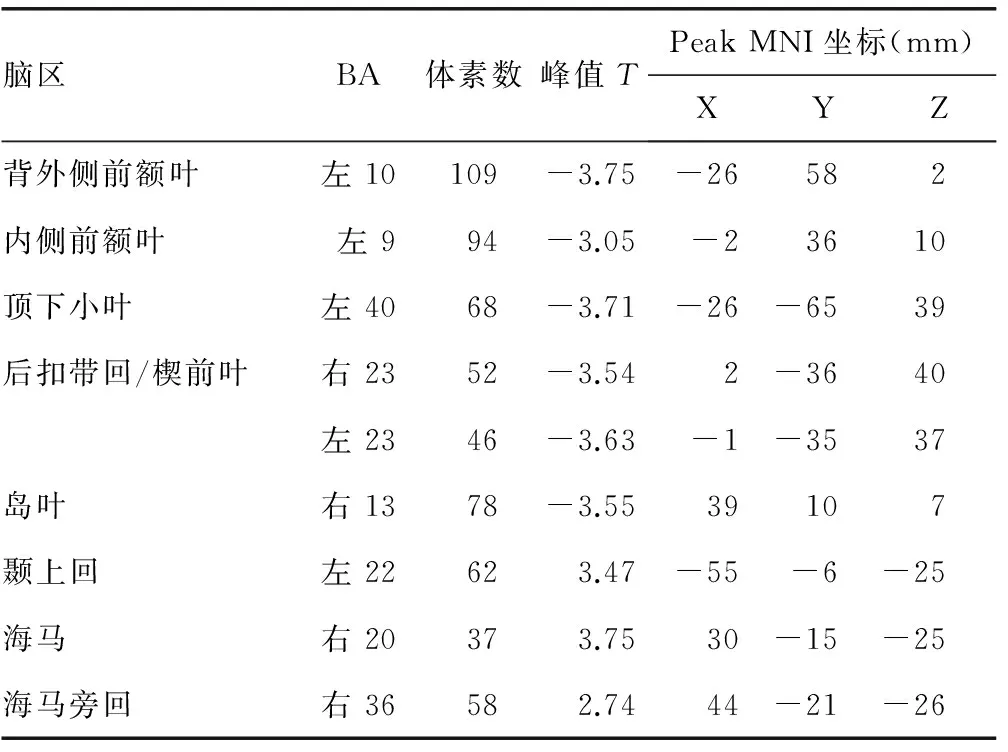
腦區BA體素數峰值TPeakMNI坐標(mm)XYZ背外側前額葉左10109-3.75-26582內側前額葉左994-3.05-23610頂下小葉左4068-3.71-26-6539后扣帶回/楔前葉右2352-3.542-3640左2346-3.63-1-3537島葉右1378-3.5539107顳上回左22623.47-55-6-25海馬右20373.7530-15-25海馬旁回右36582.7444-21-26
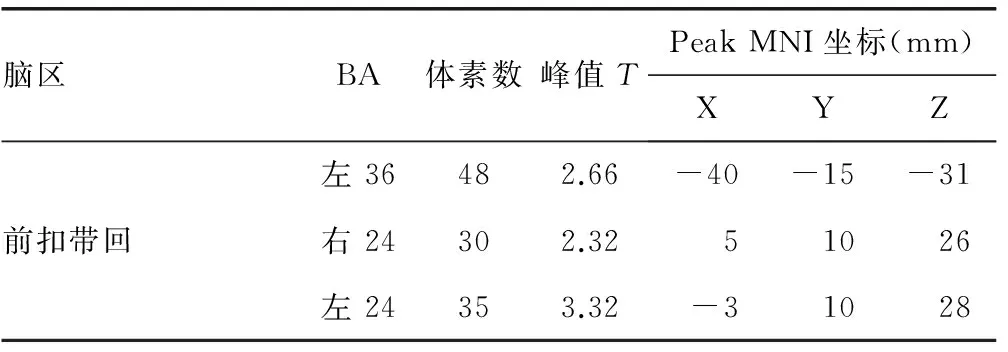
續表3 兩組ReHo顯著差異腦區
BA:布羅德曼分區
3 討 論
3.1高血壓對AD患者腦結構的影響 高血壓是老年人常見的心血管疾病,同時也是AD重要的危險因素之一[4-5]。研究發現,高血壓可以引起大腦結構退變,加速老年人記憶力及其他認知能力喪失[6]。SON等[7]采用VBM方法進行全腦定量研究,結果顯示合并高血壓的AD患者多個腦區存在顯著腦萎縮,異常腦區包括后扣帶回/楔前葉、前扣帶回、左側額下回、右側顳極和左側顳中回。然而LOBANOVA等[8]選取海馬、全腦、腦室、顳中回、梭狀回和內嗅皮質作為感興趣區,通過2年隨訪研究,發現高血壓組的AD患者較正常血壓組上述腦區體積均未出現顯著結構改變。本組資料顯示,較正常血壓組,高血壓組AD患者在雙側背外側前額葉、后扣帶回/楔前葉、頂下小葉和眶回GMV顯著減小。本研究與既往研究存在差異的原因可能是多方面的:(1)樣本量差異,本研究樣本量較小,這可能對結果的統計準確性造成一定影響;(2)人類學資料差異,既往研究多在白種人中進行,而本研究對象均為黃種人,遺傳背景的人種差異性可能會影響結果;(3)數據采集的成像參數設定和測量方法差異也會對結果產生一定程度的影響,同時本研究采用REST軟件進行VBM分析,多種軟件及其背后涉及的具體算法和統計模塊存在差異。
3.2高血壓對AD患者腦功能的影響 關于AD的rs-fMRI研究大多數主要運用功能連接方法,即不同腦區間的時間相關性,此種方法只能反映多個腦區間的功能協調性,而不能得出異常網絡里確切位點,因此本研究采用rs-fMRI局部功能指標ALFF和ReHo進行分析,其不依賴模型產生的誤差影響,能夠直接提示神經元存在自發活動,在監測局部腦功能方面具有一定的可靠性、實用性和靈敏性[9]。其中ALFF從能量角度反映各體素在靜息狀態下自發活動水平的高低[10]。ReHo則用于評價局部腦區神經元活動在時間上的同步性與協調性[11]。
本組高血壓AD患者ALFF和ReHo值在廣泛腦區存在顯著性差異,同時具有一定程度的重疊。其中減低的腦區主要位于背外側前額葉、后扣帶回/楔前葉和頂下小葉。背外側前額葉在工作記憶、情景記憶和語義記憶等記憶系統中起到重要作用[12]。既往影像學研究揭示合并高血壓的AD患者在進行記憶任務時,額葉激活程度較非高血壓人群明顯減弱[13]。筆者推測背外側前額葉可能是高血壓AD腦認知損害作用位點之一。后扣帶回/楔前葉作為學習記憶環路的關鍵神經解剖學標志,與灌注異常密切相關,且在全腦靜息態下代謝率最旺盛,其功能涉及周圍環境監控、情景記憶提取和自我內省等高級思維活動[14]。本研究中后扣帶回/楔前葉ALFF和ReHo值減低提示該腦區神經元功能活動的興奮性降低和同步性失調。頂下小葉參與感覺信息整合、邏輯思考推理和加工處理,在人體高級認知行為中具有重要作用[15]。本研究中頂下小葉ALFF和ReHo值減低可能是高血壓AD患者腦損害的敏感性指標之一。本研究發現,高血壓AD患者ALFF和ReHo減低的腦區與默認網絡(DMN)相關腦區具有高度一致性,DMN是靜息狀態腦功能中最重要的成分,相關腦區主要包括內側前額葉、后扣帶回/楔前葉和頂下小葉[16],DMN參與情景記憶提取和分類,筆者推測高血壓可能通過影響DMN功能連接強度進而損害AD患者腦功能活動和認知功能。此外,本研究中回歸掉GMV后,上述腦區功能指標仍具有差異,說明高血壓對AD患者腦損害不能完全用GMV減少來解釋,相對而論,高血壓可以引起AD更嚴重的功能損害。
本研究還發現海馬、海馬旁回和前扣帶回ALFF和ReHo值均顯著增高。海馬、海馬旁回和前扣帶回屬于邊緣系統的范疇,主要參與記憶提取、編碼,在情景記憶特別是自身相關事件中處于高激活狀態[17]。筆者認為這些腦區激活機制可能是由于高血壓引發AD患者腦動脈管壁硬化和斑塊形成,管腔狹窄致腦血流量和能量供應不足,進而血流調節失衡引起腦組織神經元、突觸損害和功能紊亂,為了保持整體水平神經元結構和功能的完整性,局部腦區形成的一種功能代償機制。 本研究中高血壓AD患者功能腦區損傷和代償共存是否可以作為診斷和監測合并高血壓的AD患者特征性影像標記物仍需要通過擴大樣本量和隨訪研究來證實。
本研究的局限性包括:(1)樣本量相對較少,部分結果可能存在偏倚;(2)缺乏完整的橫斷面研究,未按照高血壓嚴重程度進行分組。因此,有待今后大樣本、更精細、匹配的分組研究進一步證實。
綜上所述,本研究基于多模態MRI指標發現高血壓對AD患者腦結構和功能具有一定程度的影響,主要表現為背外側前額葉、后扣帶回/楔前葉和頂下小葉腦質萎縮和自發神經元活動異常。AD危險因素種類多樣,高血壓屬于可控因素之一,AD患者可以通過合理健康飲食、適當鍛煉及服用降壓藥物來維持正常血壓水平,改善認知功能,提高生活質量。
[1]BALACHANDAR R,JOHN J P,SAINI J,et al.A study of structural and functional connectivity in early Alzheimer′s disease using rest fMRI and diffusion tensor imaging[J].Int J Geriatr Psychiatry,2015,30(5):497-504.
[2]王文瀟,張占軍,李馨,等.高血壓在腦認知功能障礙中的作用研究進展[J].中華神經外科疾病研究雜志,2016,15(2):187-189.
[3]QIAO J,LU W H,WANG J,et al.Vascular risk factors aggravate the progression of Alzheimer′s disease:a 3-year follow-up study of chinese population[J].Am J Alzheimers Dis Other Demen,2014,29(6):521-525.
[4]THORIN E.Hypertension and Alzheimer disease[J].Hypertension,2014,65(1):36-38.
[5]DE BRUIJN R F,IKRAM M A.Cardiovascular risk factors and future risk of Alzheimer′s disease[J].BMC Med,2014,12:130.
[6]BLOM K,VAARTJES I,PETERS S A,et al.The influence of vascular risk factors on cognitive decline in patients with Alzheimer′s Disease[J].Maturitas,2014,79(1):96-99.
[7]SON S J,KIM J,LEE E,et al.Effect of hypertension on the resting-state functional connectivity in patients with Alzheimer′s disease (AD)[J].Arch Gerontol Geriatr,2015,60(1):210-216.
[8]LOBANOVA I,QURESHI A I.The association between cardiovascular risk factors and progressive hippocampus volume loss in persons with Alzheimer′s disease[J].J Vasc Interv Neurol,2014,7(5):52-55.
[9]LIU X,WANG S,ZHANG X,et al.Abnormal amplitude of low-frequency fluctuations of intrinsic brain activity in Alzheimer′s disease[J].J Alzheimers Dis,2014,40(2):387-397.
[10]LIANG P,XIANG J,LIANG H,et al.Altered amplitude of low-frequency fluctuations in early and late mild cognitive impairment and Alzheimer′s disease[J].Curr Alzheimer Res,2014,11(4):389-398.
[11]LIU Y,WANG K,YU C,et al.Regional homogeneity,functional connectivity and imaging markers of Alzheimer′s disease:a review of resting-state fMRI studies[J].Neuropsychologia,2008,46(6):1648-1656.
[12]NORTON S,MATTHEWS F E,BARNES D E,et al.Potential for primary prevention of Alzheimer′s disease:an analysis of population-based data[J].Lancet Neurol,2014,13(8):788-794.
[13]HAIGHT T J,BRYAN R N,ERUS G,et al.Vascular risk factors,cerebrovascular reactivity,and the default-mode brain network[J].Neuroimage,2015,115:7-16.
[14]馬曄,陳自謙,馬建芳,等.阿爾茨海默病患者后扣帶回磁共振波譜研究[J].中華保健醫學雜志,2016,18(1):21-23.
[15]WANG Y,ZHAO X,XU S,et al.Using regional homogeneity to reveal altered spontaneous activity in patients with mild cognitive impairment[J].Biomed Res Int,2015,2015:1-8.
[16]JOVICICH J,MINATI L,MARIZZONI M,et al.Longitudinal reproducibility of default-mode network connectivity in healthy elderly participants:a multicentric resting-state fMRI study[J].NeuroImage,2016,124:442-454.
[17]DIPASQUALE O,GRIFFANTI L,CLERICI M,et al.High-dimensional ICA analysis detects within-network functional connectivity damage of default-mode and sensory-motor networks in Alzheimer′s disease[J].Front Hum Neurosci,2015(9):43.

