ASC與Caspase-1在PBC患者外周血中的表達研究*
樊 佳,趙二川,葉震璇,李紅梅,任智晶,張 華△
(1.貴州醫科大學臨檢教研室,貴陽 550004;2.貴州省人民醫院檢驗科,貴陽 550002)
原發性膽汁性肝硬化(PBC)是一種漸進性發展的慢性自身免疫性肝臟疾病,以肝臟匯管區淋巴細胞浸潤、膽管上皮細胞特異性損傷及血清中出現高滴度抗線粒體抗體為特征,其病因及發病機制目前尚不完全清楚,可能與遺傳易感性及環境等因素有關[1-2]。熊去氧膽酸是目前公認唯一治療PBC有效的藥物,但約1/3的患者治療效果欠佳,最終均需要肝臟移植[3]。近年來PBC的患病率和發病率不斷增高[4-5],因此開展PBC治療相關的創新研究,對于提高PBC治療效果和減輕疾病負擔具有重要的現實意義。Caspase-1屬于Caspase家族成員,在調控炎性反應和細胞凋亡等方面起重要作用[6]。Caspase家族是一類能特異性水解半胱氨酸天冬氨酸的蛋白酶,在多種疾病的組織及血清中均有不同程度的表達。正常情況下Caspase-1是以無催化活性的pro-Caspase-1形式存在,而pro-Caspase-1的活化則依賴于ASC的招募。ASC是MASUMOTO等1999年于日本衰老研究中心發現的一種蛋白,它因在細胞凋亡時能在細胞質中聚集成中空的斑塊而得名[7],近年的研究表明其在炎癥、免疫調節和腫瘤等方面廣泛發揮作用[8]。當存在ASC抗體時,炎癥小體活化Caspase-1的作用可被阻斷,表明ASC是活化Caspase-1的關鍵因子。表觀遺傳學是近來在自身免疫性疾病方面研究的熱門領域,而DNA甲基化則是其最重要的遺傳修飾形式之一,在免疫紊亂、腫瘤發生等方面發揮重要作用。基因啟動子區甲基化的改變可影響相關細胞因子等的表達,使T細胞的分化及反應性發生相應改變,從而參與免疫性疾病的發病[9-10]。ASC基因5′端富含CpG島,其啟動子區異常甲基化與一些自身免疫性疾病或腫瘤的發生、發展相關[11-12],這可能也與PBC的發生存在聯系。而目前Caspase-1、ASC及ASC基因甲基化等研究在PBC中尚未見報道。本研究旨在通過檢測PBC患者外周血單個核細胞(PBMC)中Caspase-1與ASC 的mRNA和蛋白表達情況,以及ASC啟動子區甲基化狀況和血漿中Caspase-1和白細胞介素(IL)-18的表達水平,探討Caspase-1和ASC介導的免疫炎性反應在PBC發生過程中的作用。
1 資料與方法
1.1一般資料 選取2015年6月至2016年10月就診于貴州省人民醫院的PBC患者30例為病例組,其中男3例,女27例,平均年齡(64.08±12.11)歲;對照組為健康志愿者30例,其中男4例,女26例,平均年齡(63.39±10.59)歲。兩組間年齡與性別分布差異無統計學意義(P>0.05)。所有患者均知情同意且經倫理委員會審查通過(2017109)。納入標準:參照2009年美國肝病學會(AASLD)推薦的診斷標準[13]。排除標準:(1)病毒、乙醇、藥物、膽道梗阻等原因或其他系統疾病引起的肝臟病變;(2)合并其他自身免疫性疾病。
1.2材料和試劑 反轉錄試劑盒及SYBR Green Ⅱ試劑盒購自大連TaKaRa公司;EpiTect Fast DNA Bisulfite Kit (50)及PyroMark PCR kit(200)購自德國凱杰生物公司;Human IL-18 ELISA kit(96T)及Human Caspase-1 ELISA kit(96T)購自R&D武漢博士德公司;Anti-Caspase-1抗體及Anti-TMS1抗體購自美國Abcam生物有限公司;PCR引物由上海生工生物工程有限公司合成。
1.3方法
1.3.1PBMC的富集及DNA/RNA/蛋白的提取 取3 mL EDTA-K2抗凝全血,3 500 rpm/min離心10 min,收集血漿分裝為每管400 μL備用,剩余的血細胞采用Ficoll法分離出PBMC;采用DNA/RNA/蛋白共提取試劑盒嚴格按照試劑說明書操作提取PBMC中的RNA、DNA和蛋白質,并用微量核酸定量儀檢測RNA和DNA濃度和純度。
1.3.2實時熒光定量PCR檢測Caspase-1和ASC mRNA的相對表達量 取1 μg RNA逆轉錄為cDNA,后進行實時熒光定量PCR擴增。根據GeneBank設計引物,序列如下:Caspase-1(103 bp)上游引物5′- AGA CAA GGG TGC TGA ACA A-3′,下游引物5′- CCT TTC GGA ATA ACG GAG T -3′;ASC(185 bp)上游引物5′- GAC GCC TTG GAC CTC ACC GA -3′,下游引物5′- TTG GCT GCC GAC TGA GGA GG -3′。以GAPDH作為內參引物。擴增條件:95 ℃ 30 s,1個循環;95 ℃ 5 s,60 ℃ 34 s,40個循環。
1.3.3Western blot檢測Caspase-1和ASC蛋白的相對表達量 采用BCA蛋白定量試劑盒檢測蛋白濃度;以β-actin為內參,經蛋白凝膠電泳、轉膜、封閉、孵育抗體、曝光后采集圖像并分析。
1.3.4焦磷酸測序檢測ASC啟動子區甲基化狀態 利用在線軟件Methprimer查找ASC啟動子區甲基化島,用PyroMark Assay Design 2.0軟件預測其甲基化位點并進行引物設計,其中Island 1(IS1)含有6個CpG位點,Island 2(IS2)含有9個CpG位點,見圖1、2。根據焦磷酸測序儀判斷標準,甲基化率為0%~<5%時為檢測背景值,即該位點未發生甲基化,而甲基化率大于或等于5%時,才認為該位點甲基化。根據測序需要在上游或下游引物的3′端加生物素標記,IS1-1表示Island 1中第1個CpG位點,IS1-2/6表示針對Island 1中第2~6個CpG位點,以此類推,F、R、S分別表示上游引物、下游引物和測序引物,見表1。基因組DNA經亞硫酸鹽處理過夜后,采用PCR進行啟動子區甲基化位點擴增,擴增條件:95 ℃ 15 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,45個循環;72 ℃,10 min;4 ℃保存。最后嚴格按照焦磷酸測序操作手冊進行焦磷酸測序。
1.3.5ELISA檢測血漿Caspase-1和IL-18水平 嚴格按照Caspase-1和IL-18 ELISA試劑盒說明書進行檢測,酶標儀450 nm/630 nm波長測定光密度(OD)值,根據OD值換算出相應濃度。
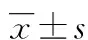

表1 ASC 啟動子區域 CpG 位點的引物

圖1利用在線軟件Methprimer預測ASC啟動子區甲基化島

A:預測IS1的CpG位點;B:預測IS2的CpG位點;黃底黑字部分為模擬亞硫酸亞處理后的序列,其中黑體加粗位點為預測的CpG位點
圖2 PyroMark Assay Design 2.0軟件預測ASC啟動子區域CpG位點
2 結 果
2.1Caspase-1和ASC mRNA表達情況 PBC組患者PBMC中Caspase-1、ASC mRNA表達分別為對照組的2.502、2.440倍,差異有統計學意義(P<0.05),見圖3。

圖3 兩組Caspase-1和ASC mRNA的相對表達情況
2.2Caspase-1和ASC蛋白表達情況 PBC組患者PBMC中Caspase-1和ASC蛋白表達均高于對照組,差異有統計學意義(P<0.05),見圖4。
2.3焦磷酸測序檢測兩組ASC啟動子區甲基化情況 PBC組IS1中1~6位點的甲基化率均低于對照組,差異有統計學意義(P<0.05),見表2。IS1-1位點測序結果見圖5,圖中紅框中堿基為焦磷酸測序質量控制位點,背景淡紅(黃)色,無峰值,代表亞硫酸鹽處理完全,測序結果可靠。兩組IS2中9個位點各自的甲基化率均值不超過5%,見表3。

圖4 兩組Caspase-1、ASC蛋白表達情況
2.4血漿中Caspase-1和IL-18水平 PBC組患者血漿中Caspase-1和IL-18水平均明顯高于對照組,差異有統計學意義(P<0.05),見表4。
2.5相關性分析 血漿中Caspase-1與IL-18表達呈正相關(r=0.716,P<0.01);ASC mRNA與Caspase-1 mRNA表達呈正相關(r=0.472,P<0.05);IS1-1、 IS1-2、IS1-4及IS1-5位點甲基化率與ASC mRNA表達均呈負相關(r=-0.74、-0.591、-0.534、-0.503,P<0.05),IS1-3及IS1-6位點無顯著相關性(r=-0.372、-0.265,P>0.05)。

表2 ASC啟動子區域IS1各位點甲基化率

表3 ASC啟動子區域IS2各位點甲基化率

圖5 IS1-1位點測序結果

組別nCaspase-1IL-18PBC組30280.02±213.76394.11±137.51對照組3061.19±48.60205.79±50.33
3 討 論
Caspase-1又稱IL-1β轉換酶(Interleukin-1beta converting enzyme,ICE),可將IL-1β前體蛋白轉化為成熟的活化成分[14]。IL-18作為IL-1家族成員,可與CD4+T細胞表面的IL-18Rα結合并激活其核因子-κB(NF-κB)信號通路促進PBC患者CD4+T細胞增殖,進而產生大量炎癥因子,最終引起PBC的發生[15]。Caspase-1作為IL-18的上游調節因子,能夠將IL-18的前體轉化為具有生物學活性的成熟IL-18,這一過程與多種炎癥性疾病和自身免疫性疾病的發生、發展有關,并可通過對其的抑制產生積極治療效果[16-17]。通常Caspase-1以無活性前體形式存在,當細胞受到各種胞內外危險信號刺激時,在胞內會裝配形成炎性體并招募pro-caspase-1,隨后活化為有活性的Caspase-1。而ASC可通過對pro-caspase-1的募集并促進酶活性形式生成的方式調控Caspase-1的活化過程,這一機制在系統性紅斑狼瘡(SLE)及類風濕關節炎(RA)的發病過程中的作用已經得到證實[18]。ASC的表達情況則可在表觀遺傳學層面通過編碼基因啟動子區甲基化水平進行調節。盡管ASC啟動子區甲基化情況、Caspase-1、ASC及IL-18等在多種自身免疫病或腫瘤中均有研究并取得有益成果,但均未在PBC領域涉及。
本研究結果顯示,PBC組PBMC中Caspase-1蛋白、mRNA和血漿中Caspase-1及IL-18的表達水平均明顯高于對照組,且血漿中Caspase-1與IL-18表達呈正相關。已有研究證實IL-18與PBC的發病有關,結合本試驗結果可以推測Caspase-1與PBC的發病密切相關,這與SLE、銀屑病及MS等多個自身免疫性疾病中的研究結果一致[19-21]。本研究還顯示,病例組ASC蛋白、mRNA的表達均明顯高于對照組,且ASC mRNA與Caspase-1 mRNA的表達呈正相關。因此可認為在PBC患者中由于ASC mRNA增加使蛋白表達量增多,從而導致有活性的Caspase-1分泌增多,提示ASC可通過調節Caspase-1相關炎性通路參與PBC的免疫炎性反應。
進一步對ASC的研究中發現,ASC啟動子區域有2個甲基化島。通過焦磷酸測序顯示PBC組中IS1各位點甲基化水平低于對照組,這與ASC mRNA的高表達結果相符。由于特定的CpG位點是CpG島中決定基因表達與沉默的關鍵,因此檢測具體位點甲基化水平對于判斷整個CpG島的甲基化情況具有重要意義。IS2各位點未見明顯甲基化情況,而IS1的第1、2、4及5位點的甲基化水平與ASC mRNA的表達呈顯著負相關;第3和第6位點甲基化率無明顯相關性。因此可以認為,ASC通過其啟動子區甲基化水平的改變影響表達水平,進而導致下游Caspase-1及IL-18的表達上調,促進了PBC的發生、發展。故而可以設想,是否可以通過誘導ASC啟動子區CpG島過甲基化以降低該基因的表達從而最終影響PBC的發病,而在誘導ASC啟動子區CpG島過甲基化過程中IS1-1、IS1-2、IS1-4、IS1-5等4個位點可能更有價值。
綜上所述,PBC患者存在ASC甲基化率降低,Caspase-1和ASC mRNA及蛋白的表達上調,血漿中IL-18水平升高等一系列改變,表明ASC和Caspase-1參與 PBC的免疫炎性反應,而該通路受到ASC啟動子區甲基化的調節。提示通過干預Caspase-1的表達可能成為有效治療PBC的新靶點。本研究在表觀遺傳學方面為自身免疫病研究提供了新的視角,同時為拓展PBC的免疫治療方案提供了新思路,但還需更多的基礎和臨床研究將成果轉化為真正的治療方法。
[1]SELMI C,GERSHWIN M E.The etiology mystery in primary biliary cirrhosis[J].Dig Dis,2010,28(1):105-115.
[2]KIM K A,JEONG S H.The diagnosis and treatment of primary biliary cirrhosis[J].Korean J Hepatol,2011,17(3):173-179.
[3]CAREY E J,ALI A H,LINDOR K D.Primary biliary cirrhosis[J].Lancet,2015,386(1003):1565-1575.
[4]BOONSTRA K,KUNST A E,STADHOUDERS P H,et al.Rising incidence and prevalence of primary biliary cirrhosis:a large population-based study[J].Liver Int,2014,34(6):e31-38.
[5]CHEUNG K S,SETO W K,FUNG J,et al.Epidemiology and natural history of primary biliary cholangitis in the Chinese:a Territory-Based study in Hong Kong between 2000 and 2015[J].Clin Transl Gastroenterol,2017,8(8):e116.
[6]WEN H T,MIAO E A,TING J P.Mechanisms of NOD-like receptor-associated inflammasome activation[J].Immunity,2013,39(3):432-441.
[7]MASUMOTO J,TANIGUCHI S,AYUKAWA K,et al.ASC,a novel 22-kDa protein,aggregates during apoptosis of human promyelocytic leukemia HL-60 cells[J].J Biol Chem,1999,274(48):33835-33838.
[8]VIRMANI A,RATHI A,SUGIO K,et al.Aberrant methylation of TMS1 in small cell,non small cell lung cancer and breast cancer[J].Int J Cancer,2003,106(2):198-204.
[9]RIVERA R M,BENNETT L B.Epigenetics in humans:an overview[J].Curr Opin Endocrinol Diabetes Obes,2010,17(6):493-499.
[10]肖嶸,廉曉日,胡新紅,等.系統性硬化病患者外周血CD4+T細胞CD40L DNA甲基化研究[J].中華皮膚科雜志,2012,45(7):517-519.
[11]丁澍,龍海,陸前進.系統性紅斑狼瘡microRNA的異常表達及其與DNA甲基化的相互調控[J].國際皮膚性病學雜志,2012,38(4):231-234.
[12]GRAU E,MARTINEZ F,ORELLANA C,et al.Hypermethylation of apoptotic genes as Independent prognostic factor in neuroblastoma disease[J].Mol Carcinog,2011,50(3):153-162.
[13]LIVER E T.EASL clinical practice guidelines:management of cholestatic liver diseases[J].J Hepatol,2009,51(2):237-267.
[14]DINARELLO C A.Immunological and inflammatory functions of the interleukin-1 family[J].Annu Rev Immunol,2009,27(27):519-550.
[15]趙二川,李紅梅,任智晶,等.CD4+T細胞中IL-18激活的NF-κB信號通路與PBC發病機制的相關性研究[J].重慶醫學,2017,46(14):1892-1896.
[16]DINARELLO C A.Interleukin 1 and interleukin 18 as mediators of inflammation and the aging process[J].Am J Clin Nutr,2006,83(2):447S-455S.
[17]MEZZASOMA L,ANTOGNELLI C,TALESA V N.A novel role for brain natriuretic peptide:inhibition of IL-1β secretion via downregulation of NF-kB/Erk 1/2 and NALP3/ASC/caspase-1 activation in human THP-1 monocyte[J].Mediators Inflamm,2017(12):5858315.
[18]于成成.NLRP3、NLRP1炎性體信號通路在系統性紅斑狼瘡、炎風濕關節炎免疫機制中的作用[D].濟南:山東大學,2013.
[19]KAHLENBERG J M,THACKER S G,BERTHIER C C,et al.Inflammasome activation of IL-18 results in endothelial progenitor cell dysfunction in systemic lupus erythematosus[J].J Immunol,2011,187(11):6143-6156.
[20]AL-SHAMSI M,SHAHIN A,IBRAHIM M F,et al.Bioenergetics of the spinal cord in experimental autoimmune encephalitis of rats[J].BMC Neurosci,2015,16(1):37.
[21]于昕鑫,王秀敏,冉德林.尋常性銀屑病患者血清半胱天冬酶-1及IL-37,IL-18水平的檢測[J].中國皮膚性病學雜志,2015(6):562-564.

