過表達C3G對高糖誘導H9C2心肌細胞增殖和凋亡的影響*
張 旭,陳旺盛,張夢嬌,聶 嬌,陳 秀△
(西南醫(yī)科大學附屬醫(yī)院:1.老年病科;2.胃腸外科,四川瀘州 646000)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是指由于持續(xù)高血糖水平所致心臟微血管病變、心肌代謝紊亂及心肌細胞纖維化等病變,導致的心肌結構發(fā)生廣泛改變,最終引起左心室肥厚、心臟泵血功能障礙的一種疾病狀態(tài)[1-3]。多項研究提示,在糖尿病動物模型和糖尿病患者中均存在心肌細胞凋亡增加、生存力降低[4-5],但其機制目前仍報道甚少。鳥苷酸交換因子C3G參與多種細胞在不同病理條件下的增殖分化與凋亡[6-7],筆者前期研究發(fā)現C3G在心肌缺血、缺氧損傷模型中對心肌細胞具有保護作用[8],但其對高糖誘導環(huán)境下心肌細胞的作用目前暫無報道。本研究探討過表達C3G對高糖誘導下H9C2心肌細胞的增殖率、凋亡率的影響,以期為DCM的防治尋找新的思路。
1 材料與方法
1.1實驗材料 大鼠H9C2心肌細胞株購自中科院上海生命科學研究院;DMEM培養(yǎng)基、D-葡萄糖、胎牛血清(FBS) 購自美國 Gibco 公司;pCXN2-Flag、pCXN2-Flag-hC3G質粒由重慶醫(yī)科大學附屬第一醫(yī)院婦產科令狐華教授惠贈;質粒提取試劑盒購自美國Omega Bio-Tek公司;轉染試劑脂質體LTX 和Plus購自美國Invitrogen公司;小鼠抗大鼠β-actin抗體 (sc-47778)、兔抗大鼠及人C3G抗體 (sc-15359) 購自美國Santa Cruz公司;細胞凋亡試劑盒 (Annexin V-FITC、PI) 購自江蘇碧云天生物研究所;四甲基偶氮唑鹽(MTT)購自美國Sigma公司。
1.2方法
1.2.1實驗方法及分組 H9C2心肌細胞在含10% FBS的低糖(5 mmol/L) DMEM 培養(yǎng)基中培養(yǎng),將處于對數生長期的細胞分別接種于6個直徑10 cm培養(yǎng)皿中,細胞密度達60%左右時分別用空白試劑、空質粒、人過表達C3G質粒瞬時轉染H9C2心肌細胞,將細胞標記為空白組、空載體組、過表達C3G組3組,每組2份,培養(yǎng)9 h后重新消化細胞、細胞計數,從以上3組中分別取相同細胞,接種于6個平板中(Western blot用培養(yǎng)皿,MTT用96孔平板,流式細胞計數用6孔板),低糖培養(yǎng)基培養(yǎng)6 h讓其充分貼壁后將其中一份培養(yǎng)基置換為含10% 胎牛血清的5.5 mmol/L的 D-葡萄糖培養(yǎng)基,另一份培養(yǎng)基置換為含10% 胎牛血清的33.3 mmol/L的 D-葡萄糖培養(yǎng)基(此時設置為實驗的0點),培養(yǎng)72 h(此時設置為實驗的72點),將細胞分為空白組、空載體組、過表達C3G組、空白+高糖組、空載體+高糖組、過表達C3G+高糖組。
1.2.2Western blot檢測C3G蛋白相對表達水平 分別提取6組細胞總蛋白,BCA法測定蛋白濃度,用10%十二烷基硫酸鈉-聚丙烯胺分離凝膠(SDS-PAGE),每組分別上樣20 μg蛋白,電泳分離后電轉至聚偏氟乙烯(PVDF)膜上,4%牛奶37 ℃封閉2 h后,一抗孵育8 h以上,洗膜,孵育二抗,洗膜,最后通過 ECL發(fā)光試劑盒顯影成像,進行吸光度值定量分析,實驗重復3次。采用Quantity-One軟件分析各組C3G蛋白的相對表達量,C3G 蛋白相對表達量用C3G吸光度值/β-actin吸光度值表示。
1.2.3MTT法檢測細胞增殖率 分別檢測各組0點、72點細胞的吸光度值,在相應的時間點取相同細胞數加MTT液20 μL (5 mg/mL),4 h后棄液,加200 μL二甲基亞砜(DMSO),37 ℃搖床培養(yǎng)30 min,酶標儀(570 nm波長)測定吸光度值,實驗重復3次。細胞增殖率(%)= (72點吸光度值-0點吸光度值)/0點吸光度值。
1.2.4流式細胞術檢測細胞凋亡率 分別檢測各組72 點的凋亡率。收集細胞,將其懸浮后加入Annexin V-FITC、PI后進行流式細胞儀檢測細胞凋亡,細胞凋亡率=凋亡細胞數/總細胞數。
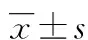
2 結 果
2.1各組H9C2心肌細胞C3G蛋白表達 較空白組(0.764±0.223)、空載體組(0.666±0.200),過表達C3G組(1.233±0.340)的C3G蛋白表達明顯增加(P<0.05)。較空白+高糖組(0.262±0.082)、空載體+高糖組(0.249±0.074),過表達C3G+高糖組(0.646±0.217)的C3G蛋白表達明顯增加(P<0.05),見圖1。
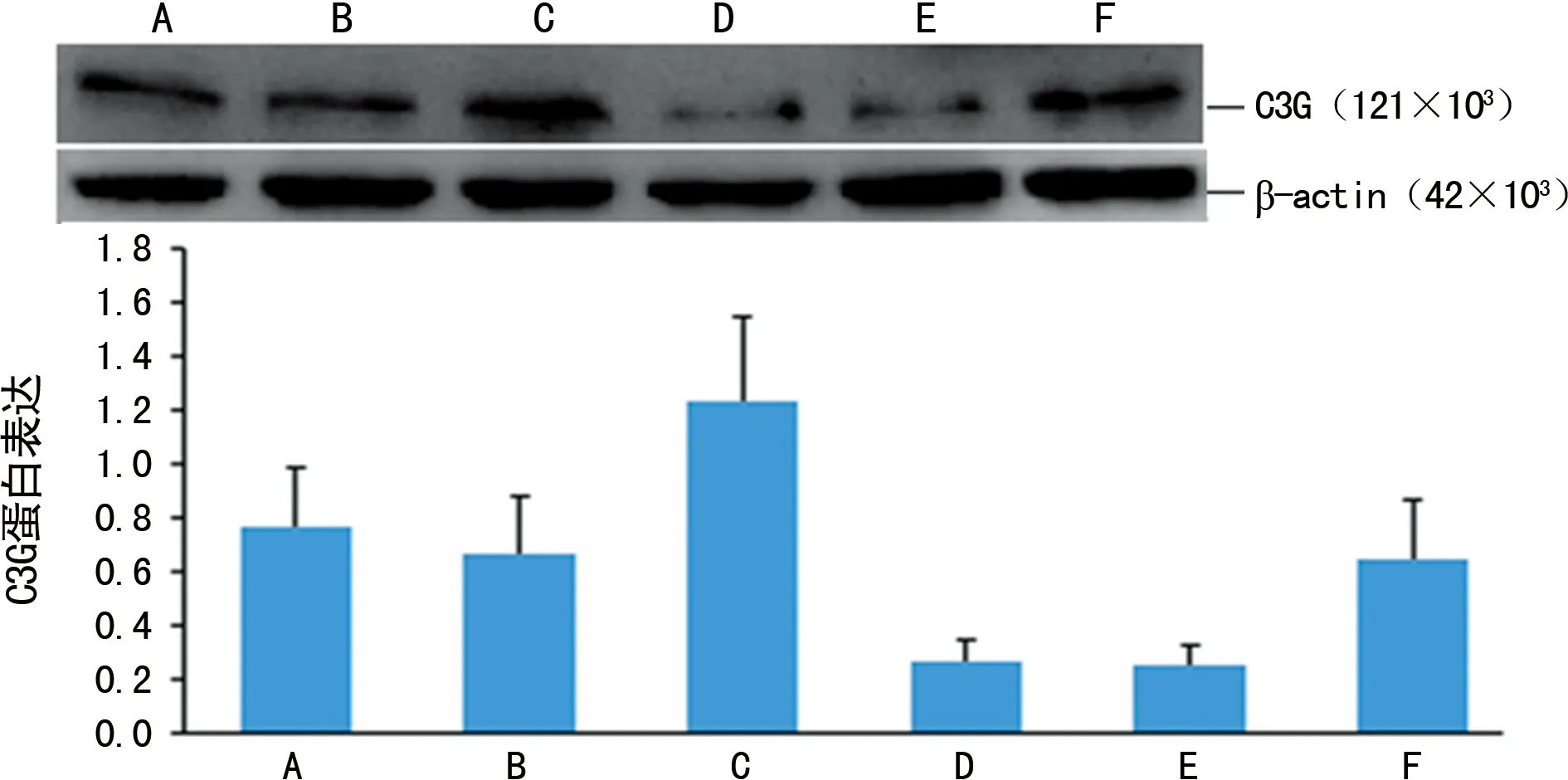
A:空白組;B:空載體組;C:過表達C3G組;D:空白+高糖組;E:空載體+高糖組;F:過表達C3G+高糖組
圖1各組H9C2心肌細胞C3G蛋白表達
2.2各組H9C2心肌細胞增殖率 較空白組、空載體組,空白+高糖組、空載體+高糖組的增殖率均明顯降低(P<0.05);過表達C3G組的增殖率較空白組、空載體組明顯升高(P<0.05);較空白+高糖組、空載體+高糖組,過表達C3G+高糖組的增殖率顯著升高(P<0.05),見圖2、表1。

A:空白組;B:空載體組;C:過表達C3G組;D:空白+高糖組;E:空載體+高糖組;F:過表達C3G+高糖組
圖2各組H9C2心肌細胞的增殖率
2.3各組H9C2心肌細胞凋亡率 較空白組、空載體組,空白+高糖組、空載體+高糖組凋亡率明顯升高(P<0.05);過表達C3G組的凋亡率較空白組、空載體組明顯降低(P<0.05);較空白+高糖組、空載體+高糖組,過表達C3G+高糖組的凋亡率明顯降低(P<0.05),見圖3、表1。

A:空白組;B:空載體組;C:過表達C3G組;D:空白+高糖組;E:空載體+高糖組;F:過表達C3G+高糖組
圖3 各組H9C2心肌細胞的凋亡率
3 討 論
心肌細胞的凋亡增加、生存力降低是許多心血管疾病發(fā)病的重要特點之一[9-10]。研究表明,糖尿病患者中心肌細胞的廣泛凋亡、變性與壞死等心肌結構的改變,嚴重降低了心臟在應對各種損傷時的代償能力,導致心臟結構與泵血功能障礙[11-12]。心肌細胞凋亡在DCM發(fā)病過程中起著重要作用,DCM中的心肌細胞更易發(fā)生壞死、凋亡。
整合素信號通路家族,如整合素的β1、β3 亞基及其下游的焦點黏附激酶(FAK)、整合素連接激酶(ILK)等具有促進心肌細胞存活、抑制心肌細胞凋亡的作用。完全敲除FAK可導致小鼠在胚胎期死亡,而主要原因可能與心血管系統(tǒng)發(fā)育缺陷有關,過表達ILK可促進心肌細胞增殖、存活,抑制心肌細胞凋亡,改善心肌梗死后心臟重塑[2,13-15]。C3G作為其重要成員之一,主要參與胚胎發(fā)育、細胞分化、增殖、凋亡等細胞行為,在心肌細胞及神經系統(tǒng)胚胎發(fā)育中起著必不可少的作用[6,16],然而,在DCM心肌細胞中的作用卻鮮有報道。
本實驗研究發(fā)現,C3G在H9C2心肌細胞中存在表達;過表達C3G可使H9C2心肌細胞中C3G蛋白表達量明顯增加,可明顯降低心肌細胞的凋亡,促進心肌細胞的增殖、存活;經過高糖處理后,心肌細胞出現大量壞死、凋亡,細胞凋亡率明顯升高,細胞增殖率明顯降低,而這種現象經過轉染過表達C3G后得以改善。由此可以證實,過表達C3G可以提高高糖環(huán)境下心肌細胞的生存力,對研究DCM的治療有一定理論意義。
本研究還發(fā)現,在高糖+空白組、高糖+空載體組的C3G蛋白表達較空白組、空載體組明顯減少,說明高糖環(huán)境并不能直接促進心肌細胞自身的C3G蛋白表達;而在過表達C3G+高糖組,其C3G蛋白表達、心肌細胞增殖率、凋亡率較高糖+空白組、高糖+空載體組差異有統(tǒng)計學意義(P<0.05),其機制可能與轉染后C3G在心肌細胞中的表達明顯增加或者與過表達C3G能夠激活或抑制其心肌細胞的某些信號分子有關,但C3G能夠抑制高糖環(huán)境中的心肌細胞凋亡、促進心肌細胞增殖存活的機制仍不清楚,有待進一步研究。
總之,本研究結果證實,高糖環(huán)境能明顯抑制心肌細胞增殖、促進心肌細胞凋亡。過表達C3G可以提高H9C2心肌細胞的生存力,逆轉高糖環(huán)境對心肌細胞所造成的不良影響。本研究為過表達C3G保護糖尿病引起的心肌損傷提供了理論依據,隨著研究的深入,C3G在糖尿病心肌病中的作用及其相關聯(lián)的信號通路也將進一步被明確。C3G有望成為探索DCM發(fā)病機制的新靶點。
[1]XU Z,SUN J,TONG Q,et al.The Role of ERK1/2 in the Development of Diabetic Cardiomyopathy[J].Int J Mol Sci,2016,17(12):156-160.
[2]WESTERMEIER F,RIQUELME J A,PAVEZ M,et al.New molecular insights of insulin in diabetic cardiomyopathy[J].Front Physiol,2016,7:125.
[3]CHEN J,ZHANG Z,CAI L.Diabetic cardiomyopathy and its prevention by nrf2:current status[J].Diabetes Metab J,2014,38(5):337-345.
[4]TSYPLENKOVA VG.Cardiomyocytic dedifferentiation,“hibernation”,and apoptosis are possible factors of progressive diabetic cardiomyopathy[J].Arkh Patol,2009,71(4):30-33.
[5]HUYNH K,BERNARDO B C,MCMULLEN J R,et al.Diabetic cardiomyopathy:mechanisms and new treatment strategies targeting antioxidant signaling pathways[J].Pharmacol Ther,2014,142(3):375-415.
[6]WANG L,LI G,WANG Z,et al.Elevated expression of C3G protein in the peri-infarct myocardium of rats[J].Med Sci Monit Basic Res,2013,19:1-5.
[7]ARAI A,NOSAKA Y,KANDA E,et al.Rap1 is activated by erythropoietin or interleukin-3 and is involved in regulation of beta1 integrin-mediated hematopoietic cell adhesion[J].J Biol Chem,2001,276(13):10453-10462.
[8]楊東艷,李剛,張蕾,等.C3G基因對H9C2心肌細胞凋亡和增殖的影響[J].解放軍醫(yī)學雜志,2015,40(8):603-609.
[9]HUBY A C,TURDI S,JAMES J,et al.FasL expression in cardiomyocytes activates the ERK1/2 pathway,leading to dilated cardiomyopathy and advanced heart failure[J].Clin Sci (Lond),2016,130(4):289-299.
[10]PRESCIMONE T,MASOTTI S,D′AMICO A,et al.Cardiac molecular markers of programmed cell death are activated in end-stage heart failure patients supported by left ventricular assist device[J].Cardiovasc Pathol,2014,23(5):272-282.
[11]WANG S,DING L,JI H,et al.The Role of p38 MAPK in the development of diabetic cardiomyopathy[J].Int J Mol Sci,2016,17(7):842-850.
[12]DELBRIDGE L M,BENSON V L,RITCHIE R H,et al.Diabetic cardiomyopathy:the case for a role of fructose in disease etiology[J].Diabetes,2016,65(12):3521-3528.
[13]FAN D,TAKAWALE A,SHEN M,et al.A Disintegrin and metalloprotease-17 regulates pressure overload-induced myocardial hypertrophy and dysfunction through proteolytic processing of integrin β1[J].Hypertension,2016,68(4):937-948.
[14]BAI J,GU R,WANG B,et al.Overexpression of integrin-linked kinase improves cardiac function in a rat model of doxorubicin-induced chronic heart failure[J].Zhonghua Xin Xue Guan Bing Za Zhi,2014,42(3):225-229.
[15]ELMEKKAWI S F,MANSOUR G M,ELSAFTY M S,et al.Prediction of fetal hypertrophic cardiomyopathy in diabetic pregnancies compared with postnatal outcome[J].Clin Med Insights Womens Health,2015,8:39-43.
[16]RADHA V,MITRA A,DAYMA K,et al.Signalling to actin:role of C3G,a multitasking guanine-nucleotide-exchange factor[J].Biosci Rep,2011,31(4):231-244.

