襄麥冬多糖提取物體外抗氧化活性的光譜學分析
潘婉蓮,楊佳娣,葉國棟,趙苗,余海忠
(湖北文理學院化學工程與食品科學學院,湖北襄陽441053)
襄麥冬(Liriope spicata var.prolifera),即湖北麥冬,又叫麥門冬,味甘、微苦,性微寒,常用于治療肺燥干咳、虛勞咳嗽、津傷口渴、心煩失眠、內熱消渴、腸燥便秘、咽白喉等癥[1]。襄陽歐廟被譽為中國麥冬之鄉,位居中國三大麥冬產地之首,單產高于川、杭麥冬,品質優,具有“白、干、凈、勻、大”的特點。麥冬多糖是動物體中降血糖最主要的有效成分,可降低正常小鼠的血糖,同時對葡萄糖、腎上腺素、四氧嘧啶所導致的小鼠高血糖有明顯的抑制作用[2]。已有學者完成了川麥冬、杭麥冬多糖的抗氧化性測試[3-5],但是鮮見關于襄麥冬多糖提取物抗氧化能力的報道。本研究采用α-脫氧核糖法、鄰苯三酚自氧化法、DPPH法、ABTS法、亞油酸體系法及鐵氰化鉀還原法等方法,利用紫外-可見分光光度計對襄麥冬多糖提取物的體外抗氧化活性及還原能力進行評價,以期能為新的天然抗氧化劑的開發提供理論支持,也為襄麥冬多糖的綜合利用提供一種新的思路。
1 材料與方法
1.1 材料
襄麥冬塊根:采自湖北襄陽歐廟襄麥冬GAP基地。
1.2 儀器
UV-2500紫外-可見光分光光度計:日本島津公司;JA5003B型電子分析天平:上海越平科學儀器有限公司;3K15型小型冷凍高速離心機:德國Sigma公司;Finnpipette移液槍:美國熱電公司;FZ-102微型植物粉碎機:天津泰斯特公司;KH3200DB超聲波清洗器:昆山禾創超聲儀器有限公司;DKB-501A超級恒溫水槽:上海精宏實驗設備有限公司;G-1磁力攪拌器:鞏義市予華儀器有限責任公司;RE-52AA旋轉蒸發儀:上海亞榮生化儀器廠;GZX-9030-MBE電熱恒溫鼓風干燥箱:上海博訊實業有限公司醫療設備廠。
1.3 試劑
DPPH:美國 Sigma公司;乙醚、FeSO4、EDTA、α-脫氧核糖、磷酸、H2O2、三氯乙酸、硫代巴比妥酸、Tris-HCl、鄰苯三酚、HCl、亞油酸、鎢酸鈉、甲醇、Tween-20、鐵氰化鉀:上海國藥(集團)公司;生育酚:購自中國食品藥品檢定研究院。
1.4 襄麥冬多糖提取物的制備
將新鮮襄麥冬塊根洗凈瀝干后60℃烘干至恒重,粉碎。稱取100 g樣品于燒杯中,加入4倍體積95%乙醇,攪拌,過濾,如此重復操作3次,使其充分脫脂,濾渣放入烘箱中烘干。然后,稱取脫脂烘干后的樣品80 g,按料液比1∶10(g/mL)加蒸餾水,80℃恒溫水浴磁力攪拌2 h,提取2次,合并兩次提取液進行離心,取上清液置透析袋中透析48 h后減壓濃縮得浸膏,再用4倍體積95%乙醇對浸膏進行醇沉,產物依次經過無水乙醇、丙酮、乙醚洗滌后,真空干燥,獲得襄麥冬多糖提取物[6]。制備的提取物分別用甲醇或乙醇梯度稀釋成 6.25、12.5、25、50、100、150、200 mg/mL 樣品溶液,備用。
1.5 襄麥冬多糖提取物體外抗氧化活性測定
1.5.1 對·OH清除活性的測定
采用α-脫氧核糖法[7],準確移取0.20 mL的FeSO4-EDTA混合液(10 mmol/L)于具塞試管中,加入 0.20 mL α-脫氧核糖溶液(10 mmol/L),然后各管再依次加入1 mL不同濃度的樣品溶液、0.4 mL磷酸緩沖液(pH7.4,0.1mol/L)以及0.2mLH2O2(10mmol/L),混勻后將具塞試管置于37℃水浴恒溫保持1 h;然后再加入1mL2.8%(質量比)三氯乙酸溶液和1.0mL 1.0%(質量比)硫代巴比妥酸溶液,迅速搖勻置沸水浴中加熱10 min,冷水冷卻后在532 nm處測定吸光值AS。不加襄麥冬多糖提取物,同上操作處理,測定其對比吸光值AC。不加襄麥冬多糖提取物且不在37℃水浴中反應,其它處理同上,測定空白吸光值A0,每個樣品重復3次,按下式計算清除率:
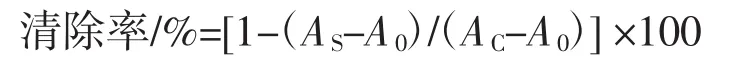
1.5.2 對·O2-清除活性的測定
采用鄰苯三酚自氧化法[8],移取pH8.2的Tris-HCl緩沖液4.5 mL于具塞試管中,放入25℃水浴20 min,然后在各管分別加入0.4 mL不同濃度的樣品溶液和0.1 mL 25℃保溫的鄰苯三酚溶液,混勻,25℃下準確反應4min,立即用10 mol/L HCl溶液2滴終止反應,在325 nm處測定吸光值。對照品以蒸餾水代替糖液,緩沖液加蒸餾水作為空白,每個樣品重復3次,按下式計算清除率:
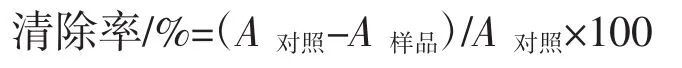
1.5.3 對DPPH自由基清除活性的測定
采用DPPH法[9],移取3.9 mL DPPH甲醇溶液(25 mg/mL)于不同的具塞試管中,分別加入0.1 mL不同濃度的樣品溶液,混勻后,將試管放入暗處反應0.5 h后立刻取出,在515 nm波長處測定其吸光值A,空白用甲醇代替樣品測得空白吸光值為A0,其它方法都一樣。每個樣品重復3次,按下式計算清除率:清除率/%=[(A0-A)/A0]×100。
1.5.4 對ABTS自由基清除活性的測定
采用ABTS法[10],移取7.4 mmol/L的ABTS溶液0.2 mL,加入2.6 mmol/L K2S2O8溶液 0.2 mL,混勻,在室溫條件下放入黑暗區域12 h,再用95%的乙醇稀釋40倍,此時在734 nm處測得吸光度值為0.7±0.02即可。取不同的具塞試管,分別加入0.8 mL上述溶液和0.2 mL不同濃度的樣品溶液,劇烈振搖10s,靜置6min后,立刻在734nm處測得其吸光值AS。空白用乙醇代替測得吸光值為A0,每個樣品重復3次,按下式計算清除率:清除率/%=(1-AS/A0)×100。
1.5.5 抗脂質過氧化活性的測定
采用亞油酸體系法[11],稱取0.29 g亞油酸和0.29 g Tween-20,再加50 mL 0.2 mol/L pH=7.5的KH2PO4-NaOH緩沖溶液。吸取不同濃度的樣品溶液,移入試管中,加2 mL樣油,37℃恒溫水浴15 h,加6 mL 60%(體積比)甲醇溶液終止反應,在234 nm波長處測定吸光度。以空白作參比,每個樣品重復3次,按下式計算其抗氧化活性:抗氧化活性/%=[(A空白-A樣品)/A空白]×100。
1.5.6 還原能力的測定
采用鐵氰化鉀還原法[12],取不同濃度樣品溶液于具塞試管中,加入2.5 mL pH 6.6的磷酸鹽緩沖液(0.2 mol/L)及2.5 mL 1%鐵氰化鉀溶液混合,將混合好的溶液置50℃水浴保溫20 min,再加入2.5 mL 10%三氯乙酸溶液,混勻,靜置10 min后,用分光光度計于700 nm處測其吸光值。以吸光值大小表示還原能力大小,每個樣品重復3次,求其平均值。
2 結果與分析
2.1 對·OH清除能力的測定結果
Fenton反應體系在催化劑作用下,過氧化物能產生兩種活潑的氫氧自由基,從而引發和傳播自由基鏈反應,加快有機物和還原性物質的氧化,從而產生·OH。本研究考察在襄麥冬多糖提取物存在時,·OH對α-脫氧核糖分子的氧化、破壞情況,從而來確定麥冬多糖對·OH的清除活性,結果見圖1。
由圖1可以看出,襄麥冬塊根多糖溶液對羥自由基的清除活性,隨著其質量濃度的增加而逐漸增強,在濃度達到100 mg/mL之前,清除率保持較大的增幅,此后,盡管隨濃度的增大而清除率繼續增強,但是增幅明顯降低,清除活性維持在51%左右。而陽性對照生育酚的清除率,從50 mg/mL濃度開始,增幅顯著減小,總體上清除率維持在80%左右。
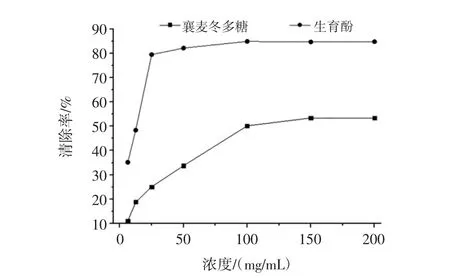
圖1 襄麥冬多糖提取物的體外清除羥基自由基的能力Fig.1 In vitro scavenging hydroxyl radical ability of L.spicata var prolifera polysaccharide
2.2 對·O2-清除能力的測定結果
在堿性條件下(pH8.2)鄰苯三酚發生自氧化反應,生成超氧陰離子自由基(·O2-)和中間產物,該中間產物在325 nm處有一特征吸收峰。當加入自由基清除劑時,·O2-的生成會受到抑制作用,自氧化過程也會受阻,中間產物生成減少,在325 nm處的吸收減弱。因此,可以通過測定A325的變化來評價襄麥冬多糖提取物對·O2-的清除能力,不同濃度的樣品溶液清除結果見圖2。
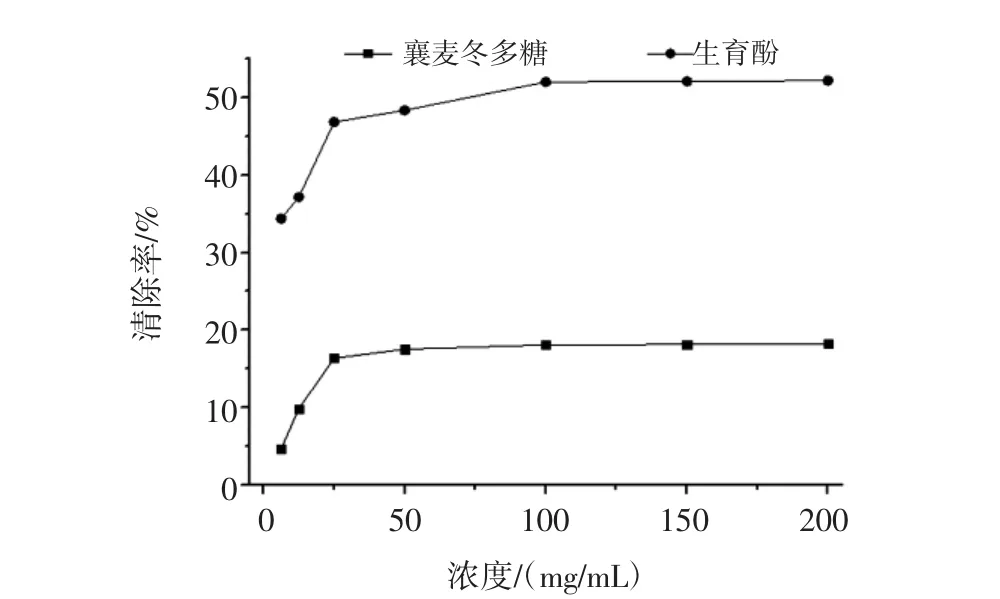
圖2 襄麥冬多糖提取物的體外清除·O2-的能力Fig.2 In vitro scavenging·O2-of L.spicata var prolifera polysaccharide
由圖2可知,不同濃度的襄麥冬多糖提取物與生育酚均對鄰苯三酚自氧化反應有一定的抑制作用,即對·O2-有一定的清除能力,隨著多糖濃度的增加,二者清除自由基的能力也逐漸增加,且清除率保持著類似的上升趨勢。但是,總體上來看,襄麥冬多糖對·O2-的清除活性并不是太強,其清除率也僅維持在20%,遠低于同濃度的生育酚的52%左右。
2.3 對DPPH自由基清除能力的測定結果
DPPH被甲醇溶解后形成一種穩定以氮為中心的質子的自由基(DPPH·),甲醇溶液呈紫紅色,在515 nm處有強吸收。當自由基清除劑提供一個電子與DPPH·的孤對電子配對,而使其顏色消退,在最大吸收波長處減弱,其中褪色程度與其接受的電子呈定量的一種關系。這種顏色變淺的狀況與配對電子數呈定量的關系可用于評價DPPH·的清除情況。不同濃度的襄麥冬多糖提取物清除DPPH·的活性測試結果見圖3。
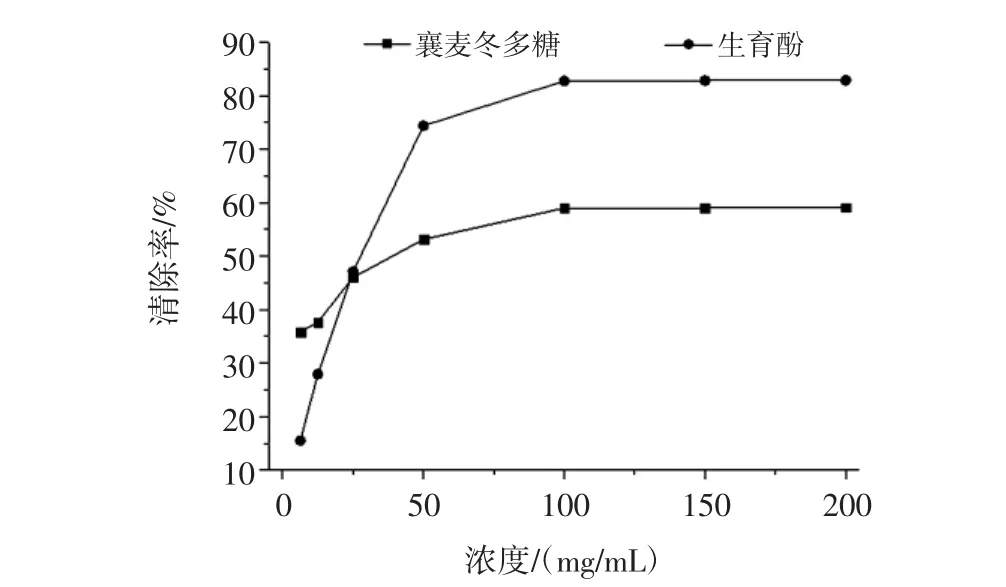
圖3 襄麥冬多糖提取物的體外清除DPPH自由基能力Fig.3 In vitro scavenging DPPH radical ability of L.spicata var prolifera polysaccharide
從圖3可以看出,襄麥冬多糖提取物體外清除DPPH·的活性較強,隨著濃度的增加其清除DPPH自由基的能力也在逐漸增強,并呈現一定的量效關系,在濃度達到100 mg/mL之后,其清除率總體維持在59%左右,這表明襄麥冬多糖提取物對DPPH自由基有比較好的清除能力。同時,由圖3還可發現,在濃度達到25 mg/mL之前,低濃度的樣品溶液其清除DPPH自由基的活性,要高于同濃度的生育酚。
2.4 對ABTS自由基清除能力的測定結果
ABTS溶液在合適的氧化劑的作用下,會自動氧化成綠色的ABTS溶液,在734 nm處可以測定其吸光度。但是在抗氧化劑存在的情況下,ABTS自由基的產生會被抑制,溶液的顏色會變淺。因此,通過測定ABTS自由基在734 nm處的吸光度變化,即可測定出樣品的總抗氧化活性大小。
襄麥冬多糖不同濃度的提取物體外清除ABTS自由基的測定結果見圖4,由圖4可知,隨著提取物濃度的增大其清除ABTS自由基的能力越強,并呈現一定的量效關系:在供試溶液濃度達到100 mg/mL之前,不論是標準品還是樣品,其清除率的增幅隨濃度的增大而增加。此后,盡管二者清除率依然會隨濃度的增大而繼續增加,但是增幅急劇減小,二者對ABTS自由基的清除活性維持在50%和80%左右。
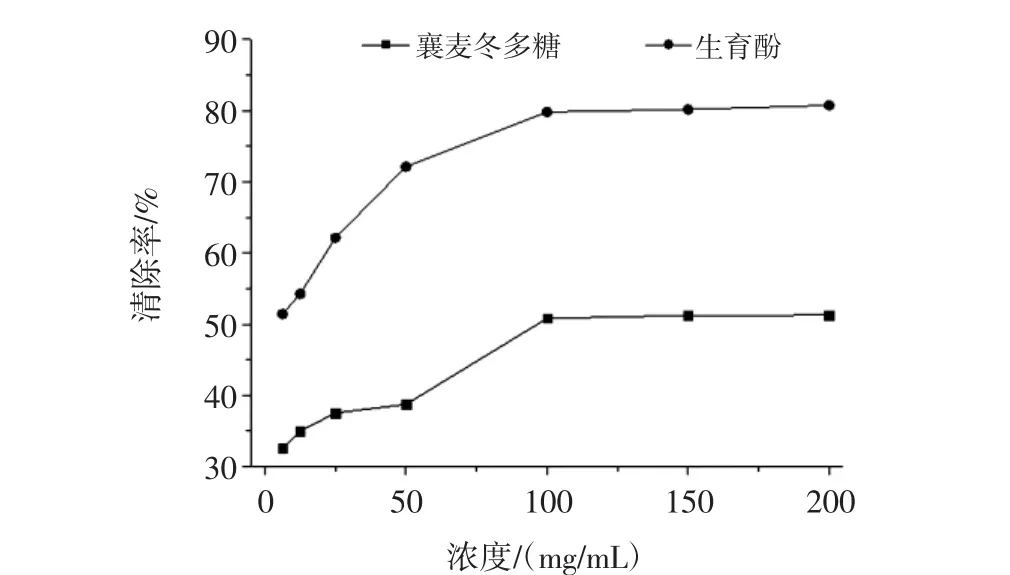
圖4 襄麥冬多糖提取物的體外清除ABTS自由基的能力Fig.4 In vitro scavenging ABTS radical ability of L.spicata var prolifera polysaccharide
2.5 抗脂質過氧化活性的測定結果
脂質的自動氧化也稱脂質的過氧化作用。脂質的過氧化一般定義為多不飽和脂肪酸或脂質的氧化變質。若糖類物質含量較高的情況下也會抑制脂質的氧化,襄麥冬多糖提取物的體外抗脂質過氧化活性見圖5。

圖5 襄麥冬多糖提取物的體外抗脂質過氧化活性Fig.5 In vitro anti lipid peroxidation activity of L.spicata var prolifera polysaccharide
由圖5可知,襄麥冬多糖提取物能明顯的抑制亞油酸的自氧化,同生育酚相比,雖然低濃度的多糖對亞油酸的抑制作用偏低,但隨其濃度加大,其抑制脂質過氧化活性越強,且抑制增幅接近于生育酚的趨勢。當濃度達到100 mg/mL之后,襄麥冬多糖提取物對脂質過氧化的抑制率保持在55%左右,顯示出較強的抗脂質過氧化特性。
2.6 還原能力的測定結果
三價鐵離子具有氧化性,還原糖可將其氧化。若反應體系中存在有還原性物質時,鐵氰化鉀會被還原成亞鐵氰化鉀,亞鐵氰化鉀在酸性條件下與三氯化鐵反應,生成普魯士藍,在700 nm波長處有最大吸收波長。故吸光值越大,表示待測還原性物質的還原能力越強。
抗氧化劑清除自由基的機理是通過自身的還原作用給出電子來清除的,一般來說,吸光值越大,還原能力就越強,其抗氧化性就越好,襄麥冬多糖提取物的體外還原能力見圖6。
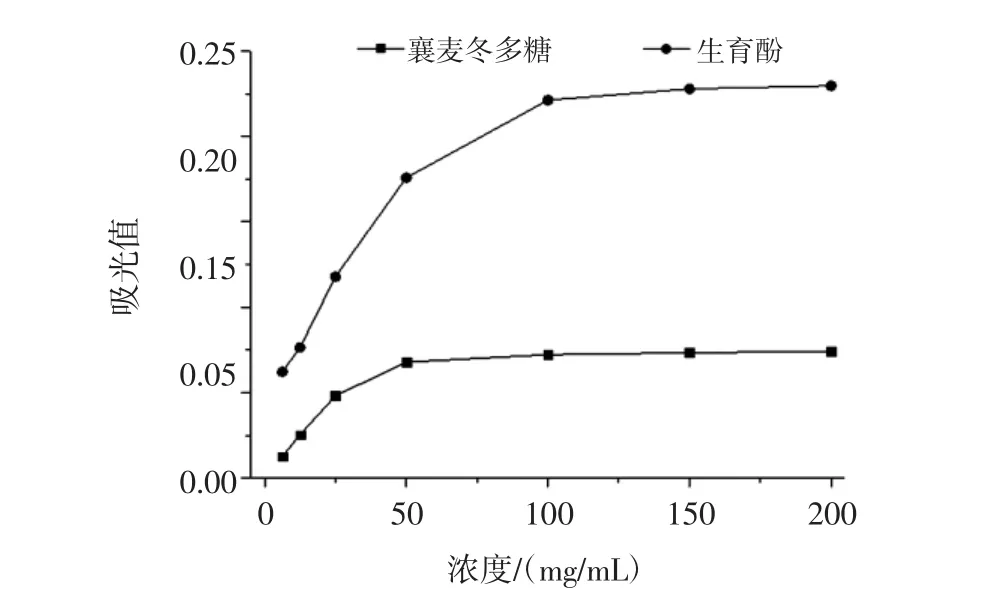
圖6 襄麥冬多糖提取物的體外還原能力Fig.6 In vitro reduction ability of L.spicata var prolifera polysaccharide
由圖6可以看出,隨著襄麥冬多糖提取物濃度的增大,處理后的樣品溶液其吸光值也逐漸增大,即對鐵氰化鉀的還原能力也增強,當濃度達到50 mg/mL之后,其吸光值增幅顯著減小,數值逐漸維持在0.073上下,這表明盡管濃度在不斷增大,但是襄麥冬多糖的還原能力趨于穩定。
3 小結與討論
目前,國內關于麥冬多糖的抗氧化活性報道,幾乎全部集中在麥冬Ophiopogon jaonicus上,鮮見襄麥冬Liriope spicata var.prolifera的。本文采用α-脫氧核糖法、鄰苯三酚自氧化法、DPPH法、亞油酸體系法、ABTS法以及鐵氰化鉀還原法等方法,對產自湖北襄陽的道地藥材——襄麥冬多糖提取物的體外抗氧化活性進行了測定。結果表明,襄麥冬多糖的清除自由基活性與其提取物的濃度呈線性關系,濃度越高,其清除自由基能力和還原能力就越強。除了對超氧陰離子的清除率僅為20%之外,麥冬多糖對其它自由基的清除率都超過50%,尤其對DPPH自由基最高,維持在59%左右。同時,研究還發現,襄麥冬多糖提取物對鐵氰化鉀的還原能力以及抗脂質過氧化活性,均是隨著多糖質量濃度的增高而增強。
嚴碧歌采用超聲波處理提取川麥冬多糖,發現雖然不會影響多糖的單糖組成,但是會改變多糖的微觀結構,提高多糖的抗氧化活性[13]。趙凱的報道則顯示,經超聲波處理所得麥冬多糖,除超氧陰離子自由基(O2-·)的清除作用喪失外,其它抗氧化活性均得到提高[14]。研究還發現,超聲功率對麥冬多糖的抗氧化活性具有顯著影響:隨著超聲功率的增大,麥冬多糖的抗氧化活性呈現出先增大后減小的趨勢,且超聲功率為400 W時其抗氧化活性最高[15]。王艷翠[16]對麥冬體外抗氧化測試結果顯示麥冬的氯仿/甲醇提取物和正丁醇萃取物具有較好的抗氧化活性,而粗多糖的抗氧化活性較低。李明[17]研究發現麥冬多糖可提高長期負荷訓練大鼠的免疫功能,抑制過氧化損傷和糖原的耗竭,具有良好的開發前景。張力妮[18]測試了經過硫酸化、磷酸化以及羧甲基化修飾的8種麥冬多糖的體外抗氧化活性,發現它們均具有一定的抗氧化活性,尤其對于DPPH自由基,清除率最高可達70%。陳剛[19]實驗證明具有很好的吸濕保濕性能,具有很好的還原能力,為麥冬多糖開發成保健品或化妝品提供了一定的理論依據。張婭芳的實驗表明6種麥冬多糖均具有體外抗氧化活性,且呈劑量依賴關系,其中POJ-SS體外抗氧化性最強,她推測這可能與其具有β-(1,3)鍵合的葡聚糖骨架有關系[20]。
襄麥冬是一種藥食兩用植物,目前已開發出麥冬酒、麥冬茶、麥冬酸奶等產品,本文對其多糖展開的抗氧化性研究,將非常有助于襄麥冬資源的綜合利用,尤其是為植物性天然食品抗氧化劑的開發,提供了一種新的思路。
[1]劉立萍,李然.“純補胃陰”論麥冬[J].遼寧中醫雜志,2011(1):132-133
[2]王智杰,茍小林.麥冬降血糖作用的藥效學研究[J].中醫藥學刊,2003,21(6):898-899
[3]張力妮,張靜,孫潤廣,等.麥冬多糖的修飾及其抗氧化活性與空間結構的研究[J].食品與生物技術學報,2014,33(1):27-33
[4]王昭晶,羅巔輝.麥冬水溶性多糖OPA的分離純化及其抗氧化活性研究[J].現代中醫藥,2008,28(5):77-79
[5]王昭晶,羅巔輝.麥冬水溶性多糖OPB的分離純化及抗氧化活性研究[J].長春中醫藥大學學報,2008,24(3):254-255
[6]孫永林,余海忠,劉慧宏,等.湖北麥冬塊根多糖提取工藝的優化[J].食品工業科技,2011(4):293-294
[7]周婷,劉統,林丹潔,等.魚腥草甲醇提取物體外抗氧化性及抑菌活性評價[J].山地農業生物學報,2012,31(3):87-90
[8]陳留勇,孟憲軍,賈薇,等.黃桃水溶性多糖的抗腫瘤作用及清除自由基、提高免疫活性研究[J].食品科學,2004,25(2):167-170
[9]余海忠,劉統,林丹潔,等.鄂西北產魚腥草提取物體外抗氧化性的四種化學方法評價[J].中國野生植物資源,2012,31(1):22-25
[10]白海娜,王振宇,劉瑞海,等.白藜蘆醇與黑木耳多糖協同清除ABTS自由基活性的研究[J].現代食品科技,2014,30(3):64-68
[11]聶倫,熊尚森,余海忠.襄麥冬不同極性部位粗提物抗氧化性能初步評價[J].山地農業生物學報,2013,32(1):87-90
[12]余海忠,阮士龍,劉統,等.鄂西北產貓眼草提取物體外抗氧化性及光穩定性測試[J].西北農業學報,2012,21(4):137-141
[13]嚴碧歌,趙凱,杜柯.超聲波提取對麥冬多糖結構和抗氧化活性的影響[J].壓電與聲光,2011,33(6):859-862
[14]趙凱.超聲波對麥冬多糖的提取率、結構及抗氧化活性的影響[D].西安:陜西師范大學,2011
[15]王小梅,孫潤廣,張靜,等.超聲提取功率對麥冬多糖結構及抗氧化活性的影響[J].陜西師范大學學報(自然科學版),2013,41(3):68-75
[16]王艷翠.麥冬化學和營養成分及其體外活性的研究[D].楊凌:西北農林科技大學,2016
[17]李明.麥冬多糖對訓練大鼠免疫及抗氧化功能的影響[J].食品科技,2014,39(8):182-186
[18]張力妮.麥冬多糖的修飾、抗氧化活性以及結構的研究[D].西安:陜西師范大學,2014
[19]陳剛,郭曉蕾,寶麗.銀耳、麥冬、燕麥多糖的抗氧化活性及吸濕保濕性能研究[J].中華中醫藥學刊,2013,31(1):212-214
[20]張婭芳.麥冬多糖的結構分析及其體外抗氧化活性研究[D].西安:陜西師范大學,2007

