針刺對慢性腦缺血大鼠三叉神經脊束核神經元鈣通道Cav1.3表達及凋亡的影響*
郭 森,魏 萌,楊松鶴,喬躍兵、2
(1.承德醫學院人體解剖學教研室,河北承德 067000;2.滄州醫學高等專科學校)
針剌是中國傳統醫學特有的一種治療手段,大量臨床和實驗研究都已證明,針刺可通過抑制炎性反應、減輕氧化應激損傷、減少細胞凋亡、促進腦血管再生等途徑保護神經元[1-3]。也有研究指出[4],電針刺激“四白”穴可以誘發大鼠三叉神經脊束核神經元中有衣小泡的產生,有衣小泡在神經元發育及對抗損傷的過程中都發揮了重要作用[5-6],但作用機制仍不明確。本研究通過觀察針刺腦缺血大鼠“四白”穴后三叉神經脊束核中鈣通道Cav1.3蛋白表達的變化和神經元的凋亡情況,探討腦損傷后電針作用的可能機制。
1 材料與方法
1.1 實驗動物及分組 Wistar大鼠,雄性,200g-220g。36只大鼠隨機分為3組,針刺組、缺血對照組和假手術組,每組12只。針刺組和缺血對照組大鼠阻斷左側頸總動脈和雙側椎動脈建立模型,假手術組只暴露相應動脈不予阻斷;針刺組大鼠于阻斷血管24h后給予針刺處理。
1.2 主要設備及試劑 G6805-2A型電針治療儀(上海華誼醫用儀器廠),H7650透射電子顯微鏡(日本日立公司),冰凍切片機(美國Thermo Scientific公司);兔源性抗Cav1.3抗體(美國Abcam公司),TUNEL試劑盒(瑞士羅氏公司)。
1.3 大鼠慢性腦缺血模型的制備 大鼠用10%水合氯醛腹腔注射麻醉(300mg/kg),仰位固定,頸部正中切口,暴露左側頸總動脈并結扎切斷;大鼠俯位固定,頸部后正中線切口,暴露第一頸椎橫突孔,電凝雙側椎動脈。
1.4 大鼠針刺方法 針刺組大鼠于阻斷血管24h后給予針刺處理。于大鼠第二排剛髭中間處[6](相當于人的“四白”穴)刺入電針,接通電針治療儀,選擇疏密波(40Hz/s,輸出電壓5V),連續針刺3h,1次/天,針刺15天。
1.5 標本的采集及指標檢測 每組12只大鼠,隨機選取其中的6只用于制作光鏡標本,其余6只用于制作電鏡標本。
1.5.1 光鏡標本的采集及指標檢測:大鼠于腹腔內注射10%水合氯醛麻醉(300mg/kg),4%多聚甲醛400ml固定,取出第四腦室底髓紋至枕骨大孔部分的腦組織,后固定過夜,30%蔗糖浸至下沉后行冠狀切面冷凍切片(厚20μm)。
⑴免疫組織化學染色:采用免疫組織化學染色法檢測鈣通道Cav1.3蛋白的表達,一抗工作濃度1:200,DAB顯色,以神經元胞質內有黃褐色顆粒為Cav1.3陽性神經元。采用Image-Pro Plus 6.0軟件進行定量分析,用三叉神經脊束核內染色的平均光密度(OD)值作為鈣通道Cav1.3蛋白相對表達量的指標。
⑵神經元凋亡的檢測:按TUNEL試劑盒提供的實驗步驟進行操作,D A B顯色。細胞中有黃褐色顆粒者為TUNEL陽性細胞,即凋亡神經元。每只大鼠隨機選取10個200倍光鏡視野,以10個視野內陽性細胞的平均值,作為該大鼠凋亡神經元的數量。
1.5.2 電鏡標本的采集及染色:大鼠腹腔內注射10%水合氯醛麻醉(300mg/kg),4%多聚甲醛、1%戊二醛混和液400ml固定,取出延髓,參照《大鼠腦立體定位圖譜》切取三叉神經脊束核部分。所得標本于25%戊二醛中固定4h,0.1mol/L的PBS沖洗5次,1%鋨酸固定2h,0.1mol/L的PBS漂洗12h,丙酮梯度脫水,Epon812浸透包埋,超薄切片,鈾鉛染色。
1.6 統計分析 采用SPSS 19.0軟件進行統計分析。各組間計量資料的比較采用單因素方差分析,各組間兩兩比較采用q檢驗。P<0.05為差異具有統計學意義。
2 結果
2.1 各組大鼠三叉神經脊束核鈣通道Cav1.3蛋白的表達針刺組大鼠三叉神經脊束核鈣通道Cav1.3蛋白表達明顯高于缺血對照組,但仍低于假手術組,組間比較差異有統計學意義(P<0.05)。見附表:
附表 各組大鼠三叉神經脊束核鈣通道Cav1.3蛋白表達和神經元凋亡情況(± s,n=6)

附表 各組大鼠三叉神經脊束核鈣通道Cav1.3蛋白表達和神經元凋亡情況(± s,n=6)
與假手術組比較:*P<0.05;與缺血對照組比較:△P<0.05
組別 Cav1.3蛋白表達 神經元凋亡數量假手術組 173.76±7.52 5.35±0.82缺血對照組 119.51±6.17* 17.15±1.27*針刺組 136.9±6.52*△ 12.07±1.35*△
2.2 各組大鼠三叉神經脊束核神經元凋亡情況 各組大鼠三叉神經脊束核內均可檢測到凋亡神經元,神經元凋亡數量:缺血對照組>針刺組>假手術組,各組間凋亡神經元數量比較差異具有統計學意義(P<0.05)。見附表。
2.3 各組大鼠三叉神經脊束核尾側亞核神經元超微結構觀察 假手術組大鼠,神經元細胞核核膜完整,核內染色質均勻;胞質內粗面內質網發達,排列規則,線粒體豐富(圖1)。缺血對照組大鼠,細胞核變形,核膜內陷形成核袋或假包涵體(圖2)。針刺組大鼠,神經元缺血性改變較缺血對照組輕;神經元細胞核形態較規則(圖3);在胞質內可見到有衣小泡,多呈圓形,質膜外多附有毛刺狀外衣,大部分有衣小泡位于細胞膜附近(圖4)。
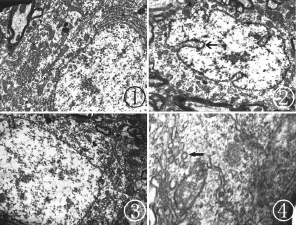
附圖 大鼠三叉神經脊束核尾側亞核神經元超微結構
3 討論
L-型鈣通道Cav1.3是電壓依賴性鈣通道,在中樞神經系統分布廣泛,參與鈣穩態、激素分泌和基因表達等多種功能的調控[7-8]。以往認為,神經元缺血后L型鈣通道的開放是導致細胞內Ca2+超載及神經元死亡的重要因素[9]。但隨著對神經元缺血損傷研究的不斷深入,人們發現細胞內Ca2+濃度降低同樣可以導致神經元凋亡,尤其是在慢性腦缺血的過程中,L-型鈣通道表達的減少也是造成神經元凋亡的重要因素[10]。因此,對缺血后神經元L-型鈣通道的保護可能成為減少神經元凋亡的有效手段。
針剌作為中國傳統醫學特有的一種治療手段,目前已經廣泛地應用于缺血性腦血管疾病的治療,且已被證明可通過減輕氧化應激損傷、減少細胞凋亡、促進腦血管再生等途徑在缺血性腦血管疾病中發揮保護神經元的作用[1-3]。孔祥玉等發現[4],電針刺激大鼠“四白”穴可誘發三叉神經脊束核神經元中有衣小泡的產生,這些有衣小泡的形成主要與神經元發育和對抗損傷因素的某些過程有關。本研究超微結構觀察亦發現了有長小泡的產生。另外,本研究還觀察了針刺后慢性腦缺血大鼠三叉神經脊束核神經元鈣通道Cav1.3表達的改變及神經元的凋亡情況,結果顯示,針刺組大鼠三叉神經脊束核神經元鈣通道Cav1.3蛋白的表達明顯高于缺血對照組、凋亡神經元數量明顯低于缺血對照組。考慮可能機制為,電針誘發產生的有衣小泡介導了細胞膜鈣通道Cav1.3在不同神經元之間的交換和循環,防止了受缺血影響較嚴重的神經元鈣通道Cav1.3表達的過度減少,進而阻止神經元鈣穩態的破壞和凋亡的發生。
綜上所述,針刺雖能抑制大鼠腦缺血后三叉神經脊束核神經元鈣通道Cav1.3表達的減少和神經元凋亡,但具體機制仍需進一步探索。
【參考文獻】
[1]王守巖,馬賢德,王哲,等.眼針對大鼠急性腦缺血再灌注損傷腦組織ICAM-1表達的影響[J].北京中醫藥大學學報,2012,35(1):38-41.
[2]閆明茹,鄭宇,孫潔,等.不同時機介入醒腦開竅針刺法對腦缺血再灌注大鼠SOD活性和MDA含量的影響[J].現代生物醫學進展,2013,13(10):1887-1891.
[3]王春霞,孫遠征.頭穴叢刺法對慢性腦缺血大鼠海馬血管內皮生長因子表達的影響[J].針刺研究,2012,37(5):375-379.
[4]孔祥玉,趙淑敏,張書琴.針刺過程中有衣小泡的形成、形態特征及其數量變化的研究[J].神經解剖學雜志,1993,9(1):39-45.
[5]Eckenhoxff MF,Pysh JJ.Double-walled coated vesicle formation:evidence for massive and transient conjugate internalization of plasma membranes during cerebellar development[J]. J Neurocytol,1979,8(5): 623-638.
[6]喬躍兵,馬秀艷,孔祥玉,等.延長針刺時間大鼠三叉神經脊束核尾側亞核非突觸部位胞吐數量的變化[J].中國臨床康復,2006,10(35):78-80
[7]Hirtz JJ, Boesen M, Braun N, et al. Cav1.3 calcium channels are required for normal development of the auditory brainstem[J].J Neurosci,2011,31(22):8280-8294.
[8]Nú?ez-Santana FL, Oh MM, Antion MD, et al. Surface L-type Ca2+channel expression levels are increased in aged hippocampus[J]. Aging Cel,2014,13(1):111-120.
[9]王金華,劉佩芳.丹參酮ⅡA對腦缺血再灌注損傷大鼠神經元L-型鈣通道表達的影響[J].中國中醫藥科技,2008,15(6):442-443.
[10]郭森,朱江,王永為,等.丁苯酞對缺血大鼠大腦皮質中鈣通道Cav1.3表達的影響[J].中風與神經疾病雜志,2016,33(1):38-41.

