黃芪對香菇菌絲體及子實體中成分的影響
張勁松,牛宇,張麗珍,單璐,聶建軍,徐全飛,馮婉君,潘保華
1(山西大學 生物技術研究所,山西 太原,030006) 2(山西省農業科學院 農業資源與經濟研究所,山西 太原,030006) 3(山西大學 生命科學學院,山西 太原,030006)
黃芪(Astragalusmembranaceus),蝶形花科黃芪屬黃芪種,國家三級保護植物,傳統中藥材。主要分布在山西、甘肅、黑龍江、內蒙古、遼寧、河北等地。皂苷類、黃酮類、多糖類為黃芪中主要的三類物質[1]。現已明確黃芪在心肌損傷[2]、低氧-復氧造心肌損傷[3]等模型中,可緩解肌漿網,并影響肌漿網內Ca- ATP酶,從而調節鈣的轉運過程,影響心臟功能。免疫方面,黃芪對T,B淋巴細胞增殖、腹腔巨噬細胞功能等都有影響[4]。另有研究表明黃芪甲苷具有抗乙型肝炎病毒的活性[5]。
香菇(Lentinusedodes),擔子菌門,傘菌目,是一種常見食用菌。中國是世界人工栽培香菇的發祥地,是全球最大的香菇生產和消費國[6]。香菇子實體可以食用,味道鮮美,口感潤滑,富含蛋白質、氨基酸和多種礦物質元素,脂肪含量低,是理想的健康食品,深受消費者們喜愛[7]。我國香菇栽培技術已經十分成熟[8]。隨著香菇消費量的逐年增加,如何培育出新型特色香菇品種成為了新興研發熱點,其中改變香菇栽培料配方便是其中之一[9-12]。本實驗探究了使用黃芪作為培養基質,并對香菇的菌絲體和子實體中的總多糖、總酚酸、總黃酮和總皂苷含量進行測定,同時利用高效液相色譜法檢測添加黃芪后獲得的香菇菌絲體和子實體中的毛蕊異黃酮葡萄糖苷和芒柄花苷的含量。
1 材料與方法
1.1 材料
材料:黃芪、黃芪下腳料,山西裕隆祥農業發展有限公司;香菇菌種,山西省農科院農業資源與經濟研究所保藏。
1.2 供試培養基
PDA固體培養基:馬鈴薯20%、葡萄糖2%、MgSO40.2%、KH2PO40.2%、蛋白胨0.3%、瓊脂2%。
液體種子培養基:黃豆芽汁20%、葡萄糖2%、酵母膏0.5%、KH2PO40.2%、MgSO40.1%、VB10.01%,pH自然。
栽培袋培養料配方:木屑40%,鋸末20%,棉籽殼30%,麥麩18%,豆粉2%,石膏0.5%,含水量65%。
1.3 儀器
SNE-3000M臺式掃描電子顯微鏡,韓國(株)SEC公司;Infinite M200 PRO 全波長多功能微孔板檢測器,帝肯公司;U3000型戴安高效液相色譜儀,Thermo fisher科技(中國)有限公司;Christ ALPHA 2-4 LD plus真空冷凍干燥機;Sigma 2-16PK冷凍離心機德國西格瑪公司,德國西格瑪公司;YXQ-LS-50立式壓力蒸汽滅菌鍋,上海博迅實業有限公司醫療設備廠;DHG-9040S電熱恒溫鼓風干燥箱,寧波東南儀器有限公司;RE-2000A型旋轉蒸發器,上海市嘉鵬科技有限公司;BS-S恒溫振蕩培養箱,國華電器有限公司;ME 204電子天平,梅特勒-托利多儀器(上海)有限公司;SW-GJ-1FD系列超凈工作臺,上海博訊實驗有限公司醫療設備廠;SL-500A型高速多功能粉碎機,浙江省永康市松青五金工具廠。
1.4 實驗方法
1.4.1 黃芪水提物的制備
將黃芪根部藥材切成段,粉碎,過篩,精確稱量100.00 g,置于700 mL蒸餾水中浸泡2 h,邊攪拌邊加熱45 min,4層紗布過濾殘渣后抽濾,取上清液,重復收集2次,合并提取液。減壓濃縮至50 mL,冷凍干燥后研磨成粉末即得黃芪水提物干粉,避光干燥處保藏。
1.4.2 香菇菌絲體掃描電鏡形態觀察
配黃芪水提物濃度為3 g/100 mL的PDA培養基,121 ℃濕熱滅菌20 min后倒平板。待平板培養基水汽消失后,接種活化好的菌種,72 h后挑取菌落邊緣在電鏡下觀察香菇菌絲體的形態,與未添加黃芪水提物的對照做比較。
1.4.3 香菇深層發酵添加黃芪水提物最大量的確定
配制2 g/mL的黃芪水提物溶液(溶劑為水),備用。取50 mL的錐形瓶,依次添加黃芪水提物溶液0、0.3、0.6、1.2、1.8、2.4、3.6 mL,將熱的PDA培養基稱量后倒入錐形瓶中加至24 mL,振蕩混勻,配成黃芪水提物濃度為0、0.25、0.5、1.0、1.5、2.0、3.0 g/100 mL的培養基。滅菌,趁熱倒平板,以8 mL為量每個濃度倒3個平板。待培養基水汽消失,將活化好的香菇菌種用打孔器取6 mm2接種于培養基上。連續觀察6 d,記錄香菇菌絲體生長情況。按公式(1) 計算黃芪水提物對香菇菌絲生長的抑制率。篩選原則以不顯著影響香菇生長的最大黃芪水提物添加量作為香菇深層發酵中添加黃芪水提物的量。
(1)
1.4.4 香菇液體發酵
1.4.4.1 液體發酵母液的制備
將活化好的香菇菌種接入裝有100 mL液體種子培養基的250 mL錐形瓶中,置于搖床上100 r/min,28 ℃培養7d作為接種時的母液。
1.4.4.2 添加黃芪水提物的香菇的液體發酵
吸取10 mL培養7 d的香菇母液,接入100 mL液體種子培養基,處理組中黃芪水提物添加濃度為0.5 g/100 mL,轉速100 r/min,恒溫培養箱中28 ℃培養7 d,備用。
1.4.4.3 液體發酵后菌球形態的特征比較
發酵完畢后取出1 mL菌液,數出菌球個數,計算菌球密度。隨機取出10個菌球排成一排置于載玻片上,在載玻片下襯坐標紙測量菌球平均直徑。從對照組和添加黃芪水提物組中各取3個大小形態近似的菌球,分別接種在PDA培養基上,統計菌絲萌發的時間,從萌發時間開始每隔24 h測量菌落半徑,連續觀察6 d,計算菌絲的日均生長量。最后將菌球過濾并清洗,60 ℃干燥至恒重,稱重。
1.4.5 菌絲體干粉的制備
將培養好的液體發酵液在3 500 r/min條件下離心20 min,清洗后再離心,將沉淀在60 ℃恒溫鼓風干燥箱中干燥至恒重,研磨成粉末,稱重,密封保存備用。測定并計算香菇菌絲體中的黃芪總皂苷、總酚酸、總黃酮、胞內多糖、胞外多糖、毛蕊異黃酮葡萄糖苷、芒柄花苷的轉化率,計算見公式(2):

(2)
1.4.6 香菇栽培添加黃芪下腳料最大量的確定
以普通栽培料配方作為對照,加入3只高20 cm的試管中,邊加栽培料邊壓實,加至試管2/3處。以分別添加5%、10%、15%、20%、25%的黃芪下腳料的栽培料作為實驗組。高壓蒸汽滅菌,放置1 d,將活化好的香菇菌種取出,用打孔器將大小為6 mm2的菌種接入試管中,在培養箱中28 ℃培養,每隔24 h觀察菌絲體生長狀況,以此來判斷田間栽培時黃芪下腳料的添加量。
1.4.7 添加黃芪下腳料的香菇栽培
以普通培養料配方作為對照組,在普通培養料配方基礎上添加最適黃芪下腳料作為實驗組,采用菌袋栽培法大棚內栽培。將培養好的香菇子實體及時采摘,收獲普通香菇子實體與添加黃芪下腳料栽培收獲的香菇子實體。曬干后于4 ℃冰箱密封保藏。測定并計算黃芪總皂苷、總多酚、總黃酮、總多糖、毛蕊異黃酮葡萄糖苷、芒柄花苷的轉化率,轉化率見公式(3):

(3)
1.4.8 樣品前處理
1.4.8.1 總皂苷提取
取樣品1 g,加15 mL甲醇,超聲提取30 min,4 000 r/min離心5 min,用0.45 μm濾膜過濾,殘渣用甲醇超聲提取2次,合并濾液,減壓蒸干。加入10 mL體積分數為10%氨水,振搖10 min,分別用15、10、10 mL正丁醇萃取3次,合并提取液,減壓蒸干,甲醇定容至10 mL。
1.4.8.2 總黃酮、總酚酸提取
取樣品1 g,加入15 mL體積分數為70% 乙醇浸泡24 h,于30 ℃水浴超聲30 min,5 000 r/min離心15 min,重復提取2次,合并濾液,減壓蒸干,甲醇定容至10 mL。
1.4.8.3 毛蕊異黃酮苷、芒柄花苷提取
將樣品用甲醇回流提取4 h,過濾。提取物減壓過濾濃縮至干,體積分數為50%甲醇溶解定容。
1.4.8.4 總多糖提取
稱取20 g樣品,加入7倍蒸餾水浸泡1 h,沸水煮45 min,過濾,重復提取1次,合并濾液,減壓蒸干,蒸餾水定容。
1.4.8.5 胞外多糖提取
將發酵液過濾后濾液加入3倍體積95%乙醇沉淀24 h,4 000 r/min離心20 min,沉淀60 ℃恒溫干燥至恒重,即為胞外粗多糖,蒸餾水定容至50 mL。
1.4.8.6 胞內多糖提取
取菌絲體干粉,以1∶10加蒸餾水,90 ℃水浴加熱3 h,提取2次,減壓過濾并收集濾液。60 ℃減壓濃縮,濃縮液加4倍無水乙醇沉淀24 h,4 000 r/min
離心20min,即為胞內粗多糖,蒸餾水定容至50 mL。
1.4.9 測定方法
總皂苷、總黃酮、總酚酸、總多糖的測定方法分別采用濃硫酸/香草醛法、硼氫化鈉四氯苯醌法、福林酚法、硫酸/苯酚法。其中總皂苷測定標準品選用黃芪甲苷[13],總黃酮測定標準品選用槲皮素[14-15],總酚酸測定標準品選用沒食子酸[16],總多糖測定標準品選用葡萄糖[17],毛蕊異黃酮葡萄糖苷、芒柄花苷的測定方法采用高效液相色譜法[18]。
1.4.10 數據處理
用SPSS Statistics 17.0進行單因素方差分析,用Duncan’s多重比較,檢驗各個處理數據間的差異顯著性。
2 結果與分析
2.1 黃芪水提物的制備
黃芪水提物呈淡黃色,粉末質地均勻,有黃芪味,極易潮,須密封干燥保存,質量為32.09±1.56 g,得率為32.09%。
2.2 黃芪水提物、黃芪和黃芪下腳料成分含量測定
黃芪水提物、黃芪和黃芪下腳料的總多糖、總酚酸、總黃酮、總皂苷測定見表1。由表1可知,三者中均含有總多糖、總酚酸、總黃酮、總皂苷、毛蕊異黃酮葡萄糖苷和芒柄花苷。對于黃芪和黃芪水提物來說,含量上從大到小依次為總多糖、總皂苷、總黃酮、總酚酸、毛蕊異黃酮葡萄糖苷和芒柄花苷。而黃芪下腳料中含量上從大到小依次為總多糖、總黃酮、總皂苷、總酚酸、毛蕊異黃酮苷和芒柄花苷。由黃芪與黃芪下腳料成分含量倍數關系可知,黃芪中多糖含量是黃芪下腳料的3.91倍,黃芪中毛蕊異黃酮苷和芒柄花苷含量是黃芪下腳料的5.24倍和5.21倍,黃芪中總皂苷含量和總酚酸含量是黃芪下腳料中的2.05倍和1.89倍,黃芪與黃芪下腳料中的總黃酮含量差距最小,為1.77倍。
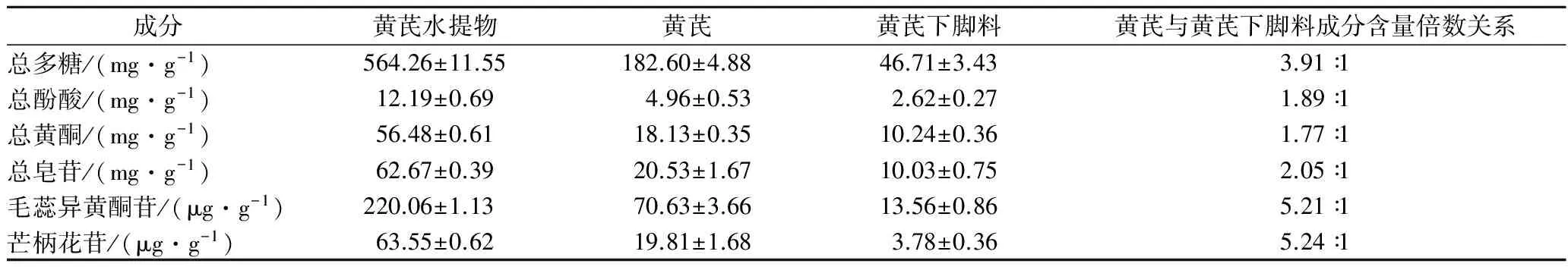
表1 黃芪水提物、黃芪和黃芪下腳料中各物質含量Table 1 The content of Astragalus aqueous extract, Astragalus and Astragalus waste material
毛蕊異黃酮苷、芒柄花苷的高效液相色譜測定結果見圖1,可見在該色譜條件下毛蕊異黃酮苷和芒柄花苷在色譜柱中分離的很好,毛蕊異黃酮苷和芒柄花苷的出峰時間分別為(17.53±0.09)和(32.61±0.04)min,經考察,標準曲線的線性關系、實驗的精密度、準確性、重現性和回收率良好,實驗結果具有可參考性。
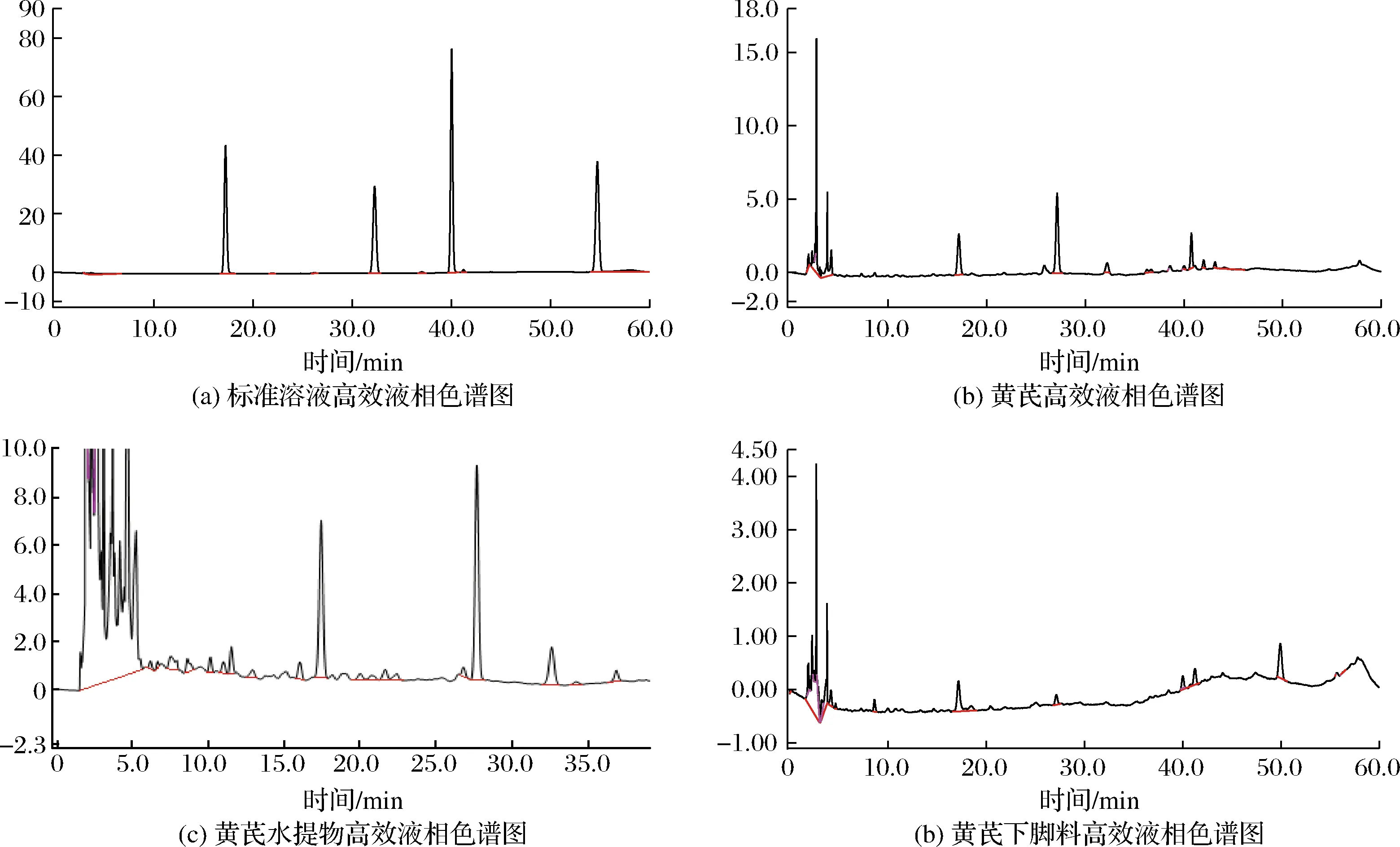
A-標準溶液高效液相色譜圖;B-黃芪高效液相色譜圖;C-黃芪水提物高效液相色譜圖;D-黃芪下腳料高效液相色譜圖圖1 高效液相色譜圖Fig.1 High performance liquid chromatography
2.3 添加黃芪水提物的香菇菌絲體在掃描電子顯微鏡下的形態
培養基中添加黃芪水提物的香菇菌絲以及不添加黃芪水提物的香菇菌絲在掃描電子顯微鏡的形態見圖2。

圖2 添加黃芪水提物后香菇菌絲體在掃描電子顯微鏡下的照片Fig.2 Photos of Lentinus edodes after adding Astragalus aqueous extract under scanning electron microscopy注:其中圖①、②為未添加黃芪添加水提物(1k倍、5k倍);圖②、④為添加濃度為3 g/100 mL的黃芪水提物(1k倍、5k倍)。
從放大1k倍的電鏡圖像上可以看到添加3 g/100 mL的黃芪水提物后香菇菌絲的密度遠遠小于未添加黃芪水提物的香菇菌絲密度。從放大5k倍的電鏡圖像上可以看到添加黃芪水提物后香菇菌絲在最粗處達3.13 μm,最細處為746 nm。而未添加黃芪水提物的香菇菌絲在最粗處為2.80 μm,最細處為508 nm。添加黃芪水提物實驗組中的香菇菌絲形態飽滿,對照組中的菌絲形態略微干癟。說明添加高濃度的黃芪水提物能夠明顯影響香菇菌絲生長狀況,黃芪水提物雖然能抑制香菇菌絲致密生長,但菌絲會比對照組更為粗壯飽滿。
2.4 香菇深層發酵添加黃芪水提物的量的確定
圖3為接種6 d后香菇菌絲體在含不同濃度黃芪水提物培養基上的生長狀況,可以看出隨著黃芪水提物濃度的增加,對香菇菌絲體的生長產生抑制作用,且黃芪水提物濃度越大抑制越明顯。圖4為黃芪水提物添加濃度對香菇菌絲體生長抑制情況及日生長情況的關系曲線,經SPSS方差分析,不影響香菇菌絲體生長的最大黃芪水提物添加量為0.5 g/100 mL,因此本實驗選取添加濃度為0.5 g/100 mL黃芪水提物作為深層發酵實驗組的添加濃度,這樣既不影響香菇菌絲體的生長,又能使黃芪水提物中的物質在香菇菌絲體中的含量盡可能達到最大,對后續栽培實驗的添加量提供依據。

圖3 接種6 d后香菇菌絲體在含不同濃度黃芪水提物的培養基上的生長狀況Fig.3 Appearance of mushroom mycelia in different concentrations of Astragalus aqueous extract inoculated six days later
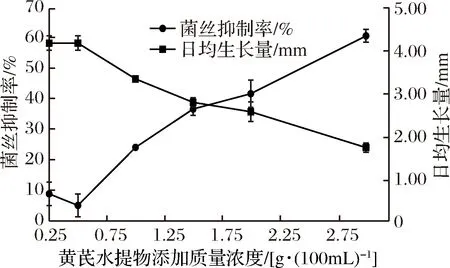
圖4 黃芪水提物添加濃度對香菇菌絲體生長抑制情況的關系曲線Fig.4 Curve of the inhibitory effect of the extract concentration of Astragalus on mycelial growth of Lentinula edodes
2.5 液體發酵后菌球形態的特征比較
培養7 d后,將液體發酵后的錐形瓶從恒溫振蕩培養箱中取出,香菇菌球的生長狀況如圖5所示。
從圖5可以觀察出發酵液的顏色基本相同,對照組和添加黃芪水提物培養的香菇菌球大小均勻,長勢良好。添加黃芪水提物培養的香菇菌球數目明顯多于未添加組。
由表2可以看出,添加黃芪水提物香菇的液體發酵在菌球密度大于未添加對照組,為67.33±4.04個/mL,對照組為54.00±4.36 個/mL。添加黃芪水提物組的菌球平均直徑遠小于對照組,說明菌球長勢良好,相對表面積大,有利于與外界進行物質交換。香菇菌絲體干重添加黃芪水提物組則與對照組相近。說明該黃芪水提物濃度下對香菇進行深層發酵不對香菇菌絲體的生長產生抑制。添加黃芪水提物組的菌球接回PDA培養基后的萌發時間較對照組短,為12.83±0.29 h。接回PDA培養基后,添加黃芪水提物組的菌絲平均生長速度快于未添加對照組,但結果不顯著。
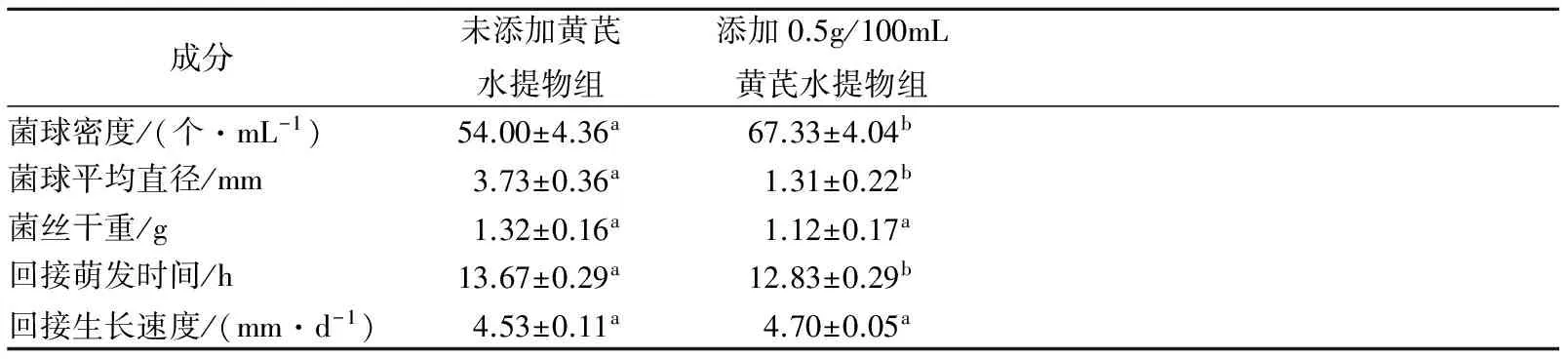
表2 添加黃芪水提物對香菇液體發酵菌球形態的影響Table 2 Effect of aqueous extract of Astragalus ondeep fermentation of Lentinula edodes
注:同行小寫字母表示0.05顯著水平。
2.6 菌絲體中成分含量測定
通過對液體發酵后的香菇菌絲體的胞內多糖、胞外多糖、總酚酸、總黃酮、總皂苷、毛蕊異黃酮葡萄糖苷和芒柄花苷進行含量測定,得到表3。
從表3可以看出在添加黃芪水提物后,香菇菌絲體中的胞外多糖、胞內多糖、總酚酸、總黃酮和總皂苷在含量上較對照組香菇菌絲體均有增加。其中總皂苷的轉化率最高,達13.56%,說明黃芪水提物對香菇液體發酵在胞內多糖和總酚酸成分上造成的影響較大;胞內多糖和總酚酸的轉化率相近,均在3%以下,說明黃芪水提物對香菇深層發酵在胞內多糖和總酚酸成分影響較小;總黃酮的轉化率最低,為0.17%,說明黃芪中的黃酮成分對香菇菌絲體的影響很小,基本可以忽略不計。此外,黃芪中特有的毛蕊異黃酮苷在添加黃芪水提物的實驗組被檢測到,說明香菇菌絲將黃芪水提物中的毛蕊異黃酮苷進行了轉化,轉化率為0.69%,而在添加黃芪水提物的實驗組中未檢測到香菇菌絲中含有芒柄花苷,說明香菇菌絲在生長過程中對芒柄花苷沒有轉化。

表3 香菇液體發酵后菌絲體成分含量測定Table 3 Content of mycelium of Lentinula edodesafter deep fermentation
注:同行小寫字母表示0.05顯著水平。
2.7 香菇栽培添加黃芪下腳料最大量的確定
黃芪下腳料添加量依次為0%、5%、10%、15%、20%、25%,隨著黃芪下腳料添加量的增大,相應香菇菌絲的生長速度變緩。圖6為菌絲體長滿試管至試管底部所用的時間及菌絲平均每日向下生長的距離,經SPSS分析,與不添加下腳料對照組生長狀況大致相同,不顯著影響香菇菌絲的生長。因此后續的田間栽培實驗中添加黃芪下腳料的比例選擇為5%。

圖6 添加黃芪下腳料對香菇菌絲生長的影響Fig.6 The effect of adding Astragalus waste on the growth of mycelia of Lentinus edodes
2.8 香菇子實體中成分含量測定
在栽培料中添加5%的黃芪下腳料后,培育出的香菇子實體產量與對照大體相近,但個頭略小,氣味更濃,口感更細膩。經測定,由表4可知,栽培料中添加黃芪下腳料培育出的香菇子實體中的總多糖、總酚酸、總黃酮和總皂苷含量都有不同程度的提高,黃芪特征組分毛蕊異黃酮苷也被檢測出,芒柄花苷未被檢出。從轉化率來看,香菇對黃芪下腳料中的總多糖含量轉化最多,為29.43%,說明黃芪下腳料中的糖分可以被充分吸收并轉化,且相對于香菇菌絲體來講,香菇子實體對多糖的轉化率更高;其次為總皂苷和總酚酸,轉化率分別為9.09%和6.26%;總黃酮轉化率為0.63%,說明黃酮含量轉化較少;出現于香菇子實體中的黃芪成分毛蕊異黃酮苷的轉化率為2.54%。
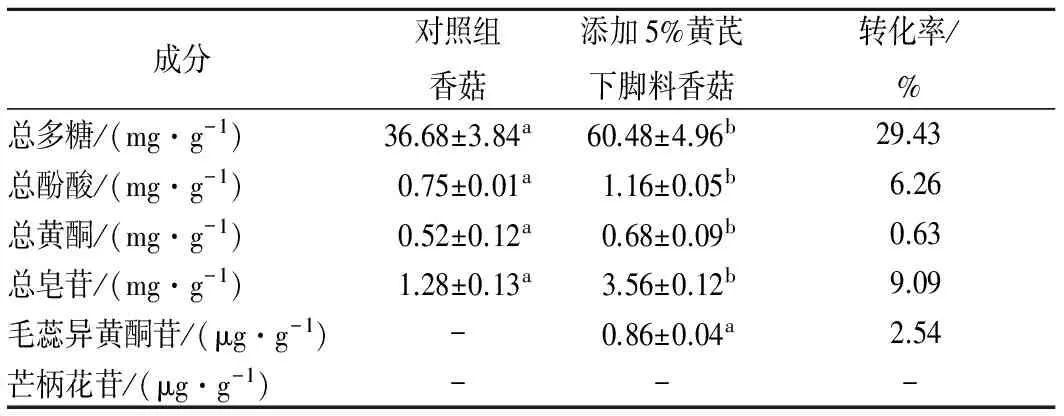
表4 香菇子實體中成分含量測定Table 4 Content of fruiting bodies of Lentinula edodes
注:同行小寫字母表示0.05顯著水平。
3 結論與討論
從物種分類角度看蘑菇與植物分屬兩大不同的界,但兩者合成代謝途徑中的一些關鍵酶和分子調控機制是相似的。基于此,國內外學者將藥用植物應用于誘導大型食用真菌次生代謝產物積累的研究與實踐,取得了重要進展[19-22]。
黃芪主根用來做藥材, 黃芪下腳料(包括黃芪莖枝、側根、根須以及無法做優良藥材的較短的主根)燒之可惜。黃芪下腳料中的總皂苷、總黃酮、總酚酸、總多糖、毛蕊異黃酮葡萄糖苷和芒柄花苷含量分別為46.71 mg/g、2.62 mg/g、10.24 mg/g、10.03 mg/g、13.56 μg/g、3.78 μg/g,與黃芪藥材相比成分相差倍數分別為3.91、1.89、1.77、2.05、5.21、5.24。這表明黃芪下腳料作為藥用栽培植物廢棄物,在食用真菌栽培基料中應用可以變廢為寶。
培養基中添加黃芪水提物0.5 g/100 mL以上時會出現抑制生長,添加0.5 g/100 mL時生長正常,在添加0.5 g/100 mL黃芪水提物而獲得的香菇菌絲體中,胞內多糖、總酚酸、總黃酮、總皂苷、毛蕊異黃酮葡萄糖苷的含量分別為52.52 mg/g、0.97 mg/g、0.35 mg/g、11.11 mg/g、1.09 μg/g,轉化率分別為1.08%、2.20%、0.17%、13.56%、0.69%,都較對照組有所提高,說明香菇菌絲在生長時對黃芪中的一些成分進行了轉化。例如冮潔等[23]對羊肚菌富硒做了研究。WU等[24]利用藤茶培養茯苓后對其中的酚酸黃酮成分進行了測定。
利用黃芪下腳料栽培培育新型香菇子實體是可行的。在田間栽培添加黃芪下腳料收獲的香菇子實體中多糖、總酚酸、總黃酮、總皂苷、毛蕊異黃酮葡萄糖苷的含量分別為60.48 mg/g、1.16 mg/g、0.68 mg/g、3.56 mg/g、0.86 μg/g,轉化率分別為29.43%、6.26%、0.63%、9.09%、2.54%。由于代謝途徑中關鍵酶的制約,并不是黃芪中所有特征物質均可以在香菇中轉化,如芒柄花苷就未被檢出。例如在添加核桃殼之后平菇子實體中的多糖和粗纖維含量都有了顯著增加[25]。相信未來利用黃芪下腳料栽培的新型香菇有著廣闊的市場和前景。
[1] 張薔,高文遠,滿淑麗,等.黃芪中有效成分藥理活性的研究進展[J].中國中藥雜志,2012,37(21):3 203-3 207.
[2] XU X L, JI H, GU S Y, et al. Modification of alterations in cardiac function and sarcoplasmic reticulum by astragaloside IV in myocardial injuryinvivo[J]. Eur J Pharmacol,2007,568(1-3): 203-212.
[3] XU X L, CHEN X J, JI H, et al. Astragaloside IV improved intracellular calcium handling in hypoxia-reoxygenated cardiomyocytes via the sarcoplasmic reticulum Ca-ATPase[J]. Pharmacology,2008,81(4): 325-332.
[4] WANG Y P, LI X Y, SONG C Q, et al. Effect of astragaloside IV on T,B lymphocyte proliferation and peritoneal macrophage function in mice[J]. Acta Pharmacol Sin,2002, 23(3): 263-266.
[5] WANG S, LI J, HUANG H, et al. Anti-hepatitis B virus activities of astragaloside IV isolated from Radix Astragali[J]. Biol Pharm Bull,2009,32(1): 132-135.
[6] 孫成文, 江巖, 鐘國贛,等. 黃芪多糖抗氧化損傷作用的研究[J]. 中國藥理學通報, 1996(2):161-163.
[7] 高觀世,張陶,吳素蕊,等.食用菌蛋白質評價及品種間氨基酸互補性分析[J].中國食用菌,2012,31(1):35-38.
[8] 李月梅. 香菇產業具有良好的發展前景[J]. 食品科學, 2005, 26(7):261-266.
[9] 蘭良程.中國食用菌產業現狀與發展[J].中國農學通報,2009,25(5):205-208.
[10] 王新風.富硒食用菌栽培技術[J].中國食用菌,2002,21(3):13-15.
[11] 姚自奇,蘭進.杏鮑菇研究進展[J].食用菌學報,2004,11(1):52-58.
[12] 姜寶財.食用菌栽培技術研究進展[J].中國農業信息,2015(18):91-92.
[13] 韓魯佳,閻巧娟,江正強,等.黃芪多糖及皂苷提取工藝研究[J].農業工程學報,2000,16(5):118-121.
[14] HE X J, LIU D, LIU R H. Sodium borohydride/chloranil-based assay for quantifying total flavonoids[J]. J Agric Food Chem, 2008,56(20):9 337-9 344.
[15] 單璐.不同加工方式小米營養成分的變化[D].太原:山西大學,2016.
[16] 付煜榮,張萬明,陳桂敏,等.景天三七中沒食子酸和總酚酸含量測定[J].中成藥,2006,28(7):1 016-1 018.
[17] 楊曉華,于廣利,趙峽,等.灰樹花糖蛋白中總糖含量的測定[J].中國海洋大學學報(自然科學版),2006,36(6):929-931.
[18] 梁麗娟,趙奎君,屠鵬飛,等.HPLC法同時測定黃芪中4種黃酮類成分的含量[J].中國藥房,2010,21(15):1 385-1 387.
[19] 柴月明.利用黃芪和甘草莖葉栽培雞腿菇技術[J].甘肅農業科技,2011(10):60-61.
[20] 佘紅,岳文輝,方建龍,等.中藥藥渣栽培金針菇試驗[J].食用菌,2006(6):29-29.
[21] 汪濤,王曉玲,趙舒武,等.中藥廢渣在食用菌培養中的生物轉化再利用研究[J].中華中醫藥學刊,2008,26(4):871-872.
[22] SONG H B, LEE H S. Changes of ginsenoside content by mushroom mycelial fermentation in red ginseng extract[J]. J Ginseng Res, 2011,35(2): 235-242.
[23] 冮潔,麥海美,解彬,等.羊肚菌菌絲體富硒條件優化及其硒多糖抗氧化活性研究[J].食品與發酵工業,2016,42(9):120-125.
[24] WU J, WANG C H. Biotransformation of vine tea (Ampelopsisgrossedentata) by solid-state fermentation using medicinal fungusPoriacocos[J]. J Food Sci Technol,2016,53(8):3 225-3 232.
[25] 朱曉琴.以核桃殼為原料栽培食用菌的研究[D].昆明:西南林學院,2008.

