未成熟粒細胞在新生兒細菌性感染疾病診斷中的應用價值
馬 科,張婭娟,李 潔,馮 博,詹明華
(河北北方學院 a.附屬第一醫院檢驗科; b.附屬第一醫院醫務處, 河北 張家口 075000)
新生兒細菌性感染是臨床常見疾病,新生兒受細菌微生物感染引起炎癥反應,患兒可表現出發熱、腹瀉、肺炎、尿路感染等多種病癥,病情嚴重極易引發早期膿毒癥(early-onset sepsis,EOS),導致新生兒發病率、死亡率升高[1-4]。目前膿毒癥(sepsis)診斷的金標準為血培養,但血培養方法受諸多因素限制臨床診斷陽性率低,檢驗耗時長不能快速發出檢驗報告。研究表明,低出生體重的膿毒癥患兒血培養陽性率僅為1.9%,早產或經抗生素治療后的患兒血培養常出現錯誤的陰性結果[5-6]。同時新生兒自身血容量少,多次進行血培養檢驗會造成患兒失血過多,加重病情發展并引發其他病癥。雖然臨床已開展中性桿狀核粒細胞計數(Band)、血漿降鈣素原(PCT)、白細胞介素6(IL-6)、C反應蛋白(CRP)等多種檢測項目,對于膿毒癥的早期診斷和監測依然缺乏有效的實驗室檢測指標。
白細胞計數及分類檢測為新生兒常規檢測項目,在新生兒感染、膿毒癥疾病診斷中發揮著重要作用。白細胞通過調理吞噬作用清除體內外來入侵的病原微生物,感染、膿毒癥可引起人體多個器官機能障礙并影響白細胞的吞噬作用,致使白細胞吞噬作用表現為增強、無變化或耐受,導致外周血中白細胞數量為升高、正常、甚至減低多種變化,使膿毒癥早期診斷治療面臨巨大挑戰[7-8]。近期研究發現,檢測血液中未成熟粒細胞(immature granulocyte,IG)在炎癥、感染疾病的診斷中具有預示作用。正常健康人外周血中未成熟粒細胞(早幼粒細胞、中幼粒細胞、晚幼粒細胞)含量極低,人體受到病原微生物入侵時機體反應性釋放未成熟粒細胞進入外周血中。Emily L.Wiland等研究表明,成人和兒童靜脈血中未成熟粒細胞占白細胞總數比通常小于1%,在以往研究中發現,成人未成熟粒細胞(IG#、IG%)的正常參考值范圍分別為:0~0.06(109/L),0~0.8%,新生兒未成熟粒細胞正常參考值范圍未見報道[9-11]。本研究應用Sysmex XN-2000全自動血細胞分析儀檢測新生兒外周血未成熟粒細胞含量(IG#)及百分比(IG%),通過研究探討成人未成熟粒細胞正常參考值是否適用于新生兒,并分析未成熟粒細胞在新生兒細菌性感染疾病診斷中的作用,豐富實驗室的檢測方法,為進一步深入研究膿毒癥早期診斷提供檢驗依據。
1 檢測方法
1.1 一般資料
選取2017年1月至2017年6月間在河北北方學院附屬第一醫院出生的新生兒93例,所有新生兒胎齡≥37周,其中非感染新生兒50例為非感染組,非感染新生兒為超過預產期出生的嬰兒或低出生體重兒,其中男26例,女24例;根據臨床癥狀及實驗室檢查并由臨床醫生確診的細菌性感染新生兒43例為感染組,其中男21例,女22例。新生兒家屬對研究檢測的項目知情同意,符合本院醫學倫理委員會標準。
1.2 儀器和試劑
檢測白細胞(WBC)、未成熟粒細胞(IG#、IG%)選用Sysmex XN-2000全自動血細胞分析及原廠配套生產試劑、質控品;檢測血漿降鈣素原(PCT)選用北京熱景生物技術有限公司生產的UPT上轉發光免疫分析儀及配套試劑、質控品;檢測C反應蛋白(CRP)含量選用上海奧普生物醫藥有限公司生產的Ottoman C反應蛋白檢測分析儀及配套試劑、質控品。
1.3 標本采集與檢測
新生兒出生48 h內采集血液標本,抽取2 mL靜脈血液標本置于EDTA-K2抗凝管中檢測白細胞(WBC)、未成熟粒細胞(IG#、IG%)和C反應蛋白(CRP)含量,抽取2ml靜脈血液標本置于肝素鋰抗凝管中檢測血漿降鈣素原(PCT),標本采集后2 h內完成檢測。
1.4 檢測未成熟粒細胞在新生兒細菌性感染疾病診斷中的作用
選取非感染新生兒和細菌性感染新生兒檢測的白細胞(WBC)、未成熟粒細胞(IG#、IG%)、血漿降鈣素原(PCT)和C反應蛋白(CRP)數據進行分析,WBC、PCT、CRP參數數據使用獨立樣本t檢驗分析,IG#和IG%參數數據使用非參數檢驗(kruskal-wallis H檢驗)分析,比較非感染新生兒和細菌性感染新生兒之間檢測指標差異。運用受試者工作特征曲線(receiver operating characteristic curve,ROC曲線),計算IG#和IG%參數的曲線下面積(AUC),并分析檢測IG#和IG%診斷新生兒細菌性感染的靈敏度、特異性、約登指數等指標,探討檢測未成熟粒細胞在新生兒細菌性感染診斷中的應用價值,分析成人未成熟粒細胞正常參考值是否適用于新生兒,為進一步深入研究提供依據。
1.5 數據整理與統計學處理

2 檢測結果
感染組和非感染組新生兒血液IG#、IG%、WBC、PCT和CRP水平比較:細菌性感染新生兒血液中WBC、PCT含量均顯著高于非感染新生兒(P<0.01),IG#、IG%和CRP含量亦高于非感染新生兒(P<0.05),如表1所示。感染組43例血液標本檢測的IG#、IG%范圍分別為0.01~0.90(109/L)和0.2%~5.7%,四分位數為0.20[0.08,0.50](109/L)和1.3[0.7,3.2]%,非感染組50例血液標本檢測的IG#、IG%范圍分別為0.00~0.23(109/L)和 0.0%~1.9%,四分位數為0.05[0.02,0.11](109/L)和0.5[0.3,1.0]%,如圖1所示。非感染組新生兒血液標本IG#含量超過0.06(109/L)的比值為44%,IG%超過0.8%的比值為40%。
對感染組和非感染組新生兒血液IG#、IG%進行受試者工作特征曲線分析,得出曲線下面積(area under the curve,AUC)分別為0.746、0.738,當IG#和IG%參數cut-off值為0.12、1.15時,敏感度為0.70、0.63,特異性為0.78、0.84,約登指數為0.48、0.47,陽性似然比為3.18、3.94,陰性似然比為0.38、0.44,如表2、圖2所示。

表1 非感染新生兒和細菌性感染新生兒檢測指標
a) 與非感染組比較,P<0.01; b)與非感染組比較,P<0.05
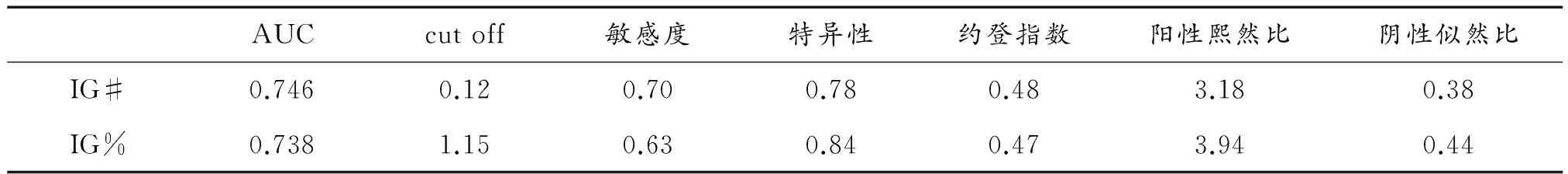
表2 未成熟粒細胞IG#及IG%參數值
3 分析
細菌感染已成為新生兒重癥監護室患兒發病率和死亡率升高的重要原因,尤其是對早期膿毒癥(EOS)的診斷,由于現有的實驗室檢測存在診斷陽性率低、特異性不高、檢驗耗時較長等因素限制,為臨床膿毒癥的診斷及后期治療帶來了不便。本研究選用Sysmex XN-2000全自動血細胞分析儀檢測新生兒外周血未成熟粒細胞含量(IG#)及百分比(IG%),同時檢測白細胞計數(WBC)、C反應蛋白(CRP)和血漿降鈣素原(PCT)炎癥檢測項目進行比較,對未成熟粒細胞(IG#、IG%)作為新的炎癥檢測指標在新生兒細菌性感染診斷中發揮的作用進行分析。未成熟粒細胞(immature granulocytes,IG)包含早幼粒細胞(promyelocytes)、中幼粒細胞(myelocytes)和晚幼粒細胞(metamyelocytes),Sysmex XN-2000全自動血細胞分析儀依據幼稚細胞膜表面含有的脂質成分較少,同時細胞核內核酸含量高的特性,可選擇性的區分未成熟粒細胞和成熟細胞,通過檢測血液中細胞的前向散射光(FSC)、側向散射光(SSC)、側向熒光(SFL)等參數來準確計數未成熟粒細胞含量[12-15]。
感染組43例血液標本檢測的IG#、IG%范圍分別為0.01~0.90(109/L)和 0.2%~5.7%,四分位數為0.20[0.08,0.50](109/L)和1.3[0.7,3.2]%,非感染組50例血液標本檢測的IG#、IG%范圍分別為0.00~0.23(109/L)和 0.0%~1.9%,四分位數為0.05[0.02,0.11](109/L)和0.5[0.3,1.0]%。應用ROC曲線評價檢測未成熟粒細胞(IG#、IG%)在新生兒細菌性感染疾病診斷中的作用,曲線下面積(AUC)分別為0.746、0.738,敏感度為0.70、0.63,特異性為0.78、0.84,約登指數為0.48、0.47,陽性似然比為3.18、3.94,陰性似然比為0.38、0.44,表明未成熟粒細胞(IG#、IG%)作為炎癥指標診斷新生兒細菌性感染疾病的敏感性、特異性較高。從非感染新生兒和細菌性感染新生兒血液中IG含量分布比較可知,非感染組新生兒血液標本IG#含量超過0.06(109/L)的比值為44%,IG%超過0.8%的比值為40%,推測成人未成熟粒細胞(IG#、IG%)的正常參考值范圍[IG#:0~0.06(109/L),IG%:0~0.8%]不適用于新生兒。由于受研究中檢測標本數量的限制,還需要今后增加檢測病例數量,確立新生兒未成熟粒細胞的正常參考值。
4 結論
細菌性感染新生兒血液中未成熟粒細胞含量顯著高于未感染新生兒,成人未成熟粒細胞的正常參考值不適用于新生兒,檢測未成熟粒細胞可用于新生兒細菌性感染疾病的診斷。
:
[1] HEDEGAARD S S,WISBORG K,HVAS A M.Diagnostic utility of biomarkers for neonatal sepsis——a systematic review [J].Infect Dis (Lond),2015,47(3):117-124.
[2] SIMONSEN KA,ANDERSON-BERRY A L,DELAIR S F,et al.Early-onset neonatal sepsis[J].ClinMicrobiol Rev.,2014,27(1):21-47.
[3] EYESUS G T,MOGES F,ESHETIE S,et al.Bacterial etiologic agents causing neonatal sepsis and associated risk factors in Gondar,Northwest Ethiopia[J].BMC Pediatr,2017,17(1):137.
[4] ROEHRL M H,LANTZ D,SYLVESTER C,et al.Age-dependent reference ranges for automated assessment of immature granulocytes and clinical significance in an outpatient setting[J].Arch Pathol Lab Med.,2011,135(4):471-477.
[5] HORNIK C P,BENJAMIN D K,BECKER K C,et al.Use of the complete blood cell count in early-onset neonatal sepsis[J].Pediatr Infect Dis J.,2012,31(8):799-802.
[6] NEWMAN T B,PUOPOLO K M,WI S,et al.Interpreting complete blood counts soon after birth in newborns at risk for sepsis[J].Pediatrics,2010,126(5):903-909.
[7] WIRBELAUER J,THOMAS W,RIEGER L,et al.Intrauterine growth retardation in preterm infants ≤32 weeks of gestation is associated with low white blood cell counts[J].Am J Perinatol,2010,27(10):819-824.
[8] BERNSTEIN L H,RUCINSKI J.Measurement of granulocyte maturation may improve the early diagnosis of the septic state[J].ClinChem Lab Med.,2011,49(12):2089-2095.
[9] WILAND E L,SANDHAUS L M,GEORGIEVSKAYA Z,et al.Adult and child automated immature granulocyte norms are inappropriate for evaluating early-onset sepsis in newborns[J].ActaPaediatr,2014,103(5):494-497.
[10]JYOTHI P,BASAVARAJ M C,BASAVARAJ P V.Bacteriological profile of neonatal septicemia and antibiotic susceptibility pattern of the isolates[J].J Nat SciBiol Med.,2013,4(2):306-309.
[11]馬科,左路廣,馮博,等.成人外周血未成熟粒細胞正常參考值的建立與臨床應用[J].廣東醫學,2017,38(21):3280-3282.
[12]HA S O,PARK S H,PARK S H,et al.Fraction of immature granulocytes reflects severity but not mortality in sepsis[J].Scand J Clin Lab Invest,2015,75(1):36-43.
[13]PRO C I,YEALY D M,KELLUM J A,et al.A randomized trial of protocol-based care for early septic shock[J].N Engl J Med.,2014,370(18):1683-1693.
[14]KIM H,HUR M,CHOI S G,et al.Performance evaluation of Sysmex XN hematology analyzer in umbilical cord blood:a comparison study with Sysmex XE-2100[J].ClinChem Lab Med.,2014,52(12):1771-1779.
[15]OEHADIAN A,MICHELS M,DE MAST Q,et al.New parameters available on Sysmex XE-5000 hematology analyzers contribute to differentiating dengue from leptospirosis and enteric fever[J].Int J Lab Hematol,2015,37(6):861-868.

