蛋白質組學技術的合理運用于食管癌治療的雙盲性臨床價值
楊 宏 周 俊 郝婷婷 劉修莉
食管癌是原發于食道的惡性腫瘤,以鱗狀上皮癌最為多見,癌前病變具有雙向發展的不穩定性生物學特征[1],但由于早期癥狀的不明顯,確診時候已經到達了中晚期的程度。西妥昔單抗作為蛋白質組學技術的新興產物,是一種人/鼠嵌合型IgG單克隆抗體[2],通過特異性結合于表皮生長因子(EGF),從而阻止配體與其結合而阻斷受體二聚化和信號傳導來抑制腫瘤的增殖、轉移,促進腫瘤細胞衰亡,已在臨床取得卓越的效果。本文通過對比觀察滴注西妥昔單抗和順鉑治療后的緩解率以及血清指標,希望可以提供有用的臨床價值。
1 材料與方法
1.1 臨床資料
選取2016年4月到2016年10月我院收治的且經過臨床病理檢查證實且需要接受治療的33例食管癌患者,男性23例,女性10例,年齡38~62歲,平均年齡(52.63±2.5)歲,10例患者腫瘤僅浸潤淺層肌、黏膜層或黏膜下層,12例患者腫瘤浸潤固有肌層,11例患者腫瘤浸潤纖維膜;患者中出現淋巴結轉移18例,無淋巴結轉移15例;病理分級:低分化型10例,中分化型14例,高分化型9例;病理分期按照國際TNM臨床分期[3]:Ⅰ期10例,Ⅱ期14例,Ⅲ期9例。按1∶2的比例將患者隨機分配至順鉑治療對照組和西妥昔單抗治療試驗組。對照組11例,男性5例、女性6例,平均年齡(51.23±4.2)歲;病理分期:Ⅰ期4例,Ⅱ期5例,Ⅲ期2例。試驗組22例,男性18例、女性4例,平均年齡(55.17±2.4)歲;Ⅰ期6例,Ⅱ期9例,Ⅲ期7例。2組患者的基本資料經過統計學處理,無明顯差異,具有可比性。該實驗已征得我院倫理協會同意,患者及家屬知情同意并簽字。
1.1.1 納入標準 經過病理檢查確診患有食管癌,KPS評分≥60分,預計生存時間≥5個月,病理分期Ⅰ期~Ⅲ期,依從性高,有可評估和和可測量病灶,肝腎功能以及骨髓儲備正常,可隨訪,同意隨機分組,簽訂正式知情同意書的患者。
1.1.2 排除標準 有且僅有不可測量病灶,食管多中心病變,無自知力腦轉移患者,依從性差,患有第二原發惡性腫瘤并未愈合者,具有嚴重無法控制的內科疾病,肝腎功能異常者,已進行過手術或放療,懷孕期或泌乳期,無法簽訂正式知情同意書的患者。
1.2 研究方法
根據雙盲實驗分組法則按1∶2的比例隨機分為2組:順鉑聯合5-fu治療組(對照組11例),西妥昔單抗治療組(22例),2組均治療3周。2組患者治療前后均接受模擬CT和食管鋇餐X片;并于治療前和治療后5天空腹狀態下采血,分離血清測定CYFRA21-1和SCC,并觀察分析2組數據。
1.3 治療方法
對照組給予順鉑30 mg/m22 h,d1,5-fu 500 mg/m2,靜脈推注d1~d5,21 d為1個周期[4]。
試驗組給予西妥昔單抗400 mg/m2(靜脈滴注120 min),其后每周給藥250 mg/m2,每次給藥前常規給予西咪替丁0.4 g靜脈滴注或非那根25 mg肌肉注射,地塞米松5 mg靜脈滴注以預防過敏反應[5]。
1.4 檢查方法
本組病例各項檢查采用雙盲法,即EUS檢查者、治療者、病理檢查者均獨立操作并做出診斷以保持客觀性。患者于治療前后空腹采血后測量血清SCC并通過微粒子酶聯免疫測定法測定治療前后的數據,治療前后空腹采血后測量CYFRA21-1并采用羅氏電化學發光免疫分析法[6]分析治療前后的數值。使用低溫醫用熱塑記憶體膜固定體位后在增強掃描和定位時使用模擬CT以5 mm層厚連續掃描由下頜至肝部上緣并配合食管鋇餐正側點位X光片分別測出腫瘤的直短徑以及腫瘤基線,以直短徑的乘積確定腫瘤體積的大小。
1.5 觀察指標
根據WHO的實體腫瘤客觀療效標準評價西醫療效[7]:對比分析2組的影像學報告判斷腫瘤的體積大小、邊界和是否出現周圍浸潤和淋巴結轉移以及遠端轉移,檢測治療前后血清SCC以及CYCYFRA21-1值來觀測治療的具體效果。
1.6 療效標準
參照WHO西醫療效評價標準[8]:通過模擬CT和食管鋇餐X片測定腫瘤直徑和短徑的乘積判斷腫瘤的大小。完全緩解(CR):所有目標病灶消失且維持時時間≥4周;部分緩解(PR):腫瘤直徑可見縮小,且縮小程度≥1/2,維持時間≥4周;無變化(NC);進展(PD):原靶病灶長徑總和增大20%且原靶病灶長徑總和絕對值增大5 mm,或者出現新病灶和淋巴結轉移或遠端轉移;穩定(SD): 基線病灶長徑總和略有縮小但未達到PR或者略有增加但未達PD,且維持時間<4周。
1.7 統計學方法
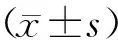
2 結果
2.1 2組西醫療效
西醫療效對照組有效率為45.3%,試驗組54.5%,差異具有統計學意義(P<0.05),見表1。
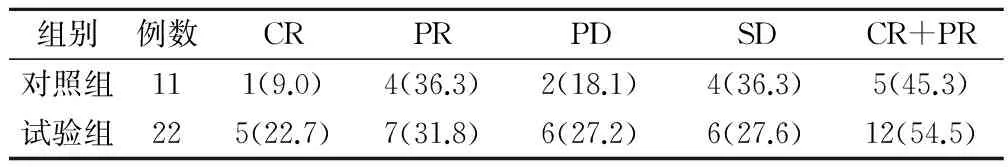
表1 2組西醫療效比較(例,%)
2.2 2組患者治療前后血清SCC和CYFRA21-1均值比較
2組患者在接受治療之后腫瘤標志物在血清中的含量均有所降低,試驗組降低的程度較對照組高,具有統計學意義(P<0.05)。見表2。
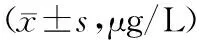
表2 2組患者治療前后SCC和CYFRA21-1變化
2.3 治療后有無淋巴轉移患者的SCC以及CYFRA21-1水平
對照組與試驗組治療后未出現淋巴結轉移者25例。有無淋巴結轉移患者血清SCC、CYFRA21-1水平比較,差異具有統計學意義(P<0.05)。見表3。
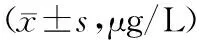
表3 有無淋巴結轉移患者治療后SCC以及CYFRA21-1比較
2.4 不良反應
2組患者出現不同程度的WBC下降、貧血、放射性食管炎、腹瀉、惡心嘔吐、腎功能下降、神經毒性,對照組分別為:27.2%(3/11)、18.8%(2/11)、36.4%(4/11)、45.5(5/11)、36.4%(4/11)、54.5%(6/11)、27.2%(3/11),試驗組分別為:13.6%(3/22)、18.8%(4/22)、22.7%(5/22)、36.4%(8/22)、27.3%(6/22)、45.5%(10/22)、36.4%(8/22),各組間不良反應無統計學意義(P>0.05)。總不良反應發生率對照組為36.4%(4/11),試驗組為27.3%(6/22),差異具有統計學意義(χ2=1.2,P<0.05)。
3 討論
食管癌是我國常見的惡性腫瘤之一,病理類型主要為鱗癌(90%以上),早期癥狀通常不典型,容易被誤診或略診[9],初步診斷為食管癌時已經失去了手術的機會。但隨著醫療技術以及科研人員的不斷探索和發現,人類對疾病的研究已經邁進了分子水平的大門,與之相關的蛋白質組學技術也突飛猛進,這為腫瘤的治愈和提供可靠的治療后評價帶來了新的進展。從本質來看,腫瘤是一種由不同且多種基因共同參與的復雜性極高的疾病但其發生發展和轉歸終究是需要通過蛋白質來實現的,可通過有效地識別、篩查、定位癌癥的特異性表達蛋白,來達到療效快且強,副作用小的目的。Profumo等[10]使用MALDI-TOF質譜分析法發現C3F片段在乳腺癌患者中顯著增高,以此來為檢測初期乳腺癌提供了有力的依據和指標,Chen等[11]利用蛋白質組學技術驗證了識別體蛋白C3為胰腺癌特異性血清標志,殷杰等[12]通過人工合成min-122成熟cDNA序列為肝癌基因沉默治療提供了新的思路。
本研究中使用西妥昔單抗作為實驗藥物和SCC以及CYFRA21-1作為預后評價指標進行實驗,其主要目的是為了能直觀地觀測蛋白質組學技術應用于食管癌的臨床價值。西妥昔單抗直接作用于受體細胞外區的單克隆抗體,可以阻斷腫瘤壞死因子α和EGF(表皮生長因子)與EGFR(表皮生長因子受體)結合,而EGFR為原癌基因的主要表達產物,主要參與癌細胞的增殖、生長、遷移、浸潤與存活。西妥昔單抗與EGFR的親和力為人體內源配體的5~10倍,可以在人體正常細胞以及癌細胞的EGFR的細胞外激酶特異性結合時,競爭性抑制EGFR與其他配體結合,使得受體激酶磷酸化受阻,來實現抑制腫瘤生長、遷移的目的。西妥昔單抗只針對腫瘤的特異性表達蛋白產生靶向作用也使得在治療后出現的不良反應大大減小,在上述的試驗中,實驗組患者治療后的不良反應率遠低于對照組患者。相關研究報道指出蛋白質組學技術在靶向性治療癌癥時候,雖然會出現耐藥性可能,靶向治療耐藥性患者仍可以接受化療,一段時間后原本已經耐藥的靶向藥物,仍然可以發揮作用,這使得癌癥患者的生存期得以很大程度的提升。治療后通過微粒子酶聯免疫測定法測定血清SCC的值得出有淋巴結轉移的患者SCC水平遠高于無淋巴結轉移患者,通過電化學發光免疫分析法分析治療得出有淋巴結轉移患者CYFRA21-1均值遠高于無淋巴結轉移患者,血清SCC和CYFRA21-1的數值可以作為評定治療后療效的有力證據,也可以用來判斷食管癌患者各階段的分期。蛋白質組學技術可以說貫穿了整個治療的始終,也為食管癌的治療提供了新的途徑和方法。
[1] 林稱意,原 野,羅衛民,等.TSLC1和 CD105在食管癌組織中表達的臨床意義〔J〕.實用癌癥雜志,2014,29(3):263-265.
[2] 呂汪霞,馬勝林.西妥昔單抗的臨床研究新進展〔J〕.醫學綜述,2010,16(9):1345-1348.
[3] 周志國,甄嬋軍,梁軍利,等.食管癌AJCC/UICC第6、7版TNM分期分段方法在放療患者中的比較〔J〕.腫瘤防治研究,2015,42(8):772-776.
[4] 劉 芳,杜 瑜.洛鉑或順鉑聯合5-Fu同步放化療治療不能手術的中晚期食管癌的臨床觀察〔J〕.實用癌癥雜志,2016,31(2):212-214.
[5] 陸超敬.西妥昔單抗聯合化療治療EGFR陽性表達中晚期食管癌患者的療效分析〔J〕.中國醫藥指南,2011,9(29):113-114.
[6] 吳正吉,張渝成,徐維鳳.血清腫瘤標志物在食管癌診斷中的運用分析〔J〕.實用癌癥雜志,2014,29(5):503-505.
[7] 樓 靜,洪 亮,余飛龍.晚期消化道腫瘤癌因性疲乏患者應用中醫辨證治療的療效及生活質量改善狀況分析〔J〕.中華中醫藥學刊,2016,24(1):245-247.
[8] 張賀龍.實體瘤療效評價標準及演變〔J〕.現代腫瘤醫學,2010,18(5):839-841.
[9] 文美玲.三維適行放療同步GEMOX方案治療局部晚期食管癌的臨床觀察〔J〕.中南醫學科學雜志,2014,42(3):300-301.
[10] Profumo A,Mangerini R,Rubagotti A,et al.Complement -C3f serum levels may predict breast cancer risk in women with gross cystic disease of the breast〔J〕.J Proteomics,2013,85(5):44-52.
[11] Chen J,Wu W,Tang HK,et al.Analysis of pancreatic cancer peripheral blood by comparative proteomics〔J〕.Zhong hua wai ke za zhi,2013,51(1):62-65.
[12] 殷 杰,楊曉燕,虞 佳,等.miR-122表達載體的構建及其對Bcl-xL,Bcl-2基因的抑制作用〔J〕.中南醫學科學雜志,2013,41(1):13-16.

