1,8-桉油素預(yù)處理對Aβ25~35誘導(dǎo)大鼠皮層神經(jīng)元炎癥反應(yīng)的影響
?
1,8-桉油素預(yù)處理對Aβ25~35誘導(dǎo)大鼠皮層神經(jīng)元炎癥反應(yīng)的影響
第一作者:王琳(1979-),女,碩士,講師,主要從事神經(jīng)及內(nèi)分泌藥理學(xué)研究。
王琳趙春貞
(濰坊醫(yī)學(xué)院藥理學(xué)教研室應(yīng)用藥理學(xué)實(shí)驗(yàn)室,山東濰坊261053)
〔摘要〕目的探討1,8-桉油素預(yù)處理對Aβ(25~35)誘導(dǎo)原代培養(yǎng)大鼠皮層神經(jīng)元炎癥反應(yīng)的影響。方法原代培養(yǎng)大鼠皮層神經(jīng)元,隨機(jī)分組。采用噻唑藍(lán)(MTT)還原反應(yīng)觀察神經(jīng)元損傷;以Aβ(25~35)處理24 h誘導(dǎo)神經(jīng)元損傷;酶聯(lián)免疫吸附法(ELISA)檢測上清液中腫瘤壞死因子(TNF)-α、白介素(IL)-1β及半胱氨酰白三烯(CysLTs)釋放水平。結(jié)果20 μmol/L的Aβ(25~35)處理神經(jīng)元細(xì)胞24 h可顯著降低神經(jīng)元活性,增加TNF-α、IL-1β及CysLTs的釋放,1,8-桉油素10 μmol/L預(yù)處理后可明顯抑制Aβ(25~35)引起的細(xì)胞毒性效應(yīng),并抑制上述炎癥因子及CysLTs的釋放。結(jié)論1,8-桉油素對Aβ(25~35)誘導(dǎo)的神經(jīng)元損傷具有保護(hù)作用,與抑制TNF-α、IL-1β及CysLTs的釋放有關(guān)。
〔關(guān)鍵詞〕1,8-桉油素,阿爾茨海默病,炎癥,細(xì)胞因子
阿爾茨海默病(AD)是一種病因未明的神經(jīng)退行性疾病,以神經(jīng)細(xì)胞之間大量老年斑沉積β淀粉樣蛋白(Aβ)和神經(jīng)細(xì)胞內(nèi)神經(jīng)元纖維纏結(jié)為主要病理學(xué)特征〔1〕。大量研究表明〔2〕,Aβ沉積誘導(dǎo)AD患者腦內(nèi)炎癥的發(fā)生,導(dǎo)致前炎癥因子如腫瘤壞死因子(TNF)-α、白細(xì)胞介素(IL)-1β等的大量釋放,并通過一氧化氮合成酶2或核轉(zhuǎn)錄因子(NF)-κB進(jìn)一步加速炎癥進(jìn)程。TNF-α,IL-6等多種炎癥因子均能通過調(diào)節(jié)γ-分泌酶的活性促進(jìn)Aβ在神經(jīng)元內(nèi)的產(chǎn)生〔3〕。1,8-桉油素是一種從桃金娘科植物藍(lán)桉中提取出的揮發(fā)油的主要活性成分。在人單核細(xì)胞和淋巴細(xì)胞中,它能夠明顯抑制TNF-α和IL-1β等炎癥因子的釋放〔4〕。臨床試驗(yàn)表明,1,8-桉油素能夠減輕哮喘患者的炎癥反應(yīng)〔5〕。然而,它對AD的作用尚不清楚。本實(shí)驗(yàn)采用Aβ25~35誘導(dǎo)原代培養(yǎng)的神經(jīng)元損傷,觀察1,8-桉油素對炎癥反應(yīng)的影響。
1材料與方法
1.1藥物與試劑1,8-桉油素,分子量為154.25 kD,購自美國Sigma公司;DMEM培養(yǎng)基購自美國Hyclone公司;胎牛血清(FBS)購自杭州四季青公司;馬血清購自美國Gibco公司;噻唑藍(lán)(MTT)購自美國Sigma公司;TNF-α和IL-1β試劑盒購自欣博盛生物科技有限公司;CysLTs試劑盒購自美國Cayman Chemical公司。
1.2原代神經(jīng)元培養(yǎng)取24 h內(nèi)新生大鼠,經(jīng)75%乙醇消毒后斷頭取腦,于預(yù)冷的解剖液中分離左右半球,分離大腦皮層后剪碎,制成細(xì)胞懸液。調(diào)整細(xì)胞密度為1×109ml,接種到經(jīng)0.1%多聚賴氨酸涂板干燥的96孔或24孔板中,并將種植液換成培養(yǎng)液。每2~3 d換液1次,到培養(yǎng)第5天,加入終濃度為10 μmol/L的阿糖胞苷,抑制非神經(jīng)元的生長,24 h后換成新鮮的培養(yǎng)液繼續(xù)培養(yǎng)7 d后用于各項(xiàng)實(shí)驗(yàn)。
1.3Aβ25~35處理將1 μg Aβ25~35加無菌生理鹽水溶解后,配成280 μmol/L的母液分裝,于-20℃保存。使用前置于37℃培養(yǎng)箱內(nèi)孵育1 w,使其聚集老化。
1.4實(shí)驗(yàn)分組將原代神經(jīng)元隨機(jī)分組:對照組,加入一定體積的細(xì)胞培養(yǎng)液,不做任何干預(yù);模型組:加入終濃度為20 μmol/L的Aβ25~35作用24 h;1,8-桉油素低劑量組,加入終濃度為1 μmol/L的1,8-桉油素預(yù)處理1 h后,再加入終濃度為20 μmol/L的Aβ25~35處理24 h;1,8-桉油素高劑量組,加入終濃度為10 μmol/L的1,8-桉油素預(yù)處理1 h后,再加入終濃度為20 μmol/L的Aβ25~35處理24 h。
1.5細(xì)胞活性測定將神經(jīng)元處理后,小心棄去培養(yǎng)液,加入MTT液(0.5 g/L),放回到CO2孵箱內(nèi)37 ℃孵育4 h,加入DMSO 100 μl,振蕩搖勻使紫色結(jié)晶充分溶解,置于酶標(biāo)儀上測波長為570 nm的吸光度。
1.6酶聯(lián)免疫吸附(ELISA)檢測藥物處理24 h后,收集上清培養(yǎng)液,按照試劑盒說明書,采用雙抗體夾心ELISA法檢測培養(yǎng)液中的TNF-α、IL-1β及半胱氨酰白三烯(CysLTs)含量。用酶標(biāo)儀測定450 nm光密度值,根據(jù)標(biāo)準(zhǔn)曲線計(jì)算樣本中各因子的含量。
1.7統(tǒng)計(jì)學(xué)方法應(yīng)用SPSS13.0行單因素方差分析和Dunnett檢驗(yàn)。
2結(jié)果
2.11,8-桉油素對神經(jīng)元細(xì)胞活性的影響Aβ25~35作用24 h后,神經(jīng)元細(xì)胞存活率明顯下降,與對照組比較顯著差異(P<0.01);1,8-桉油素(1 μmol/L和10 μmol/L)預(yù)處理后,與模型組比較,細(xì)胞存活率顯著增高(P< 0.01)。見表1。
2.21,8-桉油素對TNF-α和IL-1β釋放的影響與對照組比較,模型組TNF-α和IL-1β的含量明顯增加(P<0.01);與模型組比較,1,8-桉油素 10 μmol/L預(yù)處理后,顯著降低TNF-α和IL-1β的水平(P<0.01),1,8-桉油素 1 μmol/L預(yù)處理明顯減少TNF-α和IL-1β的釋放,但統(tǒng)計(jì)學(xué)差異不明顯。見表2。
2.31,8-桉油素對神經(jīng)元CysLTs水平的影響Aβ25~35處理后,神經(jīng)元CysLTs釋放增加,與對照組比較,模型組CysLTs水平明顯上調(diào)(P< 0.01);與模型組比較,1,8-桉油素10 μmol/L預(yù)處理顯著抑制CysLTs的釋放(P<0.01),1,8-桉油素1 μmol/L預(yù)處理雖明顯降低CysLTs的水平,但無顯著差異。見表2。
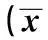
表1 各組細(xì)胞活性測定±s)
與對照組比較:1)P<0.01; 與模型組比較:2)P<0.01;下表同

表2 上清液中TNF-α和IL-1β及CysLTs水平檢測
3討論
Aβ在神經(jīng)元內(nèi)的沉積及其神經(jīng)毒性在AD的發(fā)生發(fā)展中起著關(guān)鍵作用,證據(jù)表明〔2〕,炎癥是導(dǎo)致疾病進(jìn)展的極為重要的組成部分。本研究采用Aβ25~35,處理原代培養(yǎng)的皮層神經(jīng)元24 h后能較好地建立AD細(xì)胞損傷模型。Aβ25~35處理后,細(xì)胞存活率明顯下降,可能與TNF-α、IL-1β釋放明顯增加有關(guān)。
神經(jīng)炎癥是AD患者腦內(nèi)的重要病理特征之一,而本研究發(fā)現(xiàn)1,8-桉油素能明顯抑制Aβ誘導(dǎo)的炎癥反應(yīng)。研究表明〔6〕,在AD模型,幾乎所有的炎癥因子釋放都會(huì)出現(xiàn)明顯增加,TNF-α是一種在腦內(nèi)能促進(jìn)細(xì)胞存活和死亡很強(qiáng)的前炎癥因子, IL-1β作為一種免疫調(diào)節(jié)因子可誘導(dǎo)神經(jīng)元多種炎癥因子的釋放。CysLTs(包括LTC4、LTD4、LTE4)是花生四烯酸經(jīng)5-脂氧酶的代謝產(chǎn)物,能夠促進(jìn)Aβ的生成〔7〕。在AD患者腦脊液或血漿中,TNF-α和IL-1β的水平顯著增高〔2〕;轉(zhuǎn)基因AD小鼠中下調(diào)TNF-α的表達(dá),老年斑或tau蛋白的生成明顯減少〔8〕。本文采用1,8-桉油素預(yù)處理皮層神經(jīng)元顯著減少Aβ誘導(dǎo)的炎癥因子釋放增加,表明其具有很強(qiáng)的抗感染作用。然而炎癥發(fā)生的機(jī)制尚不清楚,有研究發(fā)現(xiàn)Aβ能夠誘導(dǎo)NF-κB激活,而以前的研究表明1,8-桉油素能夠調(diào)節(jié)NF-κB的激活〔9,10〕,但是否參與Aβ的調(diào)節(jié)有待闡明。
4參考文獻(xiàn)
1溫蒲圓,周軍.阿爾茨海默病治療的研究進(jìn)展〔J〕.中國老年學(xué)雜志,2013;33(14): 3524-7
2Darreh-Shori T,Vijayaraghavan S,Aeinehband S,etal.Functional variability in butyrylcholinesterase activity regulates intrathecal cytokine and astroglial biomarker profiles in patients with Alzheimer's disease〔J〕.Neurobiol Aging,2013;34(11): 2465-81.
3Couturier J,Paccalin M,Morel M,etal.Prevention of the β-amyloid peptide-induced inflammatory process by inhibition of double-stranded RNA-dependent protein kinase in primary murine mixed co-cultures〔J〕.J Neuroinflammation,2011;8:72.
4Juergens UR,Engelen T,Racké K,etal.Inhibitory activity of 1,8-cineol (eucalyptol) on cytokine production in cultured human lymphocytes and monocytes〔J〕.Pulm Pharmacol Ther,2004;17(5): 281-7.
5Juergens UR,Dethlefsen U,Steinkamp G,etal.Anti-inflammatory activity of 1,8-cineol (eucalyptol) in bronchial asthma: a double-blind placebo-controlled trial〔J〕.Respir Med,2003;97(3): 250-6.
6邢恩鴻,田建麗,王愛霞,等.腫瘤壞死因子-α、白細(xì)胞介素- 1β 在淀粉樣蛋白致阿爾茨海默病大鼠神經(jīng)元損傷中的作用〔J〕.中國老年學(xué)雜志,2013;34(20): 5802-4.
7Wang XY,Tang SS,Hu M,etal.Leukotriene D4 induces amyloid-β generation via CysLT(1)R-mediated NF-κB pathways in primary neurons〔J〕.Neurochem Int,2013;62(3): 340-7.
8Montgomery SL,Narrow WC,Mastrangelo MA,etal.Chronic neuron- and age-selective down-regulation of TNF receptor expression in triple-transgenic Alzheimer disease mice leads to significant modulation of amyloid- and Tau-related pathologies〔J〕.Am J Pathol,2013;182(6): 2285-97.
9Zhao C,Sun J,Fang C,etal.1,8-cineol attenuates LPS-induced acute pulmonary inflammation in mice〔J〕.Inflammation,2014;37(2): 566-72.
10Greiner JF,Müller J,Zeuner MT,etal.1,8-Cineol inhibits nuclear translocation of NF-κB p65 and NF-κB-dependent transcriptional activity〔J〕.Biochim Biophys Acta,2013;1833(12): 2866-78.
〔2015-07-11修回〕
(編輯袁左鳴)
Effect of 1,8-cineol pretreatment on inflammatory response induced by Aβ25~35in primary cultured cortical neurons
WANG Lin,ZHAO Chun-Zhen.
Department of Pharmacology, Laboratory of Applied Pharmacology, Weifang Medical University, Weifang 261053, Shandong, China
【Abstract】ObjectiveTo investigate the effect of 1,8-cineol against Aβ(25~35)-induced inflammatory response in rat primary cultured neurons.MethodsRat primary cultured cortical neurons were randomly divided into control, Aβ(25~35)(20 μmol/L), low dose of 1,8-cineol (Aβ(25~35) 20 μmol/L + 1,8-cineol 1 μmol/L),high dose of 1,8-cineol(Aβ(25~35) 20 μmol/L +1,8-cineol 10 μmol/L) groups. Cell viability was evaluated by 3-(4,5-dimethyl -2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide(MTT) reduction assay. Neuron injury was induced 24 h after Aβ(25~35) treatment. Releases of TNF-α, IL-1β and CysLTs in the supernatant were determined by ELISA.Results20 μmol/L of Aβ(25~35) incubated for 24 h significantly reduced neuronal activity, and increased TNF-α, IL-1β and CysLTs releases. Pretreatment with 1,8-cineol obviously inhibited cytotoxicity and decreased the level of above cytokines and CysLTs releases.Conclusions1,8-cineol has a protective effect on Aβ(25~35) induced neuron injury, probably relates with inhibition of TNF-α, IL-1β and CysLTs releases.
【Key words】1,8-cineol; Alzheimer's disease; Inflammation; Cytokines
〔中圖分類號〕R749.1
〔文獻(xiàn)標(biāo)識碼〕A
〔文章編號〕1005-9202(2016)07-1540-02;
doi:10.3969/j.issn.1005-9202.2016.07.002
通訊作者:趙春貞(1984-),男,博士,副教授,主要從事神經(jīng)藥理學(xué)研究。
基金項(xiàng)目:國家自然科學(xué)基金專項(xiàng)基金項(xiàng)目(81341137);濰坊市科技局項(xiàng)目(201301071)

