DNA甲基化抑制劑5-azaC對(duì)花椰菜生長(zhǎng)發(fā)育的影響
袁建民,木萬(wàn)福,麻繼仙,楊 龍,李易蓉,但 忠,蘇銀玲
花椰菜(Brassica oleracea L.var.botrytis L.),又稱花菜、菜花、椰菜花,包括通常所說(shuō)的青花和白花2種。青花即青花菜(Brassica oleracea var.italica),又名西蘭花、綠菜花等。花椰菜以花球?yàn)槭秤闷鞴伲瑺I(yíng)養(yǎng)豐富,味道鮮美,是我國(guó)重要的蔬菜作物之一,具有一定的防癌、抗癌功效[1],深受消費(fèi)者的青睞。近年來(lái),栽培面積迅速擴(kuò)大,就云南而言,年生產(chǎn)面積約3.33萬(wàn)hm2(含復(fù)種)。近年來(lái),關(guān)于花椰菜在形態(tài)學(xué)[2]、細(xì)胞學(xué)[3]、生理生化[4]、分子水平[5]等方面的研究報(bào)道較多,并取得了一定的進(jìn)展。然而,對(duì)于表觀遺傳研究、DNA甲基化水平變化、基因表達(dá)調(diào)控等方面的研究卻比較缺乏。DNA甲基化與表觀遺傳變化密切相關(guān),在植物的整個(gè)發(fā)育分化過(guò)程中,DNA甲基化對(duì)控制基因表達(dá)、基因組防御、生長(zhǎng)發(fā)育都起著重要作用[6]。DNA甲基化抑制劑5-氮雜胞苷(5-azaC)現(xiàn)已廣泛用于植物生長(zhǎng)發(fā)育調(diào)控等方面的研究。甲基化水平會(huì)影響植物的花期、株高、抗病性、產(chǎn)量等重要農(nóng)藝性狀,同時(shí)產(chǎn)生的一些表型變異可作為育種材料[7]。
目前,涉及的甲基化研究主要集中在擬南芥[8]、水稻[9]、小麥[10]等植物上,而關(guān)于 DNA 甲基化抑制劑在花椰菜育種上的研究卻鮮見(jiàn)報(bào)道。本研究以花椰菜(青花和白花)為試材,對(duì)DNA甲基化抑制劑5-azaC對(duì)花椰菜生長(zhǎng)發(fā)育的影響進(jìn)行初步探索,以期通過(guò)表觀遺傳學(xué)的方法為花椰菜育種及繁種提供一定的科學(xué)依據(jù),為進(jìn)一步深入研究DNA甲基化提供參考。
1 材料與方法
1.1 試驗(yàn)材料
供試材料為5份不同熟性的花椰菜材料(表1)。其中,青花材料包括13195父本、13195母本及13027母本,白花材料包括C-2母本和152母本,均由云南省農(nóng)業(yè)科學(xué)院熱區(qū)生態(tài)農(nóng)業(yè)研究所蔬菜研究中心提供。

表1 供試材料
1.2 試驗(yàn)方法
試驗(yàn)于2014年在云南省楚雄州元謀縣熱區(qū)所蔬菜實(shí)驗(yàn)基地進(jìn)行。試驗(yàn)共設(shè)5個(gè)處理,DNA甲基化抑制劑 5-azaC 濃度分別為 0、5、10、20、40 mg/L,依次記為對(duì)照(CK)、T1、T2、T3、T4。
供試材料于2014年7月20日播種育苗,穴盤采用50孔的黑色塑料盤,當(dāng)花椰菜幼苗長(zhǎng)至5片左右真葉時(shí),選取大小均勻一致的幼苗進(jìn)行5-azaC葉面噴施處理,葉面噴施至葉片充分淋濕為止,為使溶液充分接觸葉片,在溶液中加入1~2滴吐溫20,每隔5 d處理1次,共3次。試驗(yàn)采用隨機(jī)區(qū)組設(shè)計(jì),每處理重復(fù)3次。每個(gè)小區(qū)定植20株,小區(qū)面積約4 m2,株距40 cm,行距50 cm,常規(guī)田間栽培管理。
1.3 數(shù)據(jù)調(diào)查與分析
調(diào)查不同熟性花椰菜材料的生育期和各時(shí)期的主要生物學(xué)性狀,包括株高、株幅、現(xiàn)蕾天數(shù)(從定植到現(xiàn)蕾的天數(shù))、葉長(zhǎng)度、葉寬度、葉形指數(shù)、莖粗、葉柄長(zhǎng)、花球直徑、單球質(zhì)量等。每個(gè)小區(qū)隨機(jī)選取5株調(diào)查記錄并取平均值。
試驗(yàn)所得數(shù)據(jù)采用Excel 2003軟件進(jìn)行數(shù)據(jù)的初步處理和制表,采用SAS 9.0國(guó)際通用統(tǒng)計(jì)分析軟件進(jìn)行數(shù)據(jù)差異顯著性分析,并用Duncan法進(jìn)行多重比較。
2 結(jié)果與分析
2.1 5-azaC處理對(duì)花椰菜株高的影響
當(dāng)花椰菜生長(zhǎng)到120 d左右時(shí),對(duì)株高進(jìn)行測(cè)量。由表2可知,不同濃度5-azac對(duì)不同花椰菜材料株高發(fā)育的影響不同。對(duì)青花材料而言,處理組對(duì)其株高的生長(zhǎng)存在顯著促進(jìn)效應(yīng),均比對(duì)照高。當(dāng)5-azac濃度為20 mg/L時(shí),13195父本株高達(dá)到最高;5-azac濃度為 10 mg/L時(shí),13195母本株高達(dá)到最高;而5-azac濃度為 40 mg/L時(shí),13027母本株高達(dá)到最高。對(duì)白花材料而言,處理組對(duì)C-2母本株高的生長(zhǎng)促進(jìn)效應(yīng)顯著高于對(duì)照,隨著5-azac濃度的升高,促進(jìn)效應(yīng)隨之降低;而對(duì)152母本株高的生長(zhǎng)存在一定程度的抑制效應(yīng),隨著5-azac濃度的升高,抑制效應(yīng)隨之增強(qiáng)。

表2 不同濃度5-azaC處理對(duì)花椰菜株高發(fā)育的影響 cm
2.2 5-azaC處理對(duì)花椰菜株幅的影響
由表3可知,同一材料在不同濃度5-azaC處理之間花椰菜株幅存在顯著差異。隨著5-azaC濃度的升高,13195父本和152母本的株幅呈下降趨勢(shì),表現(xiàn)為抑制效應(yīng);而13195母本、13027母本和C-2母本的株幅變化則呈升高趨勢(shì),表現(xiàn)為促進(jìn)效應(yīng),表明無(wú)論是白花還是青花,不同花椰菜材料對(duì)5-azaC處理的敏感程度不同。

表3 不同濃度5-azaC處理對(duì)花椰菜株幅發(fā)育的影響 cm
2.3 5-azaC處理對(duì)花椰菜現(xiàn)蕾時(shí)間的影響
現(xiàn)蕾時(shí)間的早晚不僅與花椰菜熟性密切相關(guān),而且還受許多外界因素的影響,現(xiàn)蕾時(shí)間的早晚直接影響著花椰菜種子的生產(chǎn)。由表4可以看出,與對(duì)照相比,青花材料13195母本,提前現(xiàn)蕾時(shí)間較短,在10 mg/L 5-azaC條件下最多可以提前 3 d左右;而13027母本在10 mg/L 5-azaC條件下提前現(xiàn)蕾時(shí)間最高可以達(dá)到8 d左右;其余13195父本、C-2母本、152母本提前現(xiàn)蕾時(shí)間最大值分別為7.0、6.4、4.3 d。此外,在5個(gè)供試材料中,13195父本和C-2母本在5-azaC濃度為20 mg/L條件下提前現(xiàn)蕾時(shí)間達(dá)到最大值;而13195母本、13027母本、152母本均在 5-azaC濃度為10 mg/L條件下提前現(xiàn)蕾時(shí)間達(dá)到最大值。由此可見(jiàn),現(xiàn)蕾時(shí)間的早晚與5-azaC的濃度存在密切相關(guān),提前現(xiàn)蕾的適宜5-azaC濃度為10~20 mg/L。同一材料在不同濃度5-azaC處理下,花椰菜現(xiàn)蕾時(shí)間存在顯著差異。各處理的現(xiàn)蕾時(shí)間均比對(duì)照明顯提前,現(xiàn)蕾時(shí)間提前范圍為3~8 d,這表明甲基化抑制劑5-azaC可以在一定程度上促進(jìn)花椰菜提早現(xiàn)蕾提早開(kāi)花。

表4 不同濃度5-azaC處理對(duì)花椰菜現(xiàn)蕾時(shí)間的影響 d
2.4 5-azaC處理對(duì)花椰菜花球直徑的影響
當(dāng)花椰菜幼苗生長(zhǎng)到120 d左右,可見(jiàn)明顯花蕾時(shí)對(duì)花球直徑進(jìn)行準(zhǔn)確測(cè)定,結(jié)果顯示(表5):在同一供試材料中(除了材料C-2母本),不同濃度5-azaC處理之間花椰菜花球直徑變化差異顯著。隨著5-azaC濃度的升高,13195母本的花球直徑均明顯高于對(duì)照組,而13195父本、13027母本和152母本的花球直徑與對(duì)照組相比,呈先升高后下降趨勢(shì)。當(dāng)5-azaC 濃度為 10 mg/L時(shí)(T2),所有供試材料的花球直徑均達(dá)到最大值;當(dāng)5-azaC濃度達(dá)到40 mg/L時(shí)(T4),13195父本的花球直徑受到的抑制效應(yīng)最明顯。可見(jiàn),不同花椰菜材料花球直徑對(duì)5-azaC處理的影響程度不同。
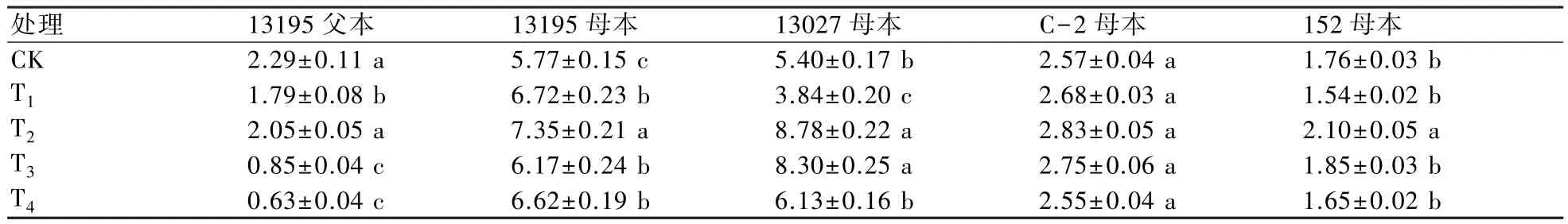
表5 不同濃度5-azaC處理對(duì)花椰菜花球直徑的影響 cm
2.5 5-azaC處理對(duì)花椰菜單球質(zhì)量的影響
田間觀察表明,在整個(gè)生育期內(nèi),處理組與對(duì)照組均能正常生長(zhǎng)發(fā)育,未發(fā)現(xiàn)幼苗枯萎或死亡現(xiàn)象。無(wú)論是青花還是白花,其葉形、葉色、花球顏色等農(nóng)藝性狀基本一致。單球質(zhì)量是影響花椰菜產(chǎn)量的重要指標(biāo)。結(jié)果顯示(表6):在同一供試材料中,不同濃度5-azaC處理之間的花椰菜單球質(zhì)量變化差異顯著,而C-2母本各處理之間的差異不顯著,表明不同材料對(duì)5-azaC處理的敏感程度不同。隨著5-azaC濃度的升高,13195父本、13195母本、13027母本、152母本的單球質(zhì)量與對(duì)照相比呈先升高后下降趨勢(shì),低濃度(低于10 mg/L)表現(xiàn)為促進(jìn)效應(yīng),高濃度(10~40 mg/L)表現(xiàn)為抑制效應(yīng)。 5-azaC 濃度為 10 mg/L 時(shí)(T2),13195 母本、13027母本和 152 母本單球產(chǎn)量達(dá)到最大值;而當(dāng)5-azaC濃度為40 mg/L時(shí)(T4),13195父本和13195母本的單球質(zhì)量與對(duì)照相比抑制效應(yīng)最明顯。
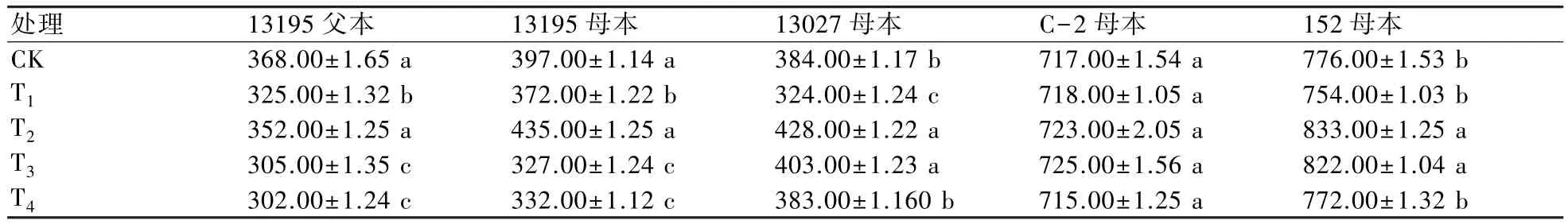
表6 不同濃度5-azaC處理對(duì)花椰菜單球質(zhì)量的影響 g
3 結(jié)論與討論
已有研究指出,DNA甲基化參與植物基因的表達(dá)調(diào)控,DNA甲基化不足或太高都可以引起植物的表型異常,進(jìn)而調(diào)節(jié)植物的生長(zhǎng)發(fā)育,同時(shí)DNA甲基化是植物正常生長(zhǎng)發(fā)育過(guò)程中所必需的。DNA甲基化抑制劑5-azaC處理可以使甲基化水平降低,DNA去甲基化是導(dǎo)致植物異常表型的主要原因。前人在研究 5-azaC 處理擬南芥種子[11]、亞麻種子[12]、甘藍(lán)幼苗[13]、小麥幼苗[10]時(shí),結(jié)果顯示:植株經(jīng) 5-azaC處理后DNA甲基化水平降低,可見(jiàn)植株矮化、株成叢狀、葉片變小等異常性狀,并且可以遺傳給后代。在本試驗(yàn)中,花椰菜幼苗經(jīng)不同濃度的5-azaC處理后沒(méi)有發(fā)現(xiàn)枯萎或死亡現(xiàn)象,但是一定濃度(20~40 mg/L)的5-azaC處理可使花椰菜植株出現(xiàn)植株矮化、葉片變小、提早現(xiàn)蕾、植株叢狀等異常性狀,其中對(duì)青花較為明顯,這可能是青花相對(duì)白花對(duì)5-azaC處理更為敏感,5-azaC處理后引起了DNA甲基化水平降低,從而導(dǎo)致了表型異常,而且這種抑制作用存在一定劑量累計(jì)效應(yīng)。此外,經(jīng)過(guò)一定濃度5-azaC處理后,花椰菜的株高、株幅、現(xiàn)蕾時(shí)間、花蕾直徑、單球質(zhì)量明顯異于對(duì)照,這說(shuō)明適宜濃度的5-azaC處理可以獲得一些理想的表型,這些表型變化假如可以遺傳,則可能用于下一步育種。
DNA甲基化與植物春化作用及開(kāi)花密切相關(guān)。Burn等[14]采用5-azaC處理尚未春化的擬南芥植株后,處理組比對(duì)照組提前開(kāi)花,而對(duì)春化作用不敏感的晚開(kāi)花材料對(duì)5-azaC處理無(wú)明顯變化。本試驗(yàn)結(jié)果表明:一定濃度的5-azaC處理可以促進(jìn)花椰菜(包括青花和白花)提早現(xiàn)蕾和開(kāi)花,提早時(shí)間在3~8 d之間;不同濃度不同材料之間花椰菜提前現(xiàn)蕾的天數(shù)各有差異,但均比對(duì)照組有所提前;不同材料對(duì)5-azaC的敏感程度反應(yīng)不同。這與擬南芥[10]、小麥[15]、蘿卜[16]、白菜[17]等植物的研究結(jié)果一致,說(shuō)明DNA甲基化水平的降低可以促進(jìn)植物提早現(xiàn)蕾開(kāi)花。Finnegan等[18]研究認(rèn)為:僅甲基化水平降低就可以使植物開(kāi)花,這說(shuō)明在植物生長(zhǎng)發(fā)育過(guò)程中,存在一些與開(kāi)花相關(guān)基因啟動(dòng)子DNA去甲基化,活化基因表達(dá)導(dǎo)致DNA甲基化水平降低,進(jìn)而促進(jìn)植物開(kāi)花,但是具體的開(kāi)花機(jī)制尚不清楚。本研究以花椰菜(包括青花和白花)為材料,通過(guò)對(duì)5葉1心幼苗進(jìn)行DNA甲基化抑制劑5-azaC處理,達(dá)到了提早現(xiàn)蕾和開(kāi)花等理想效果,這對(duì)解決花椰菜雜交育種中親本花期不遇具有重要作用。目前還只是研究初始階段,而對(duì)于甲基化水平具體下降了多少,DNA甲基化相關(guān)基因如何調(diào)控等,還需要進(jìn)一步深入研究。
[1] Keck A S, Finley JW.Cruciferous vegetables: cancer protective mechanisms of glucosinolate hydrolysis products and selenium[J].Integrative Cancer Therapies, 2004, 3(1): 5-12.
[2]朱世楊,張小玲,劉慶,等.花椰菜自交系主要形態(tài)性狀的主成分分析和聚類分析[J].植物遺傳資源學(xué)報(bào),2012,13(1):77-82.
[3]袁建民,木萬(wàn)福,楊龍,等.青花菜小孢子發(fā)育時(shí)期與花器形態(tài)的相關(guān)性[J].中國(guó)農(nóng)學(xué)通報(bào),2016,32(34):123-128.
[4]李光慶,謝祝捷,姚雪琴,等.花椰菜葉綠素?zé)晒鈪?shù)與耐寒性的關(guān)系研究[J].園藝學(xué)報(bào),2010,37(12):2001-2006.
[5]樓玨,張小玲,羅天寬,等.利用SSR和SRAP標(biāo)記分析花椰菜自交系的遺傳多樣性[J].分子植物育種,2015,13(3):605-614.
[6]屠發(fā)志,彭世清.植物表觀遺傳與DNA甲基化[J].生物技術(shù)通訊,2007,18(5):155-158.
[7] Fieldes M A,Schaeffer SM, Krech M J,et al.DNA hypomethylation in 5-azacytidine-induced early-flowering lines of flax[J].Theor Appl Genet, 2005, 111(1): 136-149.
[8] Wang Z C,Ma H X,He Y X.Effects of cadmium on Arabidopsis thaliana DNA methylation[J].Plant Physiology Communications, 2009, 45(2): 115-118.
[9] A kimoto K,Katakami H, Kim H J,et al.Epigenetic inheritance in rice plant[J].Annals of Botany, 2007, 100(2): 205-217.
[10]陳芳,王子成.5-氮雜胞苷對(duì)小麥生長(zhǎng)發(fā)育及DNA甲基化的影響[J].河南大學(xué)學(xué)報(bào):自然科學(xué)報(bào),2011,41(1):61-66.
[11] Finnegan E J, Peacock W J, Dennis E S.Reduced DNA methylation in Arabidopsis thaliana results in abnormal plant development[J].Proc Natl Acad Sci USA, 1996, 93(16):8449-8454.
[12] Fieldes M A,Schaeffer SM,Krech M J,et al.DNA hypomethylation in 5-azaCytidine induced early flowering lines of flax[J].Theor Appl Genet, 2005, 111(1): 136-149.
[13] King G J.Morphological development in Brassica oleraceais modulated by in vivo treatment with 5-azaCytidine[J].Jourm Horticul Sci, 1995, 70(2): 333-342.
[14] Burn J E, Bagnall D J,Metager J D, et al.DNA Methylation, vernalization, and the initiation of flowering[J].PNAS, 1993,90(1): 287-291.
[15] Horvath E,Szalai G, Janda T,et al.Effect of vernalization and 5-azaCytidine on the methylation level of DNA in wheat(Triticum aestivum L.cv.martonvasar 15) [J].Plant Science, 2003, 165(4): 689-692.
[16]汪炳良,李水鳳,曾廣文,等.5-azaC對(duì)蘿卜莖尖DNA甲基化和開(kāi)花的影響[J].核農(nóng)學(xué)報(bào),2005,19(4):265-268.
[17]李梅蘭,曾廣文,朱祝軍.5-氮雜胞苷促進(jìn)白菜開(kāi)花的效應(yīng)分析[J].浙江大學(xué)學(xué)報(bào),2003,29(3):287-290.
[18] Finnegan E J, Genger R K.DNA methylation and the promotion of flowering by vernalization[J].Plant Biology, 1998,95(10): 5824-5829.

