Aβ42蛋白與膠質(zhì)細(xì)胞吞噬相關(guān)受體相互作用的研究
李喆,張郃
?
Aβ42蛋白與膠質(zhì)細(xì)胞吞噬相關(guān)受體相互作用的研究
李喆,張郃
100029 北京,首都醫(yī)科大學(xué)附屬安貞醫(yī)院藥劑科(李喆);100053 北京,首都醫(yī)科大學(xué)宣武醫(yī)院藥劑科(張郃)
探討寡聚形態(tài) Aβ42蛋白與膠質(zhì)細(xì)胞吞噬相關(guān)受體 SRB、CD36 的體外結(jié)合情況,以及上述受體封閉狀態(tài)下或內(nèi)吞抑制劑存在條件下該細(xì)胞吞入 Aβ42數(shù)量的變化規(guī)律。查明富寡聚物 Aβ42(oAβ42)環(huán)境對(duì)小膠質(zhì)細(xì)胞的吞噬相關(guān)受體 SRB、CD36、TNF-α、TNF-R 基因表達(dá)量的影響。
用酶聯(lián)免疫法測(cè)定 oAβ42與膠質(zhì)細(xì)胞 SRB、CD36 受體的結(jié)合力。用 SRB、CD36 受體的功能性抗體,受體內(nèi)吞(巨吞飲)抑制劑作用細(xì)胞,檢測(cè) BV2 細(xì)胞對(duì) oAβ42吞噬能力的變化,反轉(zhuǎn)錄法測(cè)定 oAβ42影響下的 BV2 小膠質(zhì)細(xì)胞吞噬相關(guān)基因表達(dá)量變化。
oAβ42與膠質(zhì)細(xì)胞清道夫家族 SRB、CD36 受體在體外實(shí)驗(yàn)中特異性結(jié)合,SRB 受體的阻斷使小膠質(zhì)細(xì)胞內(nèi)吞 oAβ42的能力顯著下降,CD36 受體阻斷劑對(duì)細(xì)胞內(nèi)吞量無(wú)顯著影響,受體內(nèi)吞(巨吞飲)抑制劑增加細(xì)胞對(duì)oAβ42攝取的量。oAβ42對(duì)人腦小膠質(zhì)細(xì)胞吞噬相關(guān)受體的表達(dá)量有顯著影響。
oAβ42與膠質(zhì)細(xì)胞吞噬相關(guān)受體的相互作用可進(jìn)一步影響細(xì)胞對(duì)病理蛋白的吞入和清除過(guò)程。該結(jié)論可為從分子水平調(diào)節(jié)膠質(zhì)細(xì)胞與 Aβ42相互作用的受體激活劑,基因封閉劑等 AD免疫療法提供參考依據(jù)。
小神經(jīng)膠質(zhì)細(xì)胞; 淀粉樣β 肽; 阿爾茨海默病; 基因表達(dá)
在各種阿爾茨海默病(alzeimer disease,AD)病因假說(shuō)中,Aβ 級(jí)聯(lián)假說(shuō)占據(jù)主流地位[1],該學(xué)說(shuō)認(rèn)為腦內(nèi) Aβ 淀粉樣蛋白的錯(cuò)誤折疊和沉積導(dǎo)致病程進(jìn)展惡化[2],Aβ 蛋白是人體正常代謝產(chǎn)物,該蛋白在腦組織內(nèi)外的濃度處于微妙的動(dòng)態(tài)平衡狀態(tài),錯(cuò)誤折疊聚集的 Aβ 蛋白可以與膠質(zhì)細(xì)胞表面受體結(jié)合而被其吞噬清除,該清除過(guò)程與小膠質(zhì)細(xì)胞吞噬相關(guān)受體的表達(dá)情況有密切聯(lián)系[3]。膠質(zhì)細(xì)胞表面表達(dá)一系列功能各異,作用交互的模式識(shí)別受體,該組受體可識(shí)別入侵細(xì)菌、病毒,也可識(shí)別特定基序的病理蛋白結(jié)構(gòu)并作出迅速反應(yīng),包括 SRA 家族、SRB 家族等[4-5]。本研究為探討 Aβ42蛋白與膠質(zhì)細(xì)胞 SRB 家族受體的結(jié)合黏附狀態(tài)及 Aβ42對(duì)吞噬相關(guān)受體基因變化的影響,利用酶聯(lián)免疫法測(cè)定寡聚形態(tài)Aβ42(oAβ42)與小膠質(zhì)細(xì)胞表面 SRB 家族受體的體外結(jié)合力,利用細(xì)胞內(nèi)吞(吞飲)抑制劑考察 Aβ42進(jìn)入細(xì)胞的途徑,并探討該家族受體持續(xù)接觸 Aβ42蛋白后對(duì)自身表達(dá)量的調(diào)節(jié)影響。
1 材料和方法
1.1 材料
K1621 反轉(zhuǎn)錄試劑盒購(gòu)自加拿大 Fermentas 公司;TMB 顯色液購(gòu)自天根生化科技(北京)有限公司;Aβ42蛋白購(gòu)自美國(guó) Peptide 公司;牛血清白蛋白(BSA)購(gòu)自瑞士 Roche 公司;BCA 試劑盒購(gòu)自美國(guó) Pierce 公司;DMEM 無(wú)血清培養(yǎng)基購(gòu)自美國(guó) Hyclone 公司;二甲基亞砜(DMSO)、膜蛋白提取試劑盒購(gòu)自美國(guó) Merck Millipore 公司;oAβ42檢測(cè)試劑盒購(gòu)自美國(guó) IBL 公司;抗 his 標(biāo)簽兔源抗體、HRP 標(biāo)記羊抗鼠二抗購(gòu)自北京中杉金橋生物技術(shù)有限公司;諾考達(dá)唑購(gòu)自美國(guó) Sigma 公司;人腦小膠質(zhì)細(xì)胞購(gòu)自美國(guó) Sciencell 公司;大鼠星型膠質(zhì)細(xì)胞購(gòu)自武漢原生原代(PriCells)生物醫(yī)藥科技有限公司;Trizol RNA 提取試劑購(gòu)自美國(guó) Invitrogen 公司;SRB 功能性抗體、大鼠抗小鼠 CD36 抗體、網(wǎng)格蛋白抑制劑購(gòu)自 Abcam 公司。
1.2 方法
1.2.1 Aβ42寡聚體的制備 Aβ42用 HFIP 溶至 1 mg/ml,水浴超聲 10 min 后分裝,將 HFIP 揮發(fā)后–20 ℃凍存。凍存的 Aβ42用 DMSO 溶至5 mmol/L,水浴超聲 10 min,用細(xì)胞培養(yǎng)基稀釋至 100 μmol/L,4 ℃孵育 24 h,即制得 oAβ42。使用前 4 ℃ 14000 ×離心 10 min,以移除纖維及高聚集形態(tài)的 Aβ42。
1.2.2 膠質(zhì)細(xì)胞 Aβ42吞入量的測(cè)定 將狀態(tài)良好的 BV2 細(xì)胞消化后按 106個(gè)/孔接種于 6 孔板,37 ℃、5% CO2環(huán)境培養(yǎng) 48 h,每孔加藥溶于1 ml 培養(yǎng)基,oAβ42吞入量測(cè)定的加藥時(shí)間為 3 h,收集細(xì)胞離心 5 min 后,每孔加入等量的細(xì)胞裂解液混勻,10000 ×離心5 min 后取上清,按試劑盒說(shuō)明測(cè)上清中 oAβ42的量,每組值除以該樣品 BCA 蛋白濃度測(cè)定結(jié)果,即得細(xì)胞內(nèi) Aβ42的濃度。為便于對(duì)比各組結(jié)果,以對(duì)照組(只加入 Aβ42)的 Aβ42含量為 100%,換算成百分?jǐn)?shù)表示。
1.2.3 細(xì)胞膜蛋白的提取 按試劑盒說(shuō)明提取膜蛋白,將收集的細(xì)胞(約 107個(gè))用 1 ml 細(xì)胞裂解液重懸,4 ℃、1000 ×離心 5 min,收集上清即為胞漿(可溶)部分,沉淀部分含有富集的包膜蛋白,立即加入膜蛋白提取工作液室溫孵育 45 min,16000 ×離心 15 min,棄去沉淀,上清部分即為富集的膜蛋白成分,測(cè)定蛋白濃度,于–80 ℃保存。
1.2.4 Aβ42與小膠質(zhì)細(xì)胞受體的結(jié)合力測(cè)定 在 96 孔板分別包被 PBS(空白孔)、3% BSA(對(duì)照孔)和寡聚體 Aβ42,體系為 50 μl/孔,4 ℃過(guò)夜孵育,次日棄去包被液,以 3% BSA 封閉 2 h,棄去封閉液,各孔加入稀釋后(1:50)的胞膜蛋白提取物,37 ℃孵育 2 h。棄去未結(jié)合的胞膜蛋白提取物,0.3% PBST 洗板 3 遍,加入檢測(cè)受體所對(duì)應(yīng)的一抗(1:1000 稀釋),室溫孵育 2 h,棄去未結(jié)合的一抗,用 0.3% PBST 洗板 6 遍,1 min/遍。加入一抗對(duì)應(yīng)的 HRP 偶聯(lián)的二抗(1:5000稀釋),37 ℃孵育 2 h,棄去未結(jié)合的二抗,0.3% PBST 洗 6 遍,1 min/遍。每孔加入 100 μl 的 TMB 顯色15 min,之后每孔加入 100 μl 1 mol/L 的硫酸終止反應(yīng),在酶標(biāo)儀讀取 450 nm 處的值。每個(gè)樣品設(shè) 3 個(gè)復(fù)孔,實(shí)驗(yàn)重復(fù) 3 次。
1.2.5 吞噬受體及吞飲(內(nèi)吞)途徑阻斷劑對(duì)小膠質(zhì)細(xì)胞攝取 oAβ42數(shù)量的影響 預(yù)先分別用 SRB、CD36 抗體(10 μg/ml)、微管解聚抑制劑諾考達(dá)唑(1 μg/ml),網(wǎng)格蛋白抑制劑(20 μmol/L)處理 BV2 細(xì)胞 2 h,檢測(cè)小膠質(zhì)細(xì)胞在與 1 μmol/L的 oAβ42作用 3 h 后的 oAβ42攝取量,與對(duì)照組小膠質(zhì)細(xì)胞對(duì)比。
1.2.6 小膠質(zhì)細(xì)胞吞噬相關(guān)受體表達(dá)量的檢測(cè) BV2 細(xì)胞以 3 × 105個(gè)/孔接種,培養(yǎng)過(guò)夜,采用不同濃度(2、5 μmol/L)的 oAβ42作用細(xì)胞48 h,24 h 時(shí)更換含有相同培養(yǎng)基的體系繼續(xù)孵育以避免細(xì)胞內(nèi)吞引起體系 oAβ42濃度改變。Trizol 試劑提取各組細(xì)胞總 RNA,反轉(zhuǎn)錄法用隨機(jī)引物將提取的 RNA 反轉(zhuǎn)錄為 cDNA。
反轉(zhuǎn)錄體系為:RNA1 μg,5 × Buffer4 μl,RNase 抑制劑1 μl,10 mmol/L dNTP2 μl,M-MuLV 反轉(zhuǎn)錄酶1 μl,隨機(jī)引物1 μl,加水補(bǔ)足20 μl。反應(yīng)條件為:42 ℃,1 h,70 ℃,5 min。Real-time PCR 檢測(cè)相關(guān)基因表達(dá)水平,內(nèi)參基因?yàn)?GADPH。引物序列為:CD36-F(RT)mouse:GCCAGTCGGAG ACATGCTTATT,CD36-R(RT)mouse:CTTTGCCAC GTCATCTGGGTTT;SRB-F(RT)mouse:ACCTCC CAGACATGCTTCCCATAA,SRB-R(RT)mouse:CGATCTTGCTGAGTCCGTTCCA;TNF-F(RT)mouse:TGCACCACCATCAAGGACTCA,TNF-R(RT)mouse:CTCAGGGAAGAATCTGGAAAGGTC;TNFR1-F(RT)mouse:CTTACTTCATTCACGA GCGTTGTC,TNFR1-R(RT)mouse:GACATACTTT CCTTGGGGACACA;GAPDH-F:ACGGCAAGTTC AACGGCACAG,GAPDH-R:CGCCAGTAGACTC CACGACAT。Real-time PCR 反應(yīng)條件為:2 × SBGR Mix12.5 μl,引物1(10 μmol/L)1 μl,引物 2(10 μmol/L)1 μl,cDNA 模板1 μl,加水補(bǔ)足25 μl,PCR 條件:95 ℃預(yù)熱 3 min;95 ℃10 s,60 ℃ 1 min,35 個(gè)循環(huán),72 ℃延伸 10 min。溶解曲線分析:60 ~ 92 ℃,每 1 ℃讀取數(shù)據(jù)。基因表達(dá)改倍數(shù)計(jì)算:改變倍數(shù)(FC)= 2-ΔΔCT;ΔΔCT =(CT 目的基因– CT 內(nèi)參)處理組–(CT 目的基因 – CT 內(nèi)參)對(duì)照組。
1.3 統(tǒng)計(jì)學(xué)處理
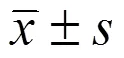
2 結(jié)果
2.1 SRB 受體與 oAβ42的結(jié)合力測(cè)定
用酶聯(lián)免疫法(ELISA)檢測(cè) oAβ42與多種膠質(zhì)細(xì)胞的 SRB 受體結(jié)合情況,不同數(shù)量的 oAβ42在酶標(biāo)板包被過(guò)夜后,與 BV2 小膠質(zhì)細(xì)胞(BV)、人腦小膠質(zhì)細(xì)胞(HM)、大鼠星型膠質(zhì)細(xì)胞(AM)細(xì)胞膜提取物孵育,加入 SRB 受體的一抗(1:1000)及相應(yīng)的 HRP 標(biāo)記二抗(1:5000),TMB 顯色讀取 450 nm 處吸光度,代表 oAβ42與三種膠質(zhì)細(xì)胞的結(jié)合力,結(jié)果如圖 1 所示。
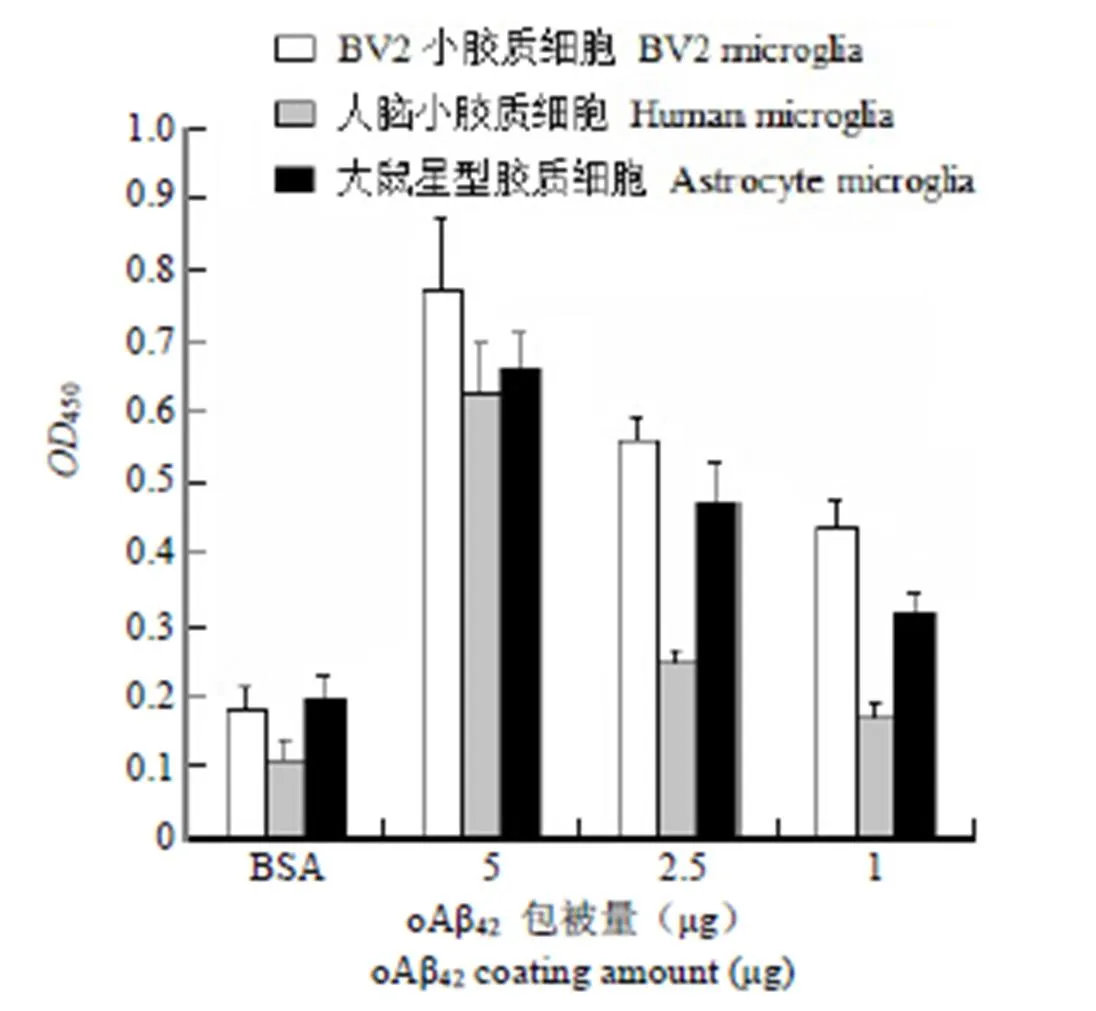
圖 1 oAβ42與三種小膠質(zhì)細(xì)胞中 SRB 受體的結(jié)合力
Figure 1 Affinity between SRB receptor and oAβ42
2.2 oAβ42與 BV2 細(xì)胞 CD36 受體的結(jié)合
在 BV2 小膠質(zhì)細(xì)胞中檢測(cè) oAβ42與 CD36 受體的結(jié)合,檢測(cè)操作步驟同 SRB 受體檢測(cè)。BV2 細(xì)胞中 CD36 受體與 oAβ42的結(jié)合呈現(xiàn)濃度依賴性,見(jiàn)圖 2。
2.3 吞噬受體或內(nèi)吞途徑被阻斷時(shí)小膠質(zhì)細(xì)胞的吞入量變化
用 SRB 受體和 CD36 受體的功能性抗體(10 μg/ml)預(yù)處理細(xì)胞 2 h,同時(shí)用巨吞飲抑制劑諾考達(dá)唑 1 μg/ml 和受體內(nèi)吞抑制劑 20 μmol/L 預(yù)先處理細(xì)胞 2 h,之后加入 oAβ42孵育,測(cè)定SRB 家族受體或內(nèi)吞(吞飲)途徑受阻時(shí)小膠質(zhì)細(xì)胞吞入oAβ42量的變化,3 h 時(shí)測(cè)定細(xì)胞內(nèi)吞oAβ42的數(shù)量,結(jié)果如圖 3 所示。
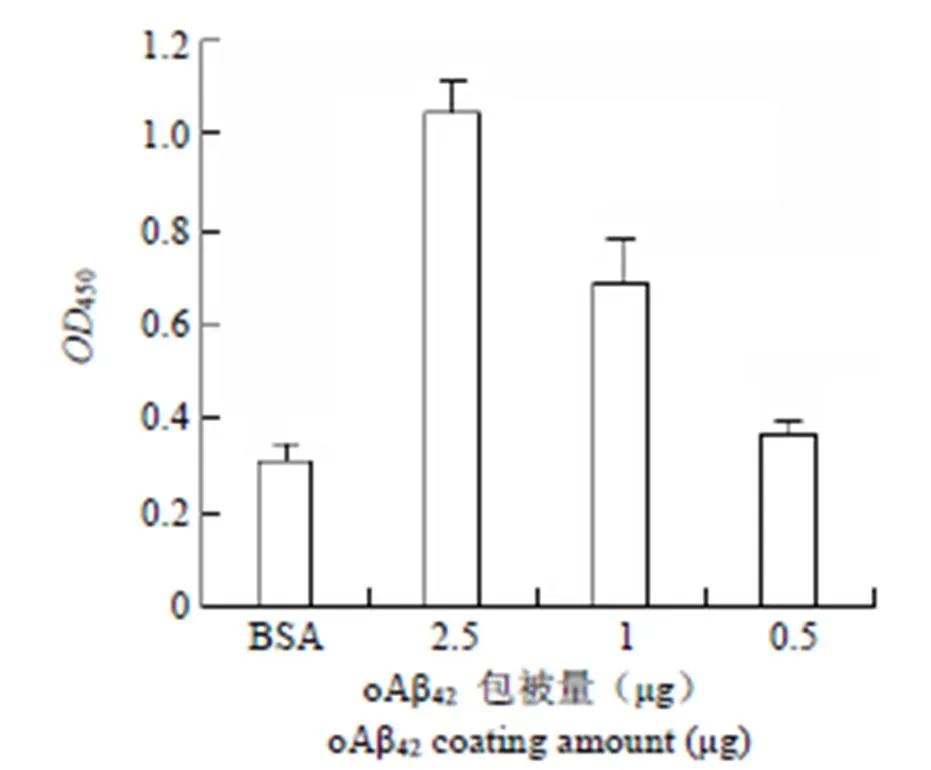
圖 2 oAβ42與小膠質(zhì)細(xì)胞 CD36 受體的結(jié)合力
Figure 2 Affinity between CD36 receptor and oAβ42
2.4 小膠質(zhì)細(xì)胞吞噬相關(guān)受體在 oAβ42作用后的表達(dá)改變情況
用不同濃度的 oAβ42(2 和5 μmol/L)孵育 BV 細(xì)胞 48 h 后,提取細(xì)胞 RNA,反轉(zhuǎn)錄為 cDNA,實(shí)時(shí)PCR 檢測(cè) CD36、SRB、TNF-α 因子、TNF 受體(TNF-R)表達(dá)情況(圖 4)。
3 討論
阿爾茨海默病(AD)是一種隨腦內(nèi) Aβ 沉積而發(fā)展的神經(jīng)退行性癡呆。寡聚形態(tài) Aβ(oAβ)可造成神經(jīng)突觸損傷失能,行為改變和神經(jīng)元的退化,進(jìn)一步形成的纖維態(tài) Aβ 可導(dǎo)致小膠質(zhì)細(xì)胞趨化聚集并釋放大量炎癥因子[6],促進(jìn) AD 的進(jìn)程,因此在 AD 的早期利用膠質(zhì)細(xì)胞這種腦內(nèi)主要的吞噬細(xì)胞來(lái)清除神經(jīng)毒性的oAβ42是一種極具希望的 AD 治療策略[7]。本次試驗(yàn)結(jié)果顯示,三種膠質(zhì)細(xì)胞中的 SRB 吞噬受體與oAβ42有特異性結(jié)合,CD36 受體在 BV2 小膠質(zhì)細(xì)胞中與 oAβ42特異性結(jié)合,確認(rèn)了該受體家族與 oAβ42的高親和力,該結(jié)合力是膠質(zhì)細(xì)胞對(duì) oAβ42進(jìn)行清除的基礎(chǔ)。
圖 3 吞噬受體阻斷及內(nèi)吞途徑阻斷對(duì)小膠質(zhì)細(xì)胞 oAβ42吞入量影響(與 oAβ42單獨(dú)處理組相比,*P < 0.05,**P < 0.01)
Figure 3 Effect of different internalization blocker on BV2 microglia (compared with single oAβ42treated group,*< 0.05,**< 0.01)
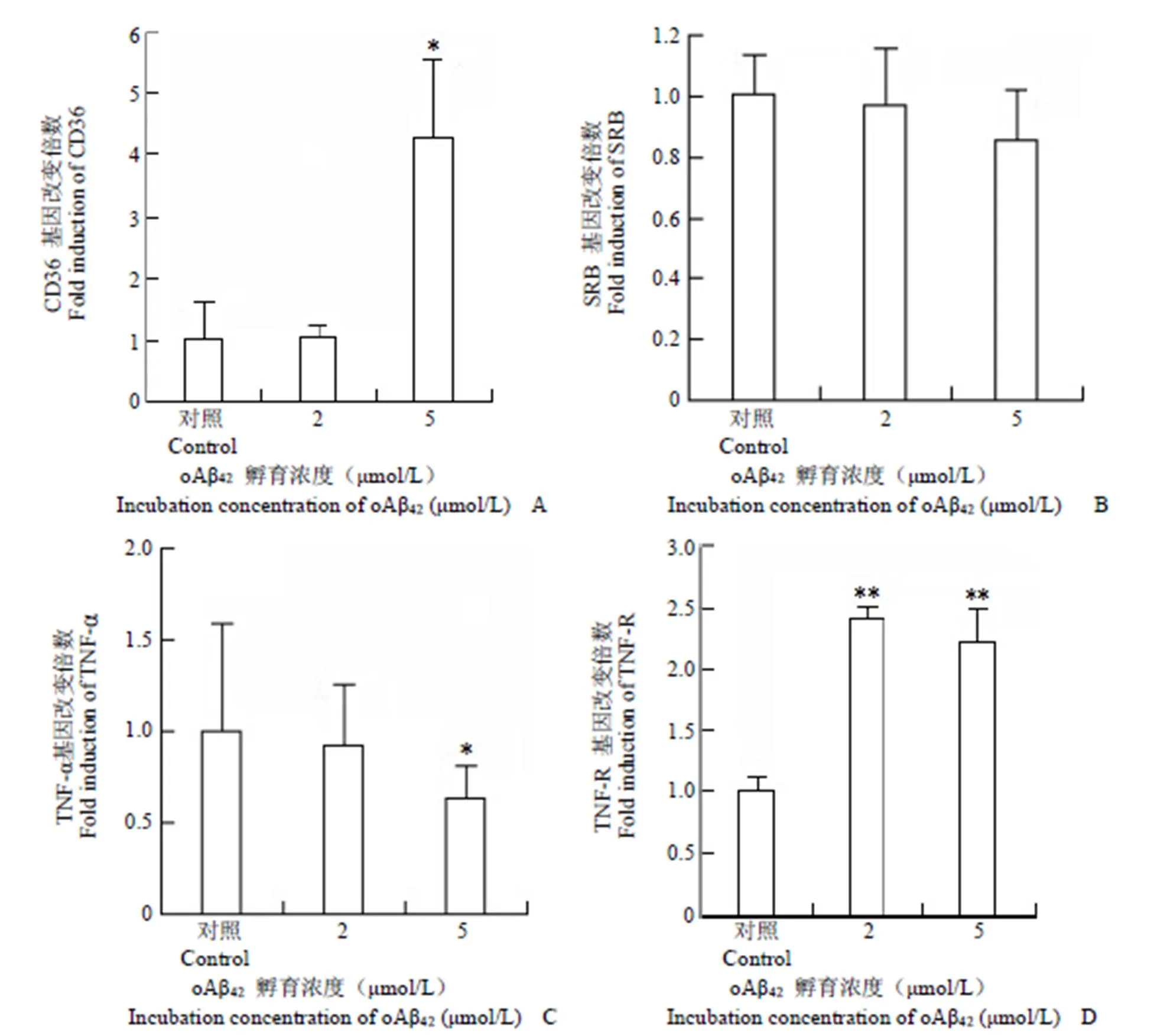
圖 4 oAβ42孵育后小膠質(zhì)細(xì)胞吞噬相關(guān)受體表達(dá)量改變(*P < 0.05,**P < 0.01)(A:CD36;B:SRB;C:TNF-α;D:TNF-R)
Figure 4 Phagocytosis related gene expression change after prolonged oAβ42incubation (*< 0.05,**< 0.01) (A: CD36; B: SRB; C: TNF-α; D: TNF-R)
為探討小膠質(zhì)細(xì)胞對(duì)oAβ42的攝取是否與 SRB、CD36 受體吞噬及吞飲(內(nèi)吞)等過(guò)程相關(guān),用不同的阻斷劑作用細(xì)胞后測(cè)定 oAβ42進(jìn)入細(xì)胞的量。SRB 受體的抗體處理細(xì)胞后,oAβ42吞噬量顯著下降,而 CD36 抗體處理組沒(méi)有檢測(cè)到與對(duì)照組吞噬量的差異;說(shuō)明 SRB 受體和 CD36 受體雖然同源[8],但具體功能有所差異,有研究指出,CD36/TLR2/6 的復(fù)合物專門對(duì)入侵病原進(jìn)行反應(yīng),CD36/TLR4/6 對(duì)內(nèi)源性配體(如 Aβ 或 oxLDL)反應(yīng)[9],而 SRB 受體并沒(méi)有與其他分子形成受體復(fù)合物的功能。體系中的 SRB 受體可直接吞噬oAβ42,而 CD36 受體的功能可能僅對(duì) oAβ42結(jié)合后的吞噬相關(guān)信號(hào)傳導(dǎo)起作用[10-11],實(shí)驗(yàn)中所用的受體內(nèi)吞抑制劑可以抑制網(wǎng)格蛋白介導(dǎo)的內(nèi)吞作用,諾考達(dá)唑可以通過(guò)抑制微管解聚從而影響細(xì)胞的巨吞飲過(guò)程,結(jié)果顯示兩者不同程度地增加了 BV2 細(xì)胞對(duì) oAβ42的攝取,這說(shuō)明小膠質(zhì)細(xì)胞 oAβ42的攝取不經(jīng)過(guò)上述途徑完成,相反地,對(duì)上述途徑的阻滯加快了oAβ42進(jìn)入細(xì)胞的速度,文獻(xiàn)報(bào)道,寡聚物形態(tài)的 Aβ 蛋白主要通過(guò)膠質(zhì)細(xì)胞受體激發(fā)的吞噬過(guò)程清除,而不是經(jīng)典受體內(nèi)吞途徑[12],吞飲途徑主要清除單體 Aβ[13],可能是由于上述內(nèi)吞途徑的抑制相對(duì)增加了oAβ42與細(xì)胞表面模式識(shí)別受體的黏附接觸,從而加強(qiáng)了oAβ42對(duì)吞噬受體的刺激,使細(xì)胞對(duì) oAβ 吞噬形式的內(nèi)化過(guò)程占優(yōu)。
清道夫受體近來(lái)已被證實(shí)參與小膠質(zhì)細(xì)胞接觸內(nèi)源性配體后介導(dǎo)的固有免疫激活過(guò)程,已證實(shí) B 族清道夫受體 CD36 和 SRB 在纖維狀態(tài)的 Aβ42與PrP(106-126)的作用下表達(dá)量增加,且兩者的變化呈現(xiàn)一致的趨勢(shì)[14]。本次實(shí)驗(yàn)得到的結(jié)果與之有所不同,SRB 受體的表達(dá)量在接受較長(zhǎng)時(shí)間的寡聚形態(tài) Aβ42作用之后出現(xiàn)一定下降趨勢(shì),而 CD36 受體在高濃度的 oAβ42作用下表達(dá)量顯著增加至本底的 465%(圖 4)。其原因可能是在高濃度 oAβ42環(huán)境下,oAβ42與小膠質(zhì)細(xì)胞的 CD36 受體結(jié)合使小膠質(zhì)細(xì)胞產(chǎn)生過(guò)氧化物,從而誘導(dǎo)該信號(hào)分子受體的進(jìn)一步表達(dá),并進(jìn)一步調(diào)節(jié)膠質(zhì)細(xì)胞的吞噬功能。
Aβ42在腦內(nèi)的穩(wěn)態(tài)由其產(chǎn)生和消除的速度共同決定[15]。如前所述,對(duì)于絕大多數(shù)的散發(fā)型(晚發(fā)型)AD 病人,并不存在 Aβ42產(chǎn)生過(guò)多的問(wèn)題,此時(shí)腦內(nèi) Aβ42清除能力的下降是 Aβ42聚集的主要原因[16],膠質(zhì)細(xì)胞對(duì) Aβ42保持清除是阻止疾病進(jìn)程的希望[17]。成年鼠中的小膠質(zhì)細(xì)胞并沒(méi)有喪失對(duì)細(xì)菌的吞噬能力以及對(duì) Aβ42纖維的黏附能力,唯獨(dú)降低了對(duì) Aβ42的吞噬能力,這說(shuō)明小膠質(zhì)細(xì)胞對(duì)病理蛋白的吞噬能力隨著衰老而退化,也與某些專職負(fù)責(zé)吞噬的細(xì)胞受體表達(dá)量變化有直接關(guān)系[18]。本實(shí)驗(yàn)結(jié)果提示在長(zhǎng)期的 oAβ42作用之下,與炎癥因子信號(hào)相關(guān)的 CD36 受體,TNF-R 受體表達(dá)明顯上調(diào),炎癥因子表達(dá)的上調(diào)伴隨Aβ 清除能力的下降是寡聚物 Aβ 產(chǎn)生細(xì)胞毒性的機(jī)制之一,相反的是,TNF-α 因子的水平在高濃度的 oAβ42孵育后顯著下降,可能是由于該因子的分泌能力在長(zhǎng)時(shí)間的病理蛋白孵育條件下有所削弱導(dǎo)致。本實(shí)驗(yàn)結(jié)果表明,oAβ42蛋白與膠質(zhì)細(xì)胞吞噬相關(guān)受體分子相互作用會(huì)影響小膠質(zhì)細(xì)胞吞噬相關(guān)受體的吞噬功能與狀態(tài),提示小膠質(zhì)細(xì)胞吞噬相關(guān)受體為靶標(biāo)的 AD 療法需要掌握精準(zhǔn)的時(shí)間、精確的藥物靶點(diǎn)以及分子水平的微環(huán)境調(diào)節(jié)。
[1] Querfurth HW, LaFerla FM. Alzheimer's disease. N Engl J Med, 2010, 362(4):329-344.
[2] Skaper SD. Alzheimer's disease and amyloid: culprit or coincidence? Int Rev Neurobiol, 2012, 102:277-316.
[3] Wilkinson K, El Khoury J. Microglial scavenger receptors and their roles in the pathogenesis of Alzheimer's disease. Int J Alzheimers Dis,2012, 2012:489456.
[4] Gao D, Sayre LM, Podrez EA. Analysis of relationship between oxidized phospholipid structure and interaction with the class B scavenger receptors. Methods Mol Biol, 2015, 1208:29-48.
[5] Li F, Faustino J, Woo MS, et al. Lack of the scavenger receptor CD36 alters microglial phenotypes after neonatal stroke. J Neurochem, 2015, 135(3):445-452.
[6] Komai K, Shichita T, Ito M, et al. Role of scavenger receptors as damage-associated molecular pattern receptors in Toll-like receptor activation. Int Immunol, 2017, 29(2):59-70.
[7] El Khoury J, Luster AD. Mechanisms of microglia accumulation in Alzheimer's disease: therapeutic implications. Trends Pharmacol Sci, 2008, 29(12):626-632.
[8] Eugenin J, Vecchiola A, Murgas P, et al. Expression pattern of scavenger receptors and amyloid-beta phagocytosis of astrocytes and microglia in culture are modified by acidosis: implications for alzheimer's disease. J Alzheimers Dis, 2016, 53(3):857-873.
[9] Stewart CR, Stuart LM, Wilkinson K, et al. CD36 ligands promote sterile inflammation through assembly of a Toll-like receptor 4 and 6 heterodimer. Nat Immunol, 2010, 11(2):155-161.
[10] Stuart LM, Bell SA, Stewart CR, et al. CD36 signals to the actin cytoskeleton and regulates microglial migration via a p130Cas complex. J Biol Chem, 2007, 282(37):27392-27401.
[11] Yamanaka M, Ishikawa T, Griep A, et al. PPARγ/RXRα-induced and CD36-mediated microglial amyloid-β phagocytosis results in cognitive improvement in amyloid precursor protein/presenilin 1 mice. J Neurosci, 2012, 32(48):17321-17331.
[12] Bateman DA, Chakrabartty A. Cell surface binding and internalization of abeta modulated by degree of aggregation. Int J Alzheimers Dis, 2011, 2011:962352.
[13] Mandrekar S, Jiang Q, Lee CY, et al. Microglia mediate the clearance of soluble Abeta through fluid phase macropinocytosis. J Neurosci, 2009, 29(13):4252-4262.
[14] Kouadir M, Yang L, Tu J, et al. Comparison of mRNA expression patterns of class B scavenger receptors in BV2 microglia upon exposure to amyloidogenic fragments of beta-amyloid and prion proteins. DNA Cell Biol, 2011, 30(11):893-897.
[15] Masters CL, Beyreuther K. Alzheimer's centennial legacy: prospects for rational therapeutic intervention targeting the Abeta amyloid pathway. Brain, 2006, 129(Pt 11):2823-2839.
[16] Thal DR. Clearance of amyloid beta-protein and its role in the spreading of Alzheimer's disease pathology. Front Aging Neurosci, 2015, 7:25.
[17] Gandy S, Heppner FL. Microglia as dynamic and essential components of the amyloid hypothesis. Neuron, 2013, 78(4):575-577.
[18] Floden AM, Combs CK. Microglia demonstrate age-dependent interaction with amyloid-β fibrils. J Alzheimers Dis, 2011, 25(2):279- 293.
Research on the interaction of Aβ42and phagocyticrelated receptors in microglia
LI Zhe, ZHANG He
Author Affiliations: Department of pharmacy, Anzhen Hospital of Capital Medical University, Beijing 100029, China (LI Zhe); Department of Pharmacy, Xuanwu Hospital of Capital Medical University, Beijing 100053, China (ZHANG He)
To investigate the binding affinity between oligomer Aβ42(oAβ42) and phagocytic-related receptors (SRB, CD36) in glia cells, assure the internalization pattern of Aβ42in phagocytic receptors (SRB, CD36)-blocked and endocytosis-blocked microglia, and clarify the expression of phagocytosis-related receptor (SRB, CD36, TNF-α, TNF-R) after oAβ42incubation in microglia.
ELISA assay was used to detect the binding affinity between oAβ42and glia SRB/CD36 receptor. Receptors neutralization and endocytosis/macropinocytosis blockade was used to detect receptor blocking effect on oAβ42internalization process. Reverse transcription was used to assay the fold change of phagocytosis-related receptor expression in oAβ42-treated microglia.
SRB and CD36 receptor showed high affinity with oAβ42in glia cells. Blockade of SRB receptor, but not CD36 receptor can decrease internalization of oAβ42. oAβ42incubation displayed remarkable effect on expression of phagocytosis-related receptors in BV2 cells.
Interaction between oAβ42and phagocytosis-related receptors in glia cells could influence the internalization and clearance of pathological protein in disease process. These findings provide reference to AD immunotherapy of receptor activator or gene blocker at molecular level.
Microglia; Amyloid beta-peptides; Alzheimer disease; Gene expression
ZHANG He,Email:zhanghe0718@sina.com
北京市政府項(xiàng)目老年重大疾病關(guān)鍵技術(shù)研究(PXM 2017-026283-000002)
張郃,Email:zhanghe0718@sina.com
2017-11-13
10.3969/j.issn.1673-713X.2018.01.007

