新型孔雀石綠衍生物的合成及其生物活性研究
季宇彬,孫瑩,張青揚,王慶華,胡海宇
?
新型孔雀石綠衍生物的合成及其生物活性研究
季宇彬,孫瑩,張青揚,王慶華,胡海宇
150076 哈爾濱商業大學生命科學與環境科學研究中心(季宇彬、孫瑩);100050 北京,中國醫學科學院北京協和醫學院藥物研究所天然藥物活性物質與功能國家重點實驗室/活性物質發現與適藥化研究北京重點實驗室(張青揚、王慶華、胡海宇)
以孔雀石綠(MG)為先導化合物,對其 C 環進行結構改造及修飾,系統評價合成的MG 類似物的抗致病菌 ESKAPE 活性及細胞毒性。
以芳香醛為原料,經過縮合、氧化反應得到13 個 MG 類似物,其結構均經1H-NMR、13C-NMR 和 HRMS 確證。采用肉湯微量稀釋法測定目標化合物抗致病菌 ESKAPE 的最小抑菌濃度(MIC),用細胞增殖法(MTS)測試目標化合物的毒性。
孔雀石綠及其 C 環改造類似物普遍對革蘭陽性菌有抑制作用,而對革蘭陰性菌無作用。其中 3b 對枯草芽孢桿菌的抗菌活性(MIC = 0.39 μmol/L)是 MG(MIC =1.56 μmol/L)的 4 倍;3f比 MG 的細胞毒性降低 10 倍以上。
設計、合成了 13 種新型孔雀石綠衍生物,并對其進行生物活性評價,從中篩選出了抑菌活性高于孔雀石綠的化合物,為研制新型抗致病菌ESKAPE的藥物提供了基礎。
ESKAPE; 孔雀石綠; 抗菌活性; 細胞毒性
細菌感染已成為嚴重危害人類健康的重大疾病之一,特別是耐藥菌的出現,已成為當代醫學的一個棘手難題。新型抗生素的研發是全球藥物研究領域的重要方向。目前,存在 6 種耐藥性嚴峻的細菌,稱為 ESKAPE 病原菌,分別是屎腸球菌()、金黃色葡萄球菌()、肺炎克雷伯菌()、鮑曼不動桿菌()、銅綠假單胞菌()及腸桿菌屬()[1-2]。在全球范圍內,ESKAPE 耐藥已成為導致患者發病及死亡的重要原因之一[3-4]。因此,探索開發新型 ESKAPE 抑制藥物具有重要的意義。
孔雀石綠(malachite green,MG)是一種人工合成的-甲基化二氨基三苯基甲烷類染料,化學式為 C23H25ClN2,結構式見圖 1[5-7]。研究發現,孔雀石綠具有抗菌活性,其對防治水霉病等有特效,因此,許多國家將其用作水產養殖中的殺菌劑[8]。文獻報道 MG 主要通過兩種途徑實現抗菌,一種為抑制 mRNA 與核糖體的結合,另一種為抑制拓撲異構酶 II 的功能[9]。但對其系統的抗菌活性及抗菌譜研究尚未見報道。與此同時,研究發現孔雀石綠具有潛在的致癌、致畸作用[10-11]。其毒性作用機制之一是通過嵌入 DNA 生成加合物,抑制人體谷胱甘肽-S-轉移酶的活性,造成脂質過氧化,使細胞凋亡[12]。
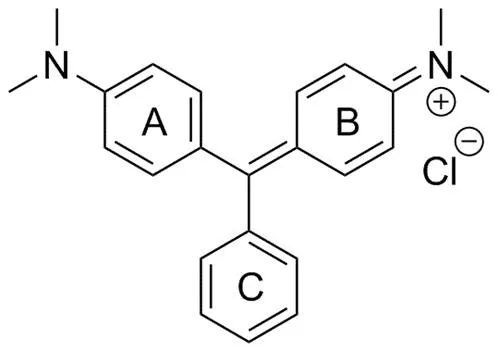
圖 1 孔雀石綠結構式
Figure 1 Structural formula of malachite green
本文首次對 MG 抗病原菌 ESKAPE 能力進行系統評價,而后以 MG 為先導化合物,對其 C 環進行結構改造及修飾,設計、合成 13 個 MG 類似物,并對此類化合物進行了系統的抗病原菌 ESKAPE 的活性及其細胞毒性研究,初步探索了構效關系,為后續研發具有更好抑菌活性及低毒性的新型抗致病菌ESKAPE藥物提供一定的借鑒作用。
1 材料與方法
1.1 材料
1.1.1 菌種 金黃色葡萄球菌(ATCC 33592)、糞腸球菌(CICC 10840)、屎腸球菌(ATCC 29212)、表皮葡萄球菌(ATCC 12228)、肺炎克雷伯菌(ATCC 700603)、鮑曼不動桿菌(CICC 22933)、銅綠假單胞菌(ATCC 27853)、陰溝腸桿菌(ATCC 13047)、大腸埃希菌(ATCC 25922)均購自美國菌種保藏中心(ATCC)或中國工業微生物菌種保藏管理中心(CICC);枯草芽孢桿菌(CTCC 63501)由中國醫學科學院藥物研究所朱平研究員課題組提供。
1.1.2 主要儀器及試劑 ECZ-400MHz 和 ECZ-500MHz 型核磁共振儀為日本電子株式會社產品;Avance-III HD-600MHz 型核磁共振儀為德國 Bruker 公司產品;Exactive plus 型液質聯用儀和 Nicolet 6700 型傅立葉紅外光譜儀為美國 Themo Fisher 公司產品;MP-J3 型熔點儀為日本 Yanaco 公司產品;Tecan SparkTM型酶標儀為瑞士 Tecan 公司產品;所用試劑均為市售分析純或化學純。
1.2 方法
1.2.1 目標化合物的合成 以芳香醛為原料,在 Lewis 酸作用下與,-二甲基苯胺縮合得到中間體 2,隨后中間體 2 與四氯苯醌在乙酸乙酯條件下發生氧化反應得到目標產物。對收率影響最大的是第一步縮合反應,本文以中間體 2a 為例,采用不同的 Lewis 酸和溶劑(圖 2)對其反應條件進行探索,以尋找高收率、低成本、后處理簡便的反應路線。
1.2.2 抑菌活性測試 參照 CLSI 標準,采用微量肉湯稀釋法進行藥敏實驗[13]。試驗菌用 MH 肉湯增菌,藥液用 MH 肉湯二倍稀釋成各種所需濃度于 96 孔板中,每孔 100 μl。各孔中藥液的終濃度分別為 100、50、25…… 0.390625 和 0.1953125 μmol/L。依次接種試驗菌(接種量約為5 × 105CFU/ml),置 37 ℃恒溫培養 18 h 后觀察結果,無菌生長的孔中所含藥物最小的濃度即為最低抑菌濃度(MIC)。
1.2.3 細胞毒性實驗 利用 MTS 法對 13 個目標化合物進行細胞活性評價,評價的細胞有大鼠成肌細胞 L6、人腎上皮細胞 293A、小鼠巨噬細胞 Raw 264.7 和人肝癌細胞 HepG2。在 96 孔板中接種細胞懸液,100 μl/孔,細胞密度為 3 × 104個/ml,37 ℃,5% CO2細胞培養箱中過夜,待細胞貼壁后用5 個濃度梯度的目標化合物處理,并設陰性對照組(加入空白溶劑),在上述條件下培養 72 h,加入 MTS 溶液(1.90 mg/ml)20 μl,在細胞培養箱中繼續培養 4 h,用酶聯免疫檢測儀 490 nm 處測得吸光度值,計算 IC50。
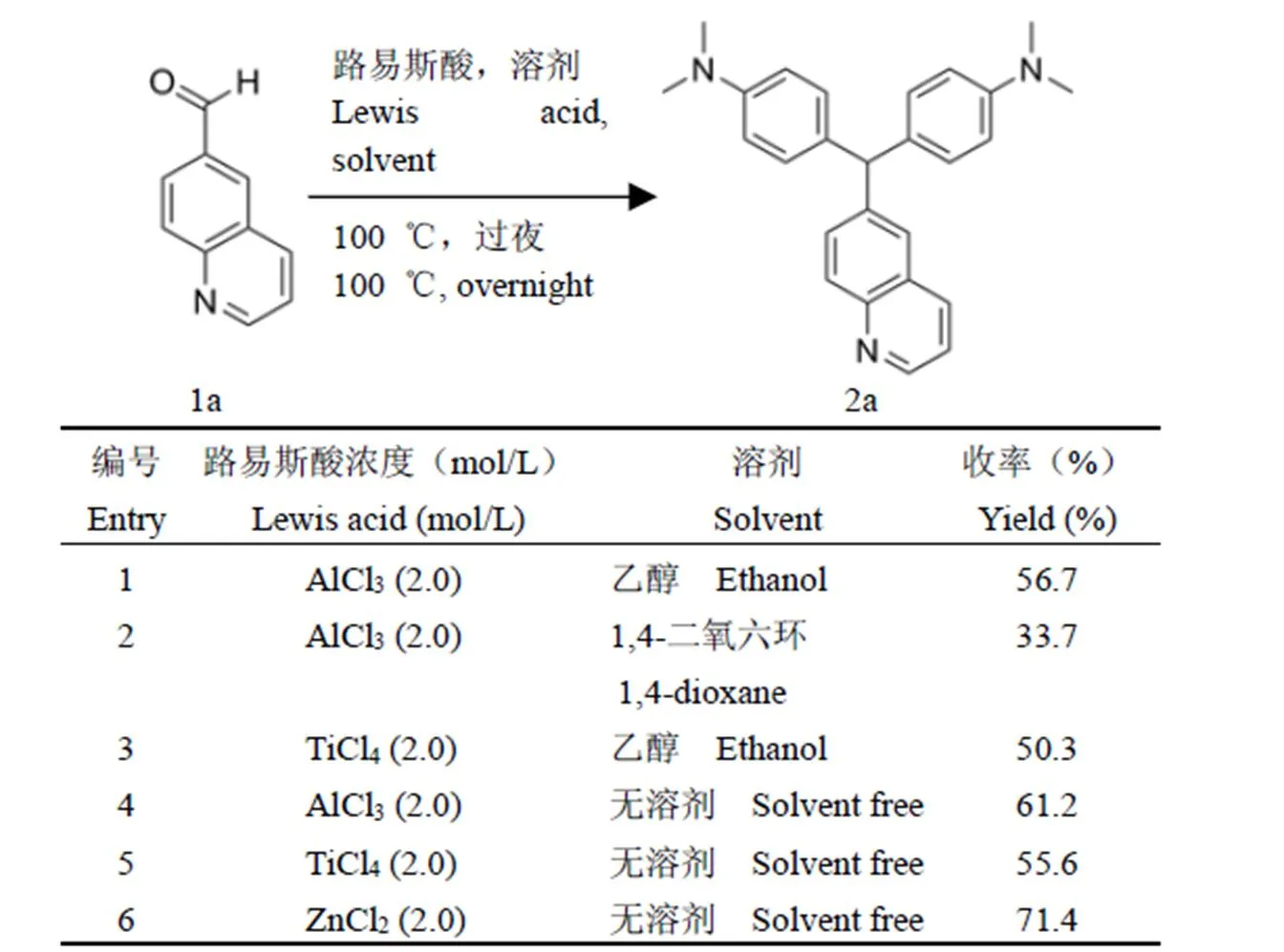
圖 2 中間體 2a 合成反應條件的優化
Figure 2 Optimization of reaction conditions
2 結果
2.1 目標化合物的合成
研究發現,選用相對弱的 Lewis 酸(無水 ZnCl2)和無溶劑的條件時,收率較高,經濟環保,后處理簡便,具有綠色化學的優點。通過兩步反應合成目標化合物 3a ~ 3m,共計 13 個(圖3)。結構均經1H-NMR、13C-NMR 和 HRMS 確證。
2.1.1 4-[(4--二甲基苯基)(6-喹啉)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3a) 深綠色固體,收率 61.5%,mp:128 ~ 130 ℃。1H-NMR(400 MHz,CDCl3):9.06(s,1H,-Ar),8.40(d,= 8.4 Hz,1H,-Ar),8.24(d,= 8.8 Hz,1H,-Ar),7.93(s,1H,-Ar),7.62(d,= 8.8 Hz,1H,-Ar),7.59(t,= 8.4 Hz,1H,-Ar),7.40(d,= 9.2 Hz,4H,-Ar),6.99(d,= 9.2 Hz,4H,-Ar),3.39(s,12H,-CH3);13C-NMR(151 MHz,CDCl3):175.03,156.88,140.60,139.62,138.22,135.67,135.59,131.91,128.94,128.25,127.06,127.00,114.05,41.23。IR(KBr):2923,2857(C-H),1681(C=N),1610,1581,1477,1456(C=C),831,728(C-H)cm-1。HRMS(m/z)(M+):計算值 C26H26N3+:380.2120,測定值 380.2121。
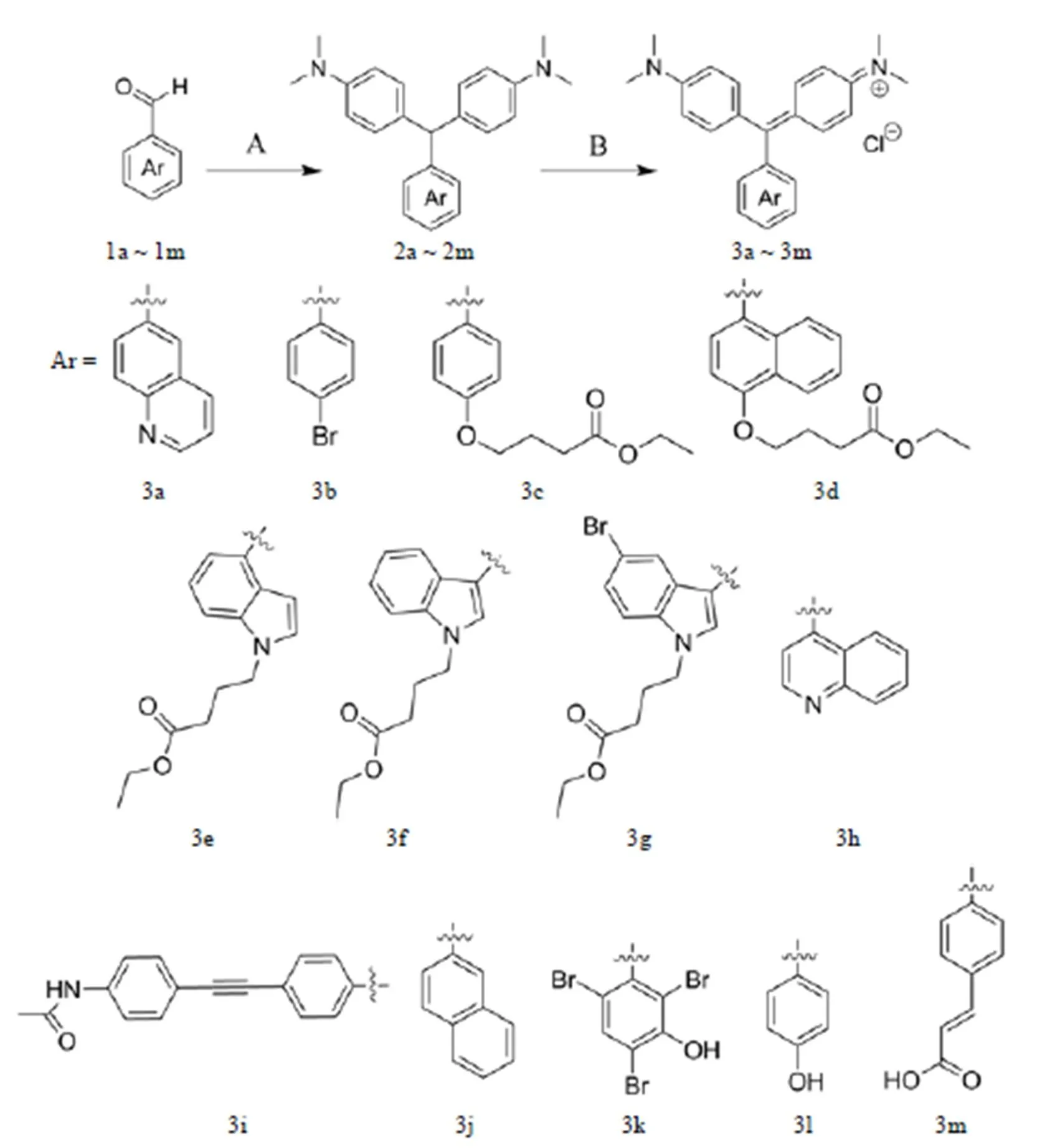
圖 3 化合物 3a ~ 3m 的合成路線(A:N,N-二甲基苯胺,氯化鋅,100 ℃,過夜;B:四氯苯醌,乙酸乙酯,80 ℃,8 h)
Figure 3 Synthetic routes of 3a ~ 3m (A:,-dimethylaniline, ZnCl2, 100℃, overnight; B: Tetrachloro--benzoquinone, ethylacetate, 80 ℃, 8 h)
2.1.2 4-[(4--二甲基苯基)(4-溴苯基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3b) 深綠色固體,收率 76.5%,mp:148 ~ 150 ℃。1H-NMR(400 MHz,CDCl3):7.68(d,= 8.0 Hz,2H,-Ar),7.52(d,= 8.8 Hz,1H,-Ar),7.35(d,= 9.2 Hz,4H,-Ar),7.19(d,= 8.0 Hz,1H,-Ar),6.98(d,= 9.2 Hz,4H,-Ar),3.38(s,12H,-CH3);13C-NMR(151 MHz,CDCl3):175.03,156.88,140.60,139.62,138.22,135.67,135.59,131.91,128.94,128.25,127.06,127.00,114.05,41.23。IR(KBr):2921,2851(C-H),1615,1582,1476(C=C),834(C-H)cm-1。HRMS(m/z)(M+):計算值 C23H24N2Br+:407.1119,測定值 407.1117。
2.1.3 4-[(4--二甲基苯基)(4-(4-乙氧基-4-氧代丁氧基)苯基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3c) 深綠色固體,收率 69.2%,mp:151 ~ 153 ℃。1H-NMR(400 MHz,CDCl3):7.36(d,= 8.8 Hz,4H,-Ar),7.30(d,= 8.8 Hz,2H,-Ar),7.06(d,= 8.8 Hz,2H,-Ar),6.95(m,= 9.2 Hz,4H,-Ar),4.17(m,4H,-CH2-),3.56(s,12H,-CH3),2.56(t,= 7.2 Hz,2H,-CH2-),2.20(m,2H,-CH2-),1.28(t,= 7.2 Hz,3H,-CH3)。13C-NMR(125 MHz,CDCl3):178.03,173.24,164.23,156.81,143.70,140.92,137.93,131.93,127.44,119.57,115.11,113.82,67.70,60.83,41.36,30.80,24.58,14.47。HRMS(m/z)(M+):計算值 C29H35O3N2+:459.2642,測定值 459.2631。
2.1.4 4-[(4--二甲基苯基)(1-(4-乙氧基-4-氧代丁氧基)萘基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3d) 紫色固體,收率 90.5%,mp:111 ~113 ℃;1H-NMR(400 MHz,CDCl3):8.35(d,= 8.4 Hz,1H,-Ar),7.47(d,= 8.0 Hz,1H,-Ar),7.38 ~ 7.34(m,4H,-Ar),7.31(m,2H,-Ar),6.96(m,2H,-Ar),6.9(d,= 8.8 Hz,4H,-Ar),4.36 ~ 4.33(t,= 6.0 Hz,2H,-CH2-),4.21 ~ 4.16(m,2H,-CH2-),3.35(s,12H,-CH3),2.68 ~ 2.65(t,= 7.2 Hz,2H,-CH2-),2.37 ~ 2.31(m,2H,-CH2-),1.28(t,= 7.2 Hz,3H,-CH3)。13C-NMR(150 MHz,CDCl3):176.0,173.0,158.9,156.8,143.5,140.2,136.0,134.9,129.9,128.5,128.1,126.1,125.9,125.6,122.6,119.3,113.8,104.2,67.7,60.6,41.1,30.9,24.5,14.2。HRMS(m/z)(M+):計算值C33H37O3N2+:509.2799,測定值509.2796。
2.1.5 4-[(4--二甲基苯基)(4-(4-乙氧基-4-氧代丁基)一氫吲哚基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3e) 紫色固體,收率 80%,mp:107 ~ 109 ℃。1H-NMR(400 MHz,CDCl3):7.69 ~ 7.67(d,= 8.0 Hz,1H,-Ar),7.41 ~ 7.39(d,= 8.8 Hz,4H,-Ar),7.35 ~ 7.31(m,1H,-Ar),7.14 ~ 7.13(m,1H,-Ar),7.06 ~ 7.04(m,1H,-Ar),6.91 ~ 6.89(d,= 8.8 Hz,4H,-Ar),5.77(d,= 2.8 Hz,1H,-Ar),4.29 ~ 4.25(t,= 7.2 Hz,2H,-CH2-),4.18 ~ 4.11(m,2H,-CH2-),3.35(s,12H,-CH3),2.38 ~ 2.34(m,2H,-CH2-),2.22 ~ 2.18(m,2H,-CH2-),1.27(t,= 7.2 Hz,3H,-CH3)。13C-NMR(125 MHz,CDCl3):177.89,172.95,156.89,140.92,136.38,131.84,131.78,130.60,128.71,127.86,121.38,115.05,113.67,101.85,60.95,45.89,41.36,31.28,25.71,14.46。HRMS(m/z)(M+):計算值C31H36O2N3+:482.2802,測定值 482.2795。
2.1.6 4-[(4--二甲基苯基)(3-(4-乙氧基-4-氧代丁基)一氫吲哚基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3f) 紫色固體,收率 66.7%,mp:102 ~ 104 ℃。1H-NMR(400 MHz,CDCl3):8.14(s,1H,-Ar),7.63 ~ 7.61(d,= 9.2 Hz,1H,-Ar),7.47 ~ 7.45(m,4H,-Ar),7.38 ~ 7.34(m,1H,-Ar),7.18 ~ 7.12(m,2H,-Ar),6.86 ~ 6.83(m,4H,-Ar),4.68 ~ 4.64(t,= 7.2 Hz,2H,-CH2-),4.12 ~ 4.06(m,2H,-CH2-),3.25(s,12H,-CH3),2.54 ~ 2.50(m,2H,-CH2-),2.33 ~ 2.30(m,2H,-CH2-),1.21(t,= 7.2 Hz,3H,-CH3)。13C-NMR(150 MHz,CDCl3):172.80,172.31,155.65,144.61,139.20,138.65,128.58,125.10,123.72,121.27,119.18,112.58,111.81,60.67,47.22,40.60,30.99,25.03,14.16。HRMS(m/z)(M+):計算值 C31H36O2N3+:482.2802,測定值 482.2793。
2.1.7 4-[(4--二甲基苯基)(3-(5-溴-1-(4-乙氧基- 4-氧代丁基))一氫吲哚基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3g) 紫色固體,收率 74%,mp:128 ~ 130 ℃。1H-NMR(400 MHz,CDCl3):8.21(s,1H,-Ar),7.55 ~ 7.53(d,= 8.4 Hz,1H,-Ar),7.44 ~ 7.42(m,5H,-Ar),7.22(m,1H,-Ar),6.86 ~ 6.83(m,4H,-Ar),4.69 ~ 4.66(t,= 7.6 Hz,2H,-CH2-),4.10 ~ 4.05(m,2H,-CH2-),3.26(s,12H,-CH3),2.54 ~ 2.50(m,2H,-CH2-),2.30 ~ 2.26(m,2H,-CH2-),1.21(t,= 7.2 Hz,3H,-CH3)。13C-NMR(150 MHz,CDCl3):172.86,171.70,155.93,144.89,139.32,137.30,130.08,127.79,123.71,119.71,117.88,117.12,113.32,112.74,60.65,47.28,40.64,30.90,25.05,14.16。HRMS(m/z)(M+):計算值C31H35O2N3Br+:560.1907,測定值 560.1902。
2.1.8 4-[(4--二甲基苯基)(4-喹啉)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3h) 深綠色固體,收率 83.7%,mp:130 ~ 132 ℃。1H-NMR(400 MHz,CDCl3):9.06 ~ 9.05(m,1H,-Ar),8.25 ~ 8.24(d,= 8.5 Hz,1H,-Ar),7.78 ~ 7.75(m,1H,-Ar),7.48 ~ 7.46(m,1H,-Ar),7.45 ~ 7.38(m,4H,-Ar),7.31 ~ 7.30(m,2H,-Ar),6.99 ~ 6.97(m,4H,-Ar),3.40(s,12H,-CH3)。13C-NMR(125 MHz,CDCl3):169.12,157.22,149.55,148.45,145.83,143.86,139.92,137.60,130.53,130.20,128.33,27.68,127.39,125.75,124.13,119.84,114.94,112.89。HRMS(m/z)(M+):計算值 C26H26N3+:380.2121,測定值 380.2121。
2.1.9 4-[(4--二甲基苯基)(4-((4-乙酰氨基苯基)乙炔基)苯基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3i) 深綠色固體,收率 86.2%,mp:158 ~ 160 ℃。1H-NMR(400 MHz,Methanol-d):7.72(d,= 8.4 Hz,2H,-Ar),7.66(d,= 8.8 Hz,2H,-Ar),7.53(d,= 8.8 Hz,2H,-Ar),7.46(d,= 9.6 Hz,4H,-Ar),7.41(d,= 8.8 Hz,2H,-Ar),7.09(d,= 9.6 Hz,4H,-Ar),3.36(s,12H,-CH3),2.17(s,3H,-CH3)。13C-NMR(151 MHz,Methanol-d):177.37,171.61,158.40,145.52,141.67,140.83,140.40,135.88,133.35,132.27,129.61,128.25,121.33,120.62,118.72,114.72,94.65,88.93,40.83,23.82。IR(KBr):2928,2859(C-H),1679(C=O),1615,1582,1522,1476(C=C),1168(C-O-C),836(C-H)cm-1。HRMS(m/z)(M+):計算值 C33H32N3O+:486.2527,測定值 486.2540。
2.1.10 4-[(4--二甲基苯基)(2-萘基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3j) 深綠色固體,收率 91.8%,mp:165 ~ 167 ℃。1H-NMR(500 MHz,Methanol-d):8.04(t,= 8.0 Hz,2H,-Ar),7.98(d,= 8.5 Hz,1H,-Ar),7.94(s,1H,-Ar),7.72(t,= 7.5 Hz,1H,-Ar),7.64(t,= 8.0 Hz,1H,-Ar),7.47(d,= 9.0 Hz,4H,-Ar),7.44(d,= 8.5 Hz,1H,-Ar),7.07(d,= 9.0 Hz,4H,-Ar),3.35(s,12H,-CH3)。13C-NMR(151 MHz,Methanol-d):178.98,158.39,141.88,138.41,137.50,136.67,133.82,131.19,130.33,130.15,129.11,128.82,128.63,128.41,114.67,40.80。IR(KBr):2925,2859(C-H),1613,1581,1476,1434(C=C),829,758(C-H)cm-1。HRMS (m/z)(M+):計算值 C27H27N2+:379.2159,測定值 379.2169。
2.1.11 4-[(4--二甲基苯基)(2,4,6-三溴-3-羥基苯基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3k) 深綠色固體,收率 77.5%,mp:195 ~197 ℃。1H-NMR(400 MHz,Methanol-d):7.91(s,1H,-Ar),7.47(d,= 9.2 Hz,4H,-Ar),7.03(d,= 9.6 Hz,4H,-Ar),3.33(s,12H,-CH3)。13C-NMR(151 MHz,Methanol-d):171.42,158.37,141.39,140.29,136.23,126.37,115.68,114.94,114.37,41.01,30.62。IR(KBr):2921,2851(C-H),1615,1582,1476(C=C),828,797,717(C-H)cm-1。HRMS(m/z)(M+):計算值 C23H22ON2Br3+:578.9265,測定值 578.9277。
2.1.12 4-[(4--二甲基苯基)(4-羥基苯基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3l) 深綠色固體,收率 75%,mp:147 ~ 149 ℃。1H-NMR(400 MHz,CDCl3):7.45(d,= 8.8 Hz,2H,-Ar),7.35(d,= 8.8 Hz,4H,-Ar),7.18(d,= 8.8 Hz,2H,-Ar),6.84(d,= 8.8 Hz,4H,-Ar),3.29(s,12H,-CH3)。13C-NMR(151 MHz,CDCl3):180.86,167.79,156.12,141.04,140.66,139.17,129.33,126.91,117.85,113.30,112.54,40.86,40.63。IR(KBr):2921,2853(C-H),1581,1471(C=C),826(C-H)cm-1。HRMS(m/z)(M+):計算值C23H25ON2+:345.1963,測定值 345.1961。
2.1.13 4-[(4--二甲基苯基)(4-(2-羧基乙烯基)苯基)]亞甲基-2,5-環己二烯基-1--二甲基氯化胺(3m) 深綠色固體,收率 83.2%,mp:180 ~182 ℃。1H-NMR(400 MHz,Methanol-d):7.84(d,= 8.0 Hz,2H,-Ar),7.79(d,= 16 Hz,1H,-CH-),7.44(d,= 9.6 Hz,6H,-Ar),7.07(d,4H,= 9.6 Hz,-Ar),6.70(d,= 16 Hz,1H,-CH-),3.35(s,12H,-CH3)。13C-NMR(151 MHz,Methanol-d):177.30,169.51,158.46,144.22,142.40,141.69,140.23,136.19,129.04,128.31,122.57,114.76,40.83,30.62。IR(KBr):3364(-OH),2920,2851(C-H),1703(C=O),1615,1582,1554,1478(C=C),836(C-H)cm-1。HRMS(m/z)(M+):計算值C26H27O2N2+:399.2067,測定值399.2069。
2.2 抗菌活性評價
以 MG 作為對照,將合成的 13 個 MG 類似物分別進行抗致病菌活性評價,得到最小抑菌濃度(MIC)(表1)。測試細菌包括致病菌 ESKAPE 及糞腸球菌(),枯草芽孢桿菌(),表皮葡萄球菌(),大腸埃希菌(),其中金黃色葡萄球菌(ATCC 33592)為耐藥菌。實驗結果表明,MG 類化合物普遍對革蘭陽性菌有抑制作用,而對革蘭陰性菌無抑制作用。與先導化合物 MG 相比,設計合成的 13 個 MG 類似物中,3a和 3c 的抑菌活性與 MG 基本相當,3d ~ 3j 的抑菌活性相比 MG 略低;而 3m 基本無抑菌活性,其原因可能為 3m 引入的羧基為親水性基團,降低了化合物的脂溶性,使其不易進入細菌,抑菌活性降低。值得一提的是化合物 3b 對枯草芽孢桿菌的抗菌活性得到了明顯的提高,是 MG 的 4 倍以上。
2.3 細胞毒性測試
我們對 MG 及設計合成的 13 個 MG 類似物分別進行細胞 MTS 試驗。選擇 4 種細胞,其中包括 3 種正常細胞和 1 種癌細胞。正常細胞分別為大鼠成肌細胞(L6)、人腎上皮細胞(293A)和小鼠巨噬細胞(Raw 264.7);癌細胞為人肝癌細胞(HepG2),結果見表2。根據實驗結果,對比每種細胞的 IC50值,發現除 3i、3j 毒性與 MG 基本相同外,其余化合物的 IC50值均有提高。3a、3b 的 IC50值大約是 MG 的 2 倍;3c ~ 3e 的IC50值則是 MG 的 4 倍左右;3f ~ 3h 和 3k ~ 3m 的毒性均低于 MG,但相比于3f ~ 3h,3k ~ 3m 的抑菌能力較差。因此在保證抑菌能力的情況下含有吲哚或喹啉環的 3f ~ 3h 毒性最低,其中 3f 的 IC50值是 MG 的 10 倍以上。結果表明在結構中引入芳香雜環或雜原子基團時,毒性得到顯著降低。
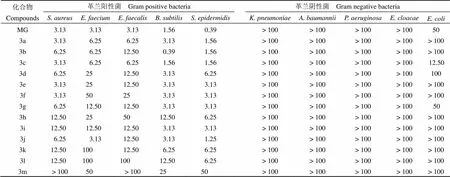
表 1 化合物 3a ~ 3m 的抗菌活性(MIC)(μmol/L)

表 2 化合物 3a ~ 3m 的細胞毒性 IC50(μmol/L)
3 討論
本文以 MG 為先導化合物,對其 C 環進行結構改造及修飾,設計并合成 13 個 MG 類似物。在合成關鍵中間體 2 的過程中采用了綠色環保的無溶劑反應策略,不僅后處理簡便,而且收率較高。系統評價該類化合物抗致病菌 ESKAPE 活性及細胞毒性表明,MG 類化合物作為抑菌劑,普遍對革蘭陽性菌有抑制作用,而對革蘭陰性菌無效。與先導化合物 MG 相比,化合物 3b 對枯草芽孢桿菌的抗菌活性提高了 4 倍以上。而除引入親水基團的 3k ~ 3m 外,多數化合物的抑菌活性與 MG 相當。因此,此類化合物的抗菌活性可能與細胞膜的通透性有關,所以增強水溶性而降低了脂溶性導致其抑菌活性降低。再對比這些化合物的細胞毒性發現,將 C 環替換為芳香雜環(吲哚或喹啉環)時,可以有效降低毒性,有可能是增大位阻不易嵌入 DNA 從而毒性降低。而引入鹵素或羧基等基團時,毒性也得到明顯降低。其中化合物 3f 與 MG 具有類似抗菌活性但細胞毒性顯著降低,因而有待更深層次的研究。本文通過對 MG 類化合物進行抗菌活性和細胞毒性研究,初步探索了其構效關系,為之后發現具有更好抗致病菌 ESKAPE 活性和更低毒性的藥物提供一定的借鑒意義。
[1] Santajit S, Indrawattana N. Mechanisms of antimicrobial resistance in ESKAPE pathogens. Biomed Res Int, 2016, 2016:2475067.
[2] Pendleton JN, Gorman SP, Gilmore BF. Clinical relevance of the ESKAPE pathogens. Expert Rev Anti Infect Ther, 2013, 11(3):297- 308.
[3] Boucher HW, Talbot GH, Bradley JS, et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. Clin Infect Dis, 2009, 48(1):1-12.
[4] Zhang Q, Wang Q, Xu S, et al. Aminoglycoside-based novel probes for bacterial diagnostic and therapeutic applications. Chem Commun (Camb), 2017, 53(8):1366-1369.
[5] Alderman DJ. Malachite green: a review. J Fish Dise, 1985, 8(3):289- 298.
[6] Banaei N, Kincaid EZ, Lin SY. Lipoprotein processing is essential for resistance of Mycobacterium tuberculosis to malachite green. Antimicrob Agents Chemother, 2009, 53(9):3799-3802.
[7] Ferreira K, Hu HY, Fetz V, et al. Multivalent siderophore-DOTAM conjugates as theranostics for imaging and treatment of bacterial infections. Angew Chem Int Ed Engl, 2017, 56(28):8272-8276.
[8] Foster FJ, Woodbury L. The use of malachite green as a fish fungicide and antiseptic. Prog Fish Cult, 1936, 3(18):7-9.
[9] Boulos RA, Man NY, Lengkeek NA, et al. Inspiration from old dyes: tris(stilbene) compounds as potent gram-positive antibacterial agents.Chemistry, 2013, 19(52):17980-17988.
[10] Culp SJ, Beland FA. Malachite green: a toxicological review. IntJ Toxicol, 1996, 15(3):219-238.
[11] Srivastava S, Sinha R, Roy D. Toxicological effects of malachite green. Aquat Toxicol, 2004, 66(3):319-329.
[12] Rao KV. Inhibition of DNA synthesis in primary rat hepatocyte cultures by malachite green: a new liver tumor promoter. Toxicol Lett,1995, 81(2-3):107-113.
[13] Ren JF, Meng JZ, Zhao Y, et al. Design, synthesis and evaluation of novel acylhydrazone schiff base derivatives as potent antituberculosis agents. Chin Med Biotechnol, 2017, 12(3):201-206. (in Chinese)
任金鳳, 蒙建州, 趙躍, 等. 新型酰腙席夫堿類化合物的設計、合成及抗結核活性研究. 中國醫藥生物技術, 2017, 12(3):201-206.
Synthesis and bioactivities of new malachite green derivatives
JI Yu-bin, SUN Ying, ZHANG Qing-yang, WANG Qing-hua, HU Hai-yu
Author Affiliations: School of Life and Environment Sciences, Harbin University of Commerce, Harbin 150076, China (JI Yu-bin, SUN Ying); State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Beijing Key Laboratory of Active Substance Discovery and Druggability Evaluation, Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (ZHANG Qing-yang, WANG Qing-hua, HU Hai-yu)
In order to obtain more active antibacterial agents, 13 malachite green (MG) analogues were synthesized by modification the C ring of skeletal structure of MG. Biological activities of these MG analogues were evaluated in antibacterial pathogens assays and cytotoxicity assays.
Compounds were synthesized from aromatic aldehydes, via condensation reactions and oxidation reactions. The structure were confirmed by1H-NMR,13C-NMR and HRMS. The MICs of antibacterial activity was assayed by standard broth microdilution method. The cytotoxicity of the target compounds was tested by cellular proliferation (MTS).
Thirteen novel MG compounds were synthesized, among which some compounds were found to have anti-gram positive bacteria activity. Specifically, the activities of compound 3b (MIC = 0.39 μmol/L) againstwas four folds stronger than that of the lead compound MG (MIC = 1.56 μmol/L). The cytotoxicity of compound 3f was decreased by 10 times than that of the compound MG.
13 new malachite green derivatives were designed and synthesized. The biological activity were evaluated, and the compounds with higher antibacterial activity than malachite green were screened out, which provided the basis for the development of new anti-pathogenic bacteria "ESKAPE".
ESKAPE; Malachite green; Antimicrobial activity; Cytotoxicity
: WANG Qing-hua, Email: wangqinghua@imm.ac.cn; HU Hai-yu, Email: haiyu.hu@imm.ac.cn
中國醫學科學院醫學與健康科技創新工程(2017-I2M-2-004)
王慶華,Email:wangqinghua@imm.ac.cn;胡海宇,Email:haiyu.hu@imm.ac.cn
2017-11-03
10.3969/j.issn.1673-713X.2018.01.006

