鼠神經生長因子對原發性閉角型青光眼小梁切除術后視神經的保護作用及安全性
張建峰,張 恒,王立肖
青光眼是一種表現為視野缺損、視神經萎縮為主要特征的進展性退化疾病,也是引起致盲的主要疾病[1],其主要是通過損害視野及視神經致盲。目前對于視神經損害的原因尚未完全闡明,可能與神經毒素產生、低血流灌注引起缺血、缺氧、高眼壓、炎性反應等有關[2-3]。目前臨床注重眼壓對視神經的損害,主要通過手術或藥物降低眼壓,其中小梁切除術是最主要的手術方式,可有效控制眼壓[4]。但是研究發現盡管通過一系列措施控制眼壓后,仍會發生視野的損傷,最終發展為失明[5]。故對于青光眼視神經的保護已成為臨床關注的熱點。鼠神經生長因子是一種神經細胞生長調節因子,具有促進神經元生長、發育、分化、再生的作用,在視神經炎、視網膜脫離、視網膜損傷等眼科疾病中逐漸應用[6-7]。本研究通過探討鼠神經生長因子對原發性閉角型青光眼小梁切除術后視神經的保護作用及安全性,旨在為青光眼治療提供理論依據。現報告如下。
1 材料與方法
1.1病例選擇標準 納入標準:①均經眼科輔助檢查確診為原發性閉角型青光眼,符合小梁切除術手術治療指征;②無合并其他眼部疾病者。排除標準:①高度近視者;②存在認知、閱讀及聽寫障礙者;③屬于惡性青光眼或合并脈絡膜脫離、前房出血等術后嚴重并發癥者;④術后眼壓波動較大者。
1.2臨床資料 對寶雞市人民醫院眼科2015年1月—2017年6月收治的擇期行小梁切除術治療的原發性閉角型青光眼86例的臨床資料進行回顧性分析,根據治療方式分為觀察組和對照組,每組43例。觀察組男20例,女23例,年齡48~75(52.89±4.56)歲,均為單眼發病,其中左眼24例,右眼19例。對照組男19例,女24例,年齡48~75(52.89±4.56)歲,均為單眼發病,其中左眼25例,右眼18例。兩組性別、年齡等方面比較差異無統計學意義(P>0.05),具有可比性。
1.3方法 均在術前給予藥物將眼壓降為正常。將0.75%布比卡因和2%利多卡因等量混合進行球周麻醉后,均由同一組副主任醫師及以上級別醫師操作常規行穿透性小梁切除術。觀察組術后給予鼠神經生長因子(生物制藥股份有限公司,國藥準字S20060023)20 μg與2 ml注射用水混合液臀大肌注射,1/d。對照組給予甲鈷胺片(揚子江藥業集團南京海陵藥業有限公司,國藥準字H20052325)0.5 mg口服,3/d。兩組均治療1個月。
1.4觀察指標
1.4.1視力檢查:通過國際標準對數視力表對所有患者手術前后及治療后1個月復查最佳視力進行記錄,視力經LogMAR轉換后進行統計。
1.4.2眼壓檢測:應用日本SHIN-NIPPON NCT-200非接觸式眼壓計對患者手術前后及治療后1個月眼壓進行檢測,每天在不同時間段檢測3次,取平均值。
1.4.3視野檢查:通過北京科思佳科技有限責任公司生產的K508682型全自動視野計對患者手術前后及治療后1個月平均視敏度值(MS)、平均缺損值(MD)進行檢測。所有患者在瞳孔放松、暗室條件下選取中心30度的視野范圍、標準模式進行檢測。對于測試結果可信度<80%,假陽性率>33%,固視丟失率>20%者再次檢測,選取符合標準的結果。
1.4.4電生理檢查:應用國特GT2000NV視覺電生理檢測儀對治療前、治療后1個月對P100波潛伏期和波幅等電生理參數進行檢測。
1.4.5生化指標檢測:分別于手術前后、治療后1個月清晨抽取靜脈血,2500 r/min,高速離心約10 min,留取上清液,放入冷藏室待測。通過放射免疫法對內皮素-1(ET-1)進行檢測,一氧化氮(NO)通過硝酸還原酶法進行檢測。
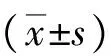
2 結果
2.1視力和眼壓 兩組手術前后及治療后1個月視力和眼壓比較差異無統計學意義(P>0.05)。觀察組應用鼠神經生長因子治療1個月后視力高于手術后(P<0.05);對照組應用鼠神經生長因子治療后1個月復查視力與手術后比較差異無統計學意義(P>0.05)。兩組手術后及治療后1個月眼壓與手術前比較差異均無統計學意義(P>0.05)。見表1。
2.2視野MS、MD 兩組手術前后及治療后1個月MS、MD比較差異無統計學意義(P>0.05)。兩組手術后及治療后1個月復查MS均高于手術前,治療1個月后MS高于手術后,且觀察組高于對照組(P<0.05,P<0.01)。觀察組手術后及治療后1個月復查MD均低于手術前,且治療后1個月復查MD低于手術后,且觀察組低于對照組(P<0.05,P<0.01),對照組手術后及治療后1個月復查MD與手術前比較差異無統計學意義(P>0.05)。見表2。
2.3P100振幅及潛伏期 兩組手術前P100振幅及潛伏期比較差異均無統計學意義(P>0.05)。兩組手術后及治療后1個月復查P100振幅均高于手術前,且觀察組高于對照組(P<0.05,P<0.01);兩組治療后1個月復查P100振幅與手術后比較差異無統計學意義(P>0.05)。兩組手術后及治療后1個月復查P100潛伏期均低于手術前,且治療1個月后低于手術后,觀察組低于對照組(P<0.05,P<0.01)。見表3。
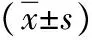
表1 兩組原發性閉角型青光眼治療前后視力和眼壓比較
注:兩組均給予小梁切除術,觀察組術后給予鼠神經生長因子,對照組給予甲鈷胺口服;與手術后比較,aP<0.05

表2 兩組原發性閉角型青光眼治療前后視野比較
注:兩組均給予小梁切除術,觀察組術后給予鼠神經生長因子,對照組給予甲鈷胺口服;與手術前比較,aP<0.05;與手術后比較,cP<0.05
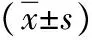
表3 兩組原發性閉角型青光眼治療前后P100振幅和潛伏期比較
注:兩組均給予小梁切除術,觀察組術后給予鼠神經生長因子,對照組術后給予甲鈷胺口服;與治療前比較,aP<0.05,與手術后比較,cP>0.05
2.4ET-1、NO水平 兩組手術前ET-1、NO水平比較差異無統計學意義(P>0.05)。兩組手術后及治療后1個月ET-1水平均低于手術前,NO水平高于手術前,且觀察組改善程度優于對照組(P<0.05,P<0.01)。見表4。
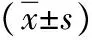
表4 兩組原發性閉角型青光眼治療前后內皮素-1和一氧化氮水平比較
注:兩組均給予小梁切除術,觀察組術后給予鼠神經生長因子,對照組術后給予甲鈷胺口服;與手術前比較,aP<0.05
2.5不良反應發生情況 兩組均未發生嚴重不良反應,觀察組有3例注射部位出現紅、痛,經熱敷或一段時間內自行緩解。
3 討論
目前臨床主要公認為機械學說、血流學說是引起青光眼發病的主要機制[8],其中機械學說主張高眼壓是引起青光眼發生的主要因素,當眼壓升高時,可對視神經纖維造成擠壓,最終引起細胞代謝受損發生死亡[9-10]。研究報道,軸漿阻滯、高眼壓和特定的視野缺損存在密切關系,眼壓持續升高在青光眼發生過程中有重要意義,故認為降眼壓是治療青光眼的重要步驟[11]。但是隨著研究的深入,學者們發現有部分眼壓高出正常者,但未發生青光眼視野缺損和視神經損害,也有少部分出現青光眼視野缺損和視神經損害的患者但是眼壓屬于正常范圍及通過手術或藥物控制眼壓正常者,也會發生視神經損害或視野缺損,可表明機械學說不能包括青光眼所有發病機制[12-13]。血流學說主張視神經的血流異常是引起視神經損害的重要原因,很多研究證實,視網膜缺血可引起視網膜神經節細胞發生原位死亡,而視網膜缺血主要由于視神經乳頭局部灌注不足或眼壓升高導致[14]。有學者發現原發性開角型青光眼患者視神經表層血流顯著少于正常眼壓性青光眼患者,其紅細胞黏度較高,最大頻移可降低40%,可見青光眼患者伴有視神經微循環受累[15-16]。不同的致病機制可能引起視野缺損的不同,但是被證實神經節細胞的損傷是其視神經損害的共同病理基礎[17]。
ET-1主要由中樞神經系統內皮細胞所分泌,在ET中約占1/4。ET-1具有收縮血管,調節腦血流的作用[18],其收縮血管強度的作用是神經肽Y、血管加壓素、血管緊張素Ⅱ的10倍,常參與各種炎性反應,研究報道原發性閉角型青光眼患者中的血漿ET-1水平高于正常眼壓性青光眼患者[19]。ET-1可通過收縮眼部微血管引起局部組織缺血缺氧,進而誘導視網膜神經節細胞的凋亡。NO也是內皮源性血管活性因子,對血管內皮細胞舒縮平衡具有調節作用,也是調節器官血流的重要因子。研究報道,NO可促使小梁網松弛而增加眼房水循環,從而起到降低眼內壓的作用[20]。ET-1與NO平衡對于視網膜循環至關重要,一旦失衡可引起局部缺血發生視神經的損害。故目前以視網膜神經節細胞為靶點的視網膜保護,已成為治療青光眼的突破口[21]。
鼠神經生長因子是一種重要的神經營養因子,其是由國外學者首次從小鼠頜下腺中提取而得,具有促進軸突、樹突發育,神經纖維定向生長及促進血旺細胞和膠質細胞生長、神經元的分裂、分化和修復作用,還可保護神經元受繼發損害[22]。可能與其是由神經、神經元支配靶組織或膠質細胞生成能促進神經元生長、再生、發育等功能特征性表達活性蛋白質相關[23]。本研究結果顯示,觀察組治療后1個月復查視野MS、視覺誘發電位振幅、血清NO水平均高于對照組,視野MD、視覺誘發電位潛伏期和血漿ET-1水平低于對照組,而兩組治療各時段眼壓比較差異無統計學意義,提示在眼壓控制較好的青光眼患者中應用外源性的鼠神經生長因子可有效促進原發性閉角型青光眼小梁切除術后視神經功能的恢復[24]。王紅艷等[25]研究結果顯示,鼠神經生長因子組MS水平較對照組高,MD水平較對照組低。本研究結果與其報道一致。
綜上所述,鼠神經生長因子可能存在一種長效機制,治療后1個月仍可持續改善原發性閉角型青光眼小梁切除術后患者的電生理參數、視力、視野等,其可有效促進原發性閉角型青光眼小梁切除術后視神經功能的恢復,安全可靠。鼠神經生長因子對視神經的保護作用可能與抑制ET-1水平、升高NO水平相關。
[1] 劉艷艷,余涵.原發性急性閉角型青光眼患者持續高眼壓狀態下行復合式小梁切除術療效分析[J].新鄉醫學院學報,2015,32(2):160-162.
[2] 吳仁毅,黃昌泉,呂潔璇,等.神經生長因子凝膠對青光眼視神經保護的初步臨床評價[J].國際眼科雜志,2015,15(2):255-258.
[3] 黨鴻,辛曉蓉.青光眼視神經損傷機制的研究進展[J].眼科新進展,2016,36(7):680-683.
[4] 劉勵,林胤,陳本安,等.原發性閉角型青光眼小梁切除術后行白內障超聲乳化聯合房角分離術的療效分析[J].東南國防醫藥,2017,19(1):51-53.
[5] 韓敬力,劉天榮,易湘龍.鼠神經生長因子聯合高壓氧治療視神經萎縮的療效[J].眼科新進展,2016,36(9):832-834.
[6] 沈惠芳,謝欣,楊文忠.注射用鼠神經生長因子多藥聯合治療對缺血性視神經病變的作用[J].中國醫院藥學雜志,2015,35(15):1412-1414.
[7] 劉靜雯,秦波.鼠神經生長因子對外傷性視神經病變治療作用的Meta分析[J].國際眼科雜志,2015,15(4):633-635.
[8] Hong J, Chen J, Yang Y,etal. Optical Coherence Tomography Assessment of Angle Anatomy Changes After Trabeculectomy in Primary Angle-Closure Glaucoma[J].J Glaucoma, 2016,25(3):244-246.
[9] 劉文文,姜濤,劉桂波,等.視神經挫傷患者經鼠神經生長因子治療前后視覺誘發電位變化[J].國際眼科雜志,2015,16(9):1612-1614.
[10] 畢宇,葛紅巖,劉平.不同手術方式對原發性閉角型青光眼合并白內障的療效分析[J].眼科新進展,2015,35(5):442-445.
[11] 高宏杰,李朋英.超聲乳化白內障吸除聯合小梁切除治療閉角型青光眼合并白內障的療效觀察[J].實用醫院臨床雜志,2015,41(2):113-115.
[12] 馮希敏,祁穎,張鳳妍,等.超聲乳化人工晶狀體植入聯合房角分離術治療急性原發性閉角型青光眼合并年齡相關性白內障患者的療效分析[J].眼科新進展,2016,36(8):767-769.
[13] 金尚麗,郭海科,郭瑞,等.OZIL模式超聲乳化聯合小梁切除術對白內障合并急性閉角型青光眼的療效與安全性[J].中國臨床研究,2015,28(8):1059-1061.
[14] 胡佩宏,劉新華,裴重剛,等.改良的扇形鞏膜瓣半隧道切口行復合小梁切除術治療原發性閉角型青光眼的臨床療效[J].眼科新進展,2016,36(8):738-741.
[15] 王麗麗,李達,楊陽,等.原發性閉角型青光眼高眼壓下復合式小梁切除術的療效[J].國際眼科雜志,2016,16(10):1937-1939.
[16] 廖輝,伍繼光.改良小梁切除術治療原發性閉角型青光眼患者的療效[J].國際眼科雜志,2016,16(9):1683-1686.
[17] 施國忠.小梁切除術聯合可調節縫線治療原發性閉角型青光眼的臨床療效[J].臨床眼科雜志,2016,24(1):64.
[18] 吳仁毅,黃昌泉,呂潔璇,等.神經生長因子凝膠對青光眼視神經保護的初步臨床評價[J].國際眼科雜志,2015,15(2):255-258.
[19] 董潔玉.鼠神經生長因子治療前部缺血性視神經病變的臨床療效[J].神經損傷與功能重建,2015,10(4):298-299.
[20] 黃勝,卿晨,楊秋林.原發性閉角型青光眼微創小梁切除術的設計及其臨床療效研究[J].湖南中醫藥大學學報,2016,26(1):393-393.
[21] 謝怡,黃麗娜.閉角型青光眼合并白內障兩種手術方式比較的Meta分析[J].國際眼科雜志,2015,15(9):1556-1559.
[22] 高陽,劉潔梅,張良.小梁切除聯合生物羊膜移植術治療原發性慢性閉角型青光眼效果分析[J].臨床眼科雜志,2015,23(2):166-168.
[23] Poon Y C, Lai I C, Lee J J,etal. Comparison of surgical outcomes after phacotrabeculectomy in primary angle-closure glaucoma versus primary open-angle glaucoma[J].Taiwan Journal of Ophthalmology, 2015,5(1):89-91.
[24] 梁冬梅.可調節縫線在原發性閉角型青光眼小梁切除術中的應用[J].廣東醫學,2016,37(2):154-155.
[25] 王紅艷,姜濤,劉文文,等.注射用鼠神經生長因子治療視神經挫傷的臨床療效觀察[J].山東醫藥,2015,59(33):42-43.

