人骨髓間充質干細胞復合兩種填充材料體外生物相容性的比較
侯亮+張揚+孫軼峰等

[摘要]目的:對比膨體聚四氟乙烯(expanded polytetraf luoroethylene,ePTFE)與硅膠的體外生物相容性,為臨床上ePTFE的廣泛應用提供實驗依據。方法:采用密度梯度離心法分離培養人骨髓間充質干細胞(human mesenchymal stem cells,hMSCs),取第3代細胞通過流式檢測、茜素紅和油紅0染色進行干細胞鑒定,將hMSCs分別與ePTFE和硅膠材料直接作用或與材料浸提液復合培養,觀察細胞黏附、生長及增殖情況,計算細胞黏附率,CCK-8比色法檢測細胞增殖。結果:成功分離培養hMSCs,形態上呈長梭形、紡錘狀、類成纖維細胞樣;流式檢測結果顯示第3代hMSCs高表達間充質干細胞表面標志物CD44(99.5%)、CD90(95.8%),低表達造血系細胞表面標志物CD45;且茜素紅和油紅0染色陽性;ePTFE組細胞黏附率(92.3%)明顯高于硅膠組細胞黏附率(76.8%)(P<0.05);若兩種材料直接作用培養后的細胞,隨時間延長ePTFE組和空白對照組細胞活性逐漸增加,仍可保持正常的分裂增殖速度(P>0.05),而硅膠組活細胞吸光值明顯低于ePTFE組(P<0.05)。結論:ePTFE體外生物相容性優于假體硅膠,較適合作為支架材料應用于組織工程的構建。
[關鍵詞]骨髓間充質干細胞;聚四氟乙烯;生物相容性;填充材料
[中圖分類號]R318 [文獻標志碼]A [文章編號]1008-6455(2017)07-0048-05
在整形外科領域,通過移植自體組織或埋置人工材料以達到治療或美容目的的填充類手術非常多見。填充物的理化性質、生物相容性以及體內長期穩定性等問題一直以來備受關注。自體組織最安全,組織相容性好,且不會產生排異,但其取之有限,因而并不能滿足所有的手術需求。臨床目前常用的填充材料主要是固體硅膠,隨著材料工藝水平的發展,雖然從形態、質地和組織相容性等方面較以往有了較大的改善,但其缺點是不能與機體建立起血液循環,后期可在其周圍形成一薄層纖維包膜,且偶見硅膠假體的體表透光現象,影響外觀效果。
膨體聚四氟乙烯(expanded polytetrafluoroethylene,ePTFE)是一種多孔高分子聚合材料,具有不變形、不變質、不產生炎性吸收反應等特點,可容許細胞游走及組織向內生長。近年來ePTFE已普遍應用于整形美容外科,尤其是隆鼻、面部凹陷畸形修復、鼻唇溝過深美容、耳廓缺陷修復等。本實驗以人骨髓間充質干細胞(human mesenchymal stem cells,hMSCs)作為組織工程細胞載體,對比ePTFE和硅膠的體外生物相容性,為臨床上ePTFE的廣泛應用提供實驗依據。
1材料和方法
1.1實驗材料:膨體聚四氟乙烯(上海索康醫用材料有限公司,產品注冊證號:20143461861);硅膠(廣州市萬和整形材料有限公司,產品注冊證號:20143460494);Ficoll分離液(G&E,瑞士);DMEM低糖培養基(Hyelone,美國);胎牛血清、胰酶(Gibco,美國);小鼠抗人CD44-FITC、CD90-FITC、CD45-PE(北京中衫生物技術有限公司);人成骨和成脂誘導試劑盒(廣州賽業生物技術有限公司);CCK-8細胞增殖檢測試劑盒(北京天恩澤生物技術有限公司)。
1.2儀器設備:離心管、細胞培養皿、96孔細胞培養板(Corning,美國);HERAcell 240i全能型CO2細胞培養箱、Attune NxT流式細胞儀、MK3多功能酶標儀(Thermo Fisher Scientific,美國);DMIL LED倒置顯微鏡(Leica,德國);5810R高速冷凍離心機(Eppendorf,德國)。
1.3標本來源:成人骨髓血樣本1例,取自吉林大學第二醫院骨科就診的股骨頸骨折手術患者,經血、尿分析及系統檢查,無家族遺傳病史及造血系統疾病,肝功能正常,術前經醫院倫理委員會及患者同意,手術中于骨折斷端取骨髓血5ml,吸入含0.5ml肝素的無菌針管中備用。
1.4方法
1.4.1 hMSCs分離及傳代培養:采用密度梯度離心法分離hMSCs,將抽取的骨髓血置于Fieoll上層,2000rmp離心20min后,吸取中層乳白色懸浮細胞,PBS清洗2次,1500rmp離心5min,棄上清。將分離得到的單核細胞用完全培養基制備成單細胞懸液,以1×106/ml接種于培養瓶內,置于37℃、5%CO2孵育箱內培養,每間隔2d換液1次。待貼壁細胞融合至80%~90%,0.25%胰酶消化,以1:3比例傳代。倒置顯微鏡觀察細胞的生長及形態變化。
1.4.2 hMSCs表面標志物檢測:取生長良好的第3代hMSCs,制成1×106/ml細胞懸液。PBS洗滌2次,棄上清,加入100 μl PBS液。每管相繼加入小鼠抗人CD44-FITC、CD90-FITC、CD45-PE各20μl。室溫避光孵育20min,PBS洗滌2次,1000rmp離心5min,PBS重懸定容至每管200μl,流式分析儀上樣檢測。
1.4.3 hMSCs成骨誘導實驗:將第3代hMSCs以每孔1×104/cm2密度接種于6孔板中,待細胞生長融合至80%~90%之后,加入成骨誘導培養液(10%FBS、0.1μM地塞米松、50μM抗壞血酸、10mMβ-磷酸甘油、1%青鏈霉素),并設陰性對照孔(僅加入普通培養基),繼續培養21d,進行茜素紅染色后鏡下觀察。
1.4.4 hMSCs成脂誘導實驗:將第3代hMSCs以每孔2×108/cm2密度接種于6孔板中,待細胞生長融合至80%~90%之后,加入成脂誘導培養液(IO%FBS、1μM地塞米松、10μM胰島素、200μM吲哚美辛、0.5mM IBMX、1%青鏈霉素),并設陰性對照孔(僅加入普通培養基),繼續培養至14d,進行油紅0染色后鏡下觀察。endprint
1.4.5 ePTFE和硅膠材料處理
1.4.5.1原材料直接處理:將ePTFES和硅膠分別置于15ml離心管內,用75%乙醇浸泡24h,無菌PBS沖洗3次,放入紫外操作臺中照射30min后,無菌剪刀剪成1mm×2mm×2mm小塊,兩種材料的處理如圖1。
1.4.5.2材料浸提液制備:稱取相同質量的兩種無菌材料,置于15ml離心管內,依次加入5ml完全培養基,室溫下分別浸泡24h、48h、96h,將獲得的浸提液于4℃保存待用。
1.4.6細胞黏附率測定:在24孔板培養板內分別植入備用的ePTFE和硅膠各8塊,將濃度為1×108/L的細胞懸液0.2ml滴加到材料上,靜置4h后,換于另一培養板,加入完全培養基,將原培養板中細胞消化收集,細胞計數儀計數,得出流失的細胞數;細胞材料復合物培養24h后,在培養液中輕輕晃動,換于另一培養板,重復上述步驟,得出未黏附細胞數,計算黏附率。黏附率=(接種細胞數流失細胞數未黏附細胞數)/(接種細胞數流失細胞數)×100%。
1.4.7細胞增殖能力測定
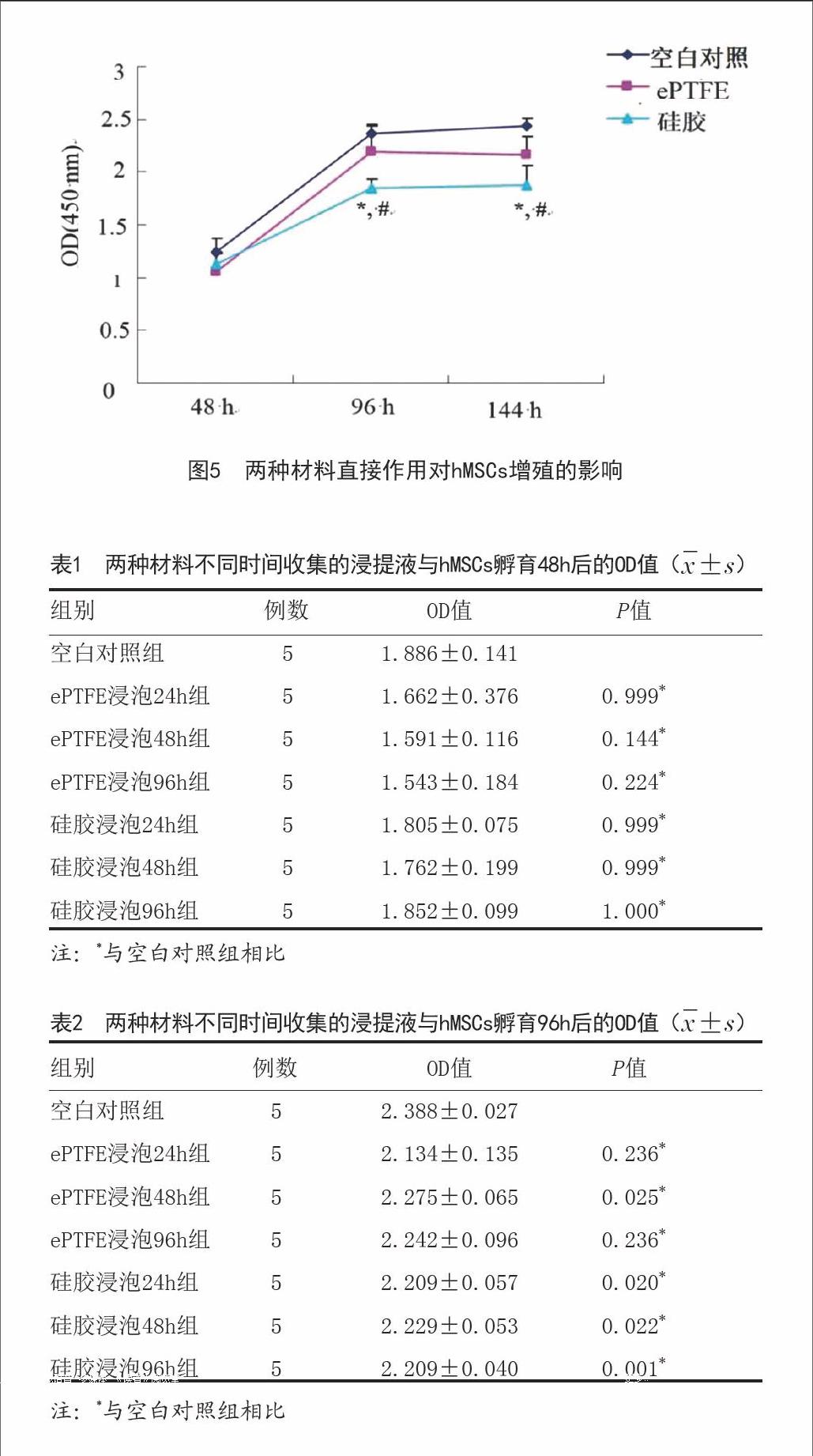
1.4.7.1原材料直接作用對hMSCs增殖的影響:將兩種材料分別置于96孔培養板中,并設不加材料的空白對照組,每組5個復孔。將濃度為2×103/L細胞懸液按100μl/孔接種于培養板內,置于37℃、5%C02孵育箱內培養48h、96h、144h,每孔加入CCK-8 10μl,孵育3h,酶標儀在450nm波長處測定各孔吸光度OD值。以時間為橫軸,OD值為縱軸繪制生長曲線。
1.4.7.2材料浸提液對hMSCs增殖的影響:將濃度為5×103/L細胞懸液接種于96孔培養板中,加入兩種材料不同時間收集的浸提液,置于37℃、5%CO2孵育箱內培養48h、96h,每孔加入CCK-8 10μl,孵育3h,酶標儀在450nm波長處測定各孔吸光度OD值。
1.5統計學分析:采用統計軟件SPSS15.0進行統計分析,所得數據均以(x±s)表示,采用t檢驗,各組別之間的比較采用F分析,P<0.05為差異有統計學意義。
2結果
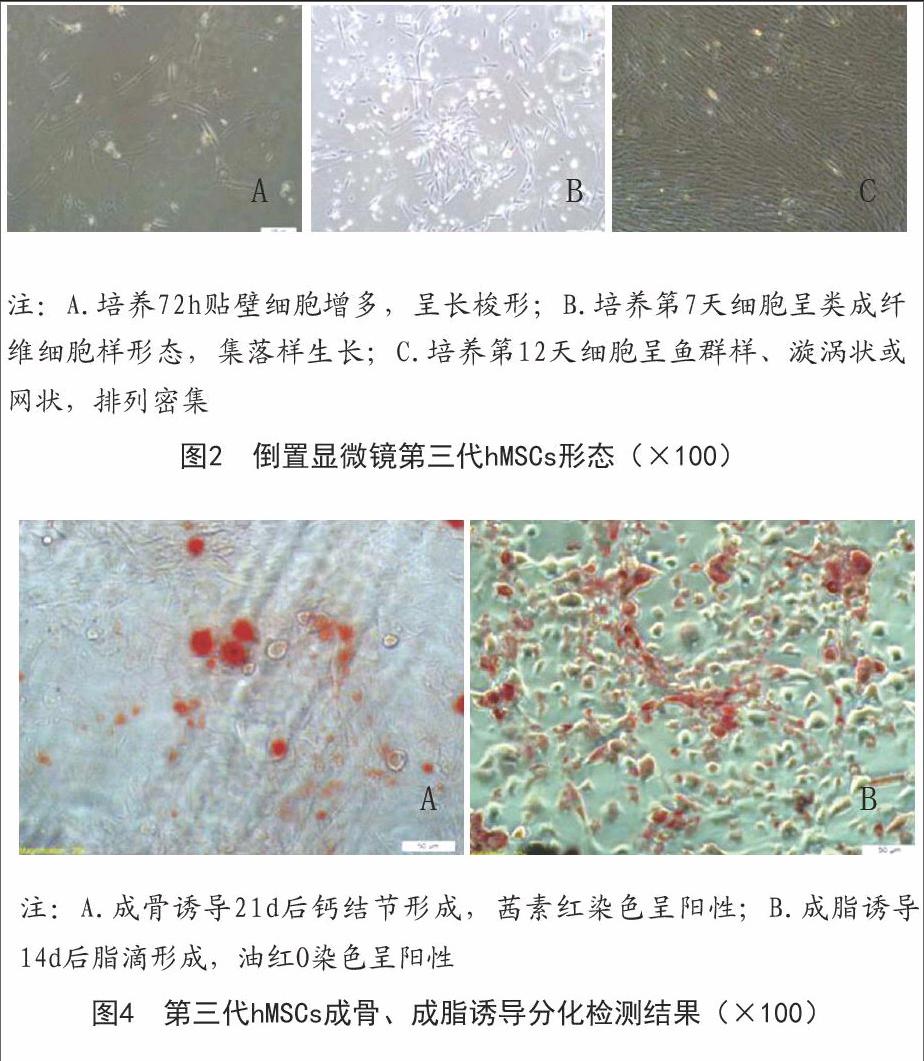
2.1 hMSCs形態觀察結果:倒置顯微鏡觀察到接種3h后少量細胞貼壁生長,但細胞體積較小,無突起;培養72h后貼壁細胞有所增多,呈長梭形;培養至第7天細胞增殖分裂加速,為類成纖維細胞樣形態,呈漩渦狀集落樣生長,約在10~12d細胞生長融合至80%~90%;傳代后的hMSCs形態更加均一,排列更加有序,呈魚群樣、漩渦狀或網狀排列。見圖2。
2.2 hMSCs表面標志物檢測:流式細胞儀分析顯示間充質干細胞表面標志物CD44和CD90表達均為陽性(99.5%,95.8%),而造血干細胞表面標志物CD45表達為陰性(0.0%),證實所培養的細胞為間質來源的干細胞,見圖3。
2.3 hMSCs成骨、成脂誘導分化鑒定結果:hMSCs經成骨誘導后由長梭形逐漸變成多角形或不規則形,細胞質中可見較多細小顆粒,誘導7d時細胞外出現細小礦化結節,21d時可見明顯鈣結節形成,茜素紅染色為陽性;hMSCs經成脂誘導后胞質內可見許多大小不一的脂滴,誘導2周時細胞分化達高峰,細胞體積明顯增大,油紅O染色為陽性。見圖4。
2.4細胞黏附率測定結果:經檢測,ePTFE每塊材料細胞黏附率平均達到92.3%,而硅膠材料細胞黏附率僅為76.8%,ePTFE對細胞的黏附作用優于硅膠(P<0.05)。
2.5細胞增殖測定結果:如圖5所示,CCK 8法檢測兩種材料直接作用培養后的細胞,隨時間延長ePTFE組和空白對照組細胞活性逐漸增加,仍可保持正常的分裂增殖速度,兩組之間差異無顯著性意義(P>0.05),而硅膠組細胞吸光值明顯低于ePTFE組和空白對照組(P<0.05)。兩種材料不同時間收集的浸提液分別作用hMSCs,孵育48h后檢測結果顯示各組OD值無顯著差異(P>0.05),結果見表1。孵育96h后ePTFE浸泡48h組和硅膠浸泡各組OD值低于空白對照組(P<0.05),表明材料浸提液對細胞生長有一定的影響,結果見表2。
3討論
軟組織缺失是整形外科關注的焦點問題之一,傳統的組織重建方法存在供皮區缺損、植入物吸收以及異物反應產生等缺陷,近年來干細胞被認為可能是一種新的治療方法。骨髓間充質干細胞與脂肪干細胞是目前組織工程中研究較多的間充質干細胞。二者均能自我更新和多向分化潛能,而且具有取材方便、創傷小、細胞獲取量大等優點,因而成為組織工程研究中的重要種子細胞之一。雖然這兩種間充質干細胞生物學特性相似,但在成軟骨誘導、血管內皮分化等方面,骨髓間充質干細胞比脂肪干細胞更具有優勢。因此,本研究選取hMSCs作為填充材料生物活性檢測的細胞載體。
骨髓間充質干細胞細胞支架材料的化學組成成分、表面理化特性、機械穩定性和三維空間支架結構均是此次考慮的重要因素,而且必須保證移植后細胞的滲透、足夠的增殖和細胞在構建物中完全分化。目前在組織工程中用作細胞支架的生物材料主要是一些天然高分子、天然無機物和合成高分子。雖然這些支架的生物相容性較好,但仍存在一些不足,如:對缺損組織的修復不足,隨時間增長材料可逐漸降解等,因此仍需進一步研究探索適用于組織工程的載體材料。
ePTFE在整形外科的應用已有30多年的歷史。目前報道多為ePTFE單獨或是聯合自體軟骨或其他生物材料應用于整形外科的臨床觀察,而其體內外生物相容性的基礎實驗研究鮮有報道。田田等制備SD大鼠背部全層皮膚至筋膜層損傷模型,觀察自體移植組、異體移植組和ePTFE實驗組創面愈合情況,發現ePTFE可引起較小的炎性反應及異物反應,置于受損創面上未見不良反應,提示可將其作為創面覆蓋材料。尹中普等將ePTFE和Ⅰ型膠原聯合制成的復合材料應用于隆鼻填充物,發現ePTFE聯合Ⅰ型膠原復合材料在細胞毒性、埋植后的炎性浸潤及生物相容性方面均優于單純ePTFE。此外,楊柳等觀察到ePTFE支架材料與人脂肪干細胞具有良好的體外生物相容性,可作為構建脂肪組織工程的細胞載體。
本次研究成功分離培養出hMSCs,檢測了第3代細胞表面標志物CD44和CD90陽性表達,并對細胞進行多系定向誘導分化,進一步確認實驗所得細胞具有干細胞特性。實驗中通過倒置顯微鏡觀察hMSCs黏附、伸展和生長情況,結果顯示,細胞生長狀態良好,無明顯細胞毒性表現,說明該材料對細胞有著良好的親和力。CCK-8法測定活細胞光吸收值,實驗發現ePTFE直接作用hMSCs時,可增加其成活及增殖,且細胞增殖效果優于硅膠組。由此可見,ePTFE作為整形外科填充材料,在體外生物相容性方面優于硅膠假體,為臨床上填充材料的改進和廣泛應用提供了科學依據。但是,兩種材料的浸提液與hMSCs孵育96h后檢測結果顯示對細胞的生長有一定的影響。作為長期植入體內的生物材料,本實驗設計的作用時間遠不能真實地反應材料的細胞毒性。合理的細胞毒性評價應跟蹤材料降解過程中降解產物的細胞毒性。因此,在后續實驗中將跟蹤填充材料在不同降解時間內其降解液的細胞毒性,建立基于材料降解液的細胞毒性評價方法。
目前,評價材料生物相容性的方法主要包括體外細胞培養法和體內埋植法。體外細胞培養法是將材料的浸提液或者材料本身與某種細胞進行體外的復合培養,以檢測細胞的增殖與功能表達的情況,這種方法作為材料生物相容性的初級評價方法,可以直接觀察細胞與材料復合生長的情況。體內埋植法是將材料植入體內,觀察宿主對材料的反應,這種方法往往作為后期評價材料生物相容性的有效方法,主要觀察的是材料與周圍機體組織的組織相容性。本次研究采用體外細胞培養法,直接觀察了hMscs與兩種填充材料復合生長的情況。對于ePTFE體內生物相容性,以及臨床應用中所產生的并發癥及其作用機理等,有待進一步研究探討。endprint

