油茶葉片生理生化指標動態變化*
胡玉玲 姚小華張 山 周艷紅
(1.湖南應用技術學院,湖南 常德 415000;2.中國林業科學研究院亞熱帶林業研究所,浙江 杭州 311400)
油茶一般指的是以產油為主的山茶科(Theaceae)中植物,屬于我國重要的木本食用油料樹種。普通油茶(Camellia oleifera)栽培面積和產量占所有油茶的90%以上,其中長林系列油茶是由中國林科院亞林所和亞林中心選育的油茶優良無性系品種,具有適應性較強、栽培面積非常廣的特點[1]。在長林系列油茶品種中,長林4號(Camellia oleifera‘ChangLin 4’)油茶無性系的綜合表現較好,較有代表性,對該品種進行深入的研究,可為其他普通油茶品種的研究提供有益的參考。
植物葉片是光合作用和光形態建成的主要器官,葉片中的生理生化變化反應了植物的生長狀況及各項生命活動特征[2,3]。普通油茶葉片生命周期可從當年3月份葉片萌發開始至翌年5月底,成熟的葉片一方面為油茶果實生長及花芽發育提供所有的能量和營養物質,另一方面還為油茶適應夏天高溫、冬季低溫及不同光周期等刺激提供各種信號物質。目前研究油茶葉片營養、生理生化的較多,但由于對油茶葉片正常生命周期沒有準確界定、對油茶成花機制沒有一致性的研究,因此,對油茶葉片生理生化指標的年動態變化鮮有報道。本文主要研究油茶長林4號無性系品種葉片中碳氮化合物和植物內源激素含量變化,旨在明確油茶形態建成和感受逆境時的生理生化指標變化。
1 試驗材料與方法
1.1 試驗地概況
中國林科院亞熱帶林業研究所油茶基地(浙江金華東方紅林場)位于 20°0l′N,119°30′E,海拔80 m,年有效積溫6 486.8℃,年降水量1 408.4 mm,屬亞熱帶季風氣候,土壤以第四紀土壤形成的紅壤為主,土層較深厚。該基地油茶于2006年種植,株行距為2 m×3 m,2008年開始掛果,按照標準化進行栽培和管理。
1.2 試驗材料及采樣方法
試驗材料為5年生長林4號油茶優良無性系。采樣方法:在同一行中不同位置選擇3株生長健壯的油茶,從東西南北4個方位摘取下中上(3根枝條)葉片,并用干冰保存,帶回實驗室置于-80℃冰箱內保存備用。采樣時間間隔:從葉片萌發(本采樣地油茶葉片萌發時間為3月25日)到落葉(翌年5月30日),每月下旬采樣1次。
1.3 測定指標
2013年7月,將葉片從-80℃冰箱內取出,在液氮中充分研磨和混合,通過四分法從中取樣進行相關指標測定。具體測定指標有可溶性蛋白、可溶性總糖、果糖、蔗糖、生長素(IAA)、赤霉素(GA)、玉米素(ZR)和脫落酸(ABA),其中可溶性蛋白測定采用“考馬斯亮藍”比色法、可溶性總糖測定采用“蒽酮”比色法、蔗糖和果糖測定采用“間苯二酚”比色法、激素測定采用“酶聯免疫法”[4-8]。
1.4 數據處理
測定的數據采用Microsoft office 2010和DPS12.1[9]進行處理和方差分析,并用LSD法進行多重比較。
2 結果與分析
2.1 油茶葉片中碳氮化合物含量變化
2.1.1 可溶性蛋白含量變化
從圖1可以看出,油茶葉片成熟過程(3~5月)中,可溶性蛋白含量先上升后略有下降;果實成熟過程(6~10月)中,葉片中可溶性蛋白含量變化幅度不明顯。在幼果休眠期(冬季)葉片中可溶性蛋白含量較其他時期相對較低;翌年隨著溫度的升高,葉片中可溶性蛋白含量也隨之升高,到落葉時又開始下降。總體來看,油茶葉片中可溶性蛋白含量在12月份最低(5.84%),翌年4月份最高(10.17%),其次是開花授粉時期(11月),高溫或低溫逆境環境下葉片中可溶性蛋白含量相對較低。
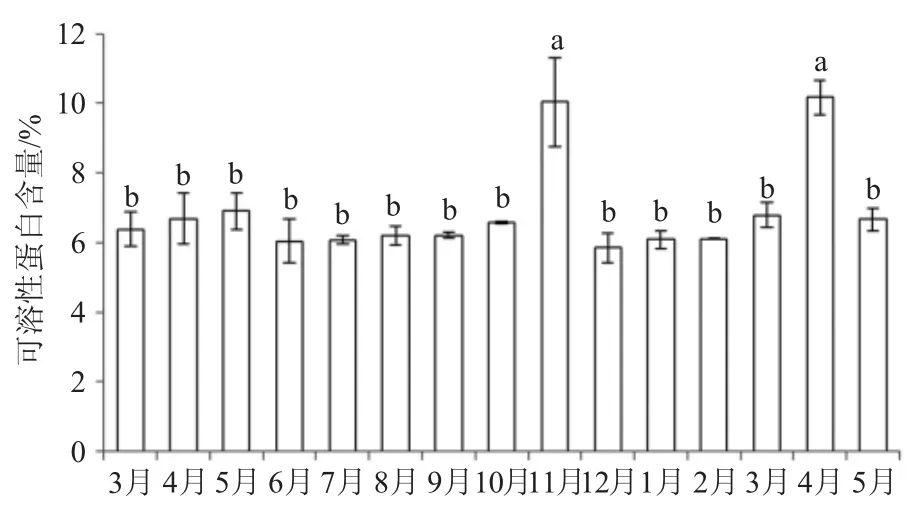
圖1 葉片中可溶性蛋白含量月變化
2.1.2 可溶性總糖含量變化
從圖2可以看出,葉片成熟過程中,葉片中可溶性總糖含量上升;果實成熟過程中,葉片中可溶性總糖含量先略有下降后又上升;在幼果休眠期,葉片中可溶性總糖含量隨著溫度的降低開始下降。翌年,當溫度開始上升時,可溶性總糖含量也開始上升;隨著新葉萌發,可溶性總糖含量又略有下降;新葉成熟后,可溶性總糖含量又恢復上升趨勢,到落葉時又開始下降。總體來看,油茶葉片中可溶性總糖含量在3月份最低(5.85%),11月份最高(13.39%),高溫或低溫逆境環境下葉片中可溶性總糖含量相對較低。

圖2 葉片中可溶性總糖含量月變化
2.1.3 果糖含量變化
從圖3可以看出,隨著葉片成熟,葉片中果糖含量變化幅度比較明顯,先下降后上升。在果實成熟過程中,葉片中果糖含量先略有下降后再上升;在幼果休眠期間,葉片中果糖含量較高。總體來看,油茶葉片中果糖含量在翌年2月份最高(4.90%),翌年4月份最低(0.57%),在低溫逆境環境下葉片中果糖含量增加明顯,在高溫逆境條件下葉片中果糖含量略有增加。
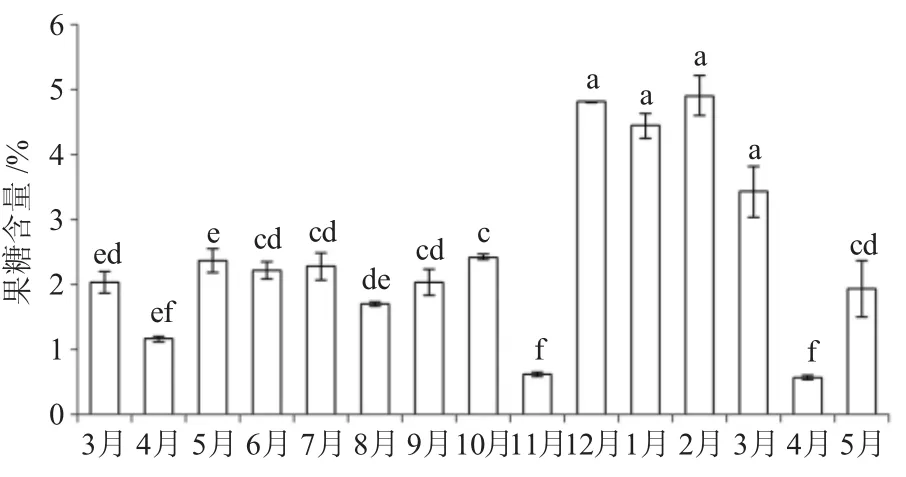
圖3 葉片中果糖含量月變化
2.1.4 蔗糖含量變化
從圖4可以看出,隨著葉片成熟,葉片中蔗糖含量逐漸上升;在果實成熟過程中,葉片中蔗糖含量先略有下降后再上升;在幼果休眠期,葉片中蔗糖含量變化比較明顯,含量較高,均高于其他時期。翌年隨著氣溫上升,葉片中蔗糖含量逐漸下降。總體來看,油茶葉片中蔗糖含量以翌年1月份最高(7.42%),翌年4月份最低(0.23%),在低溫逆境環境下葉片中蔗糖含量增加明顯,在高溫初期葉片中蔗糖含量增加。
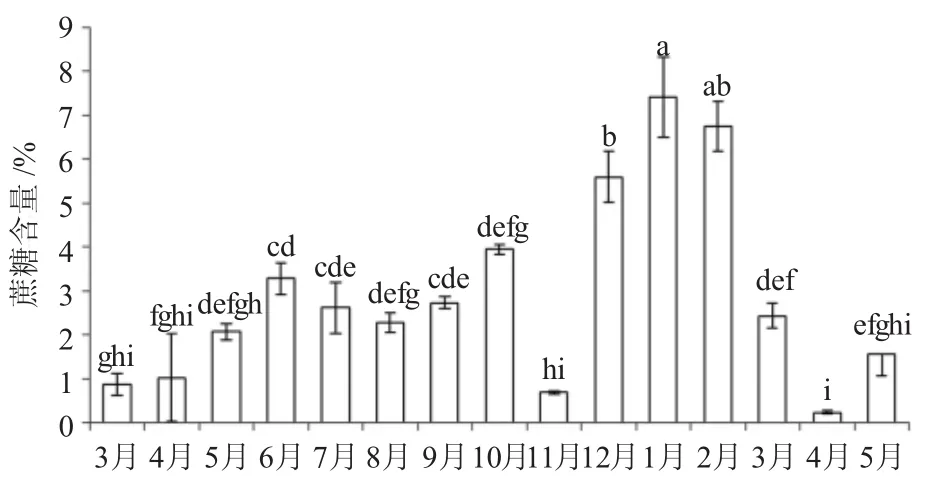
圖4 葉片中蔗糖含量月變化
2.1.5 方差分析
對油茶葉片中碳氮化合物含量進行方差分析的結果(表1)表明,不同月份中,油茶葉片中可溶性蛋白含量、可溶性總糖含量、果糖含量及蔗糖含量均差異極顯著(P=0.000)。
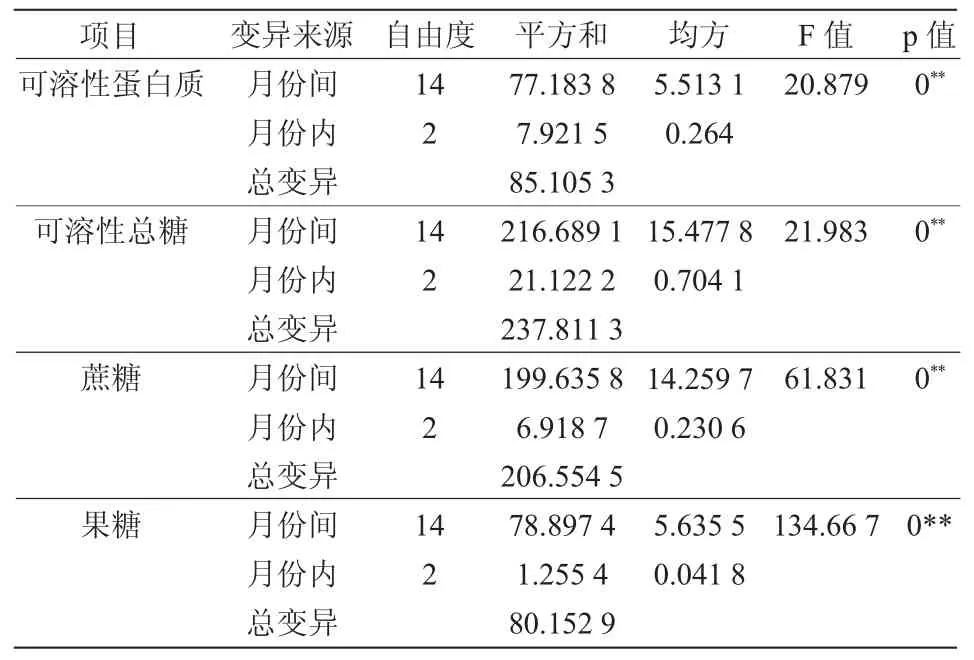
表1 碳氮化合物方差分析
2.2 油茶葉片中內源激素含量變化
2.2.1 生長素含量變化
從圖5可以看出,幼葉萌發初期,其生長素含量最高;而葉片成熟過程中,葉片中生長素含量先上升再下降;果實成熟過程中,葉片中生長素含量先略有上升后再下降;幼果休眠期間葉片中生長素含量變化比較明顯,幼果休眠初期生長素含量較高,幼果完全進入休眠狀態后,生長素含量明顯下降;翌年隨著氣溫上升生長素含量略有增加。總體來看,油茶葉片中生長素含量以當年4月份最高(171.19 ng·gFW-1),翌年5月份最低(35.73 ng·gFW-1),在高溫或低溫逆境環境下葉片中生長素含量相對較低。
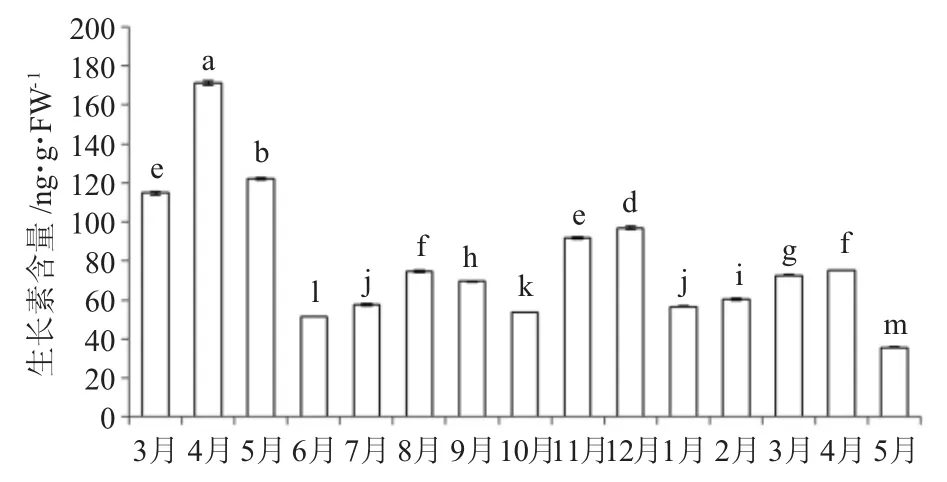
圖5 葉片中生長素含量月變化
2.2.2 赤霉素含量變化
從圖6可以看出,葉片成熟過程中,葉片中赤霉素含量上升后再下降;果實成熟過程中,葉片中赤霉素含量先略上升再下降,然后變化不明顯;在幼果休眠期,葉片中赤霉素含量先下降再上升,經過一段穩定時期后又開始下降,到幼果膨大期略有上升。總體來看,油茶葉片中赤霉素含量在當年 4月份最高(23.92 ng·g FW-1),12月份最低(5.01 ng·g FW-1),在低溫逆境環境下葉片中赤霉素含量增加,夏季隨高溫持續時間增加葉片中赤霉素含量略有下降。
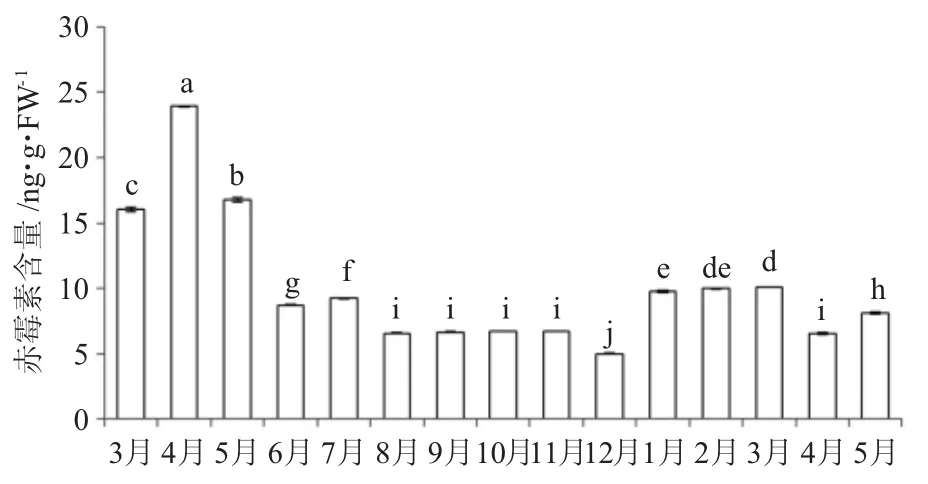
圖6 葉片中赤霉素含量月變化
2.2.3 玉米素含量變化
從圖7可以看出,葉片成熟過程中,葉片中玉米素含量先上升后下降;果實成熟過程中,葉片中玉米素含量先上升然后下降;在幼果休眠期,葉片中玉米素含量變化不明顯。總體來看,油茶葉片中玉米素含量 5 月份最高(19.82 ng·g FW-1),翌年5 月份最低(9.32 ng·g FW-1),在高溫或低溫逆境環境下葉片中玉米素含量相對較低。
2.2.4 脫落酸含量變化
從圖8可以看出,葉片成熟過程中,葉片中脫落酸含量先上升后下降;果實成熟過程中,葉片中脫落酸含量呈雙峰曲線變化;在幼果休眠期,葉片中脫落酸含量較高,但變化不明顯;翌年隨著新葉生長,脫落酸含量先下降后上升。總體來看,油茶葉片中脫落酸含量4月份最高(225.49 ng·gFW-1),翌年 4 月份最低(125.71 ng·g FW-1),在冬季低溫逆境影響下葉片中脫落酸含量增加明顯,夏季隨著高溫持續及降水影響葉片中脫落酸含量起伏變化。
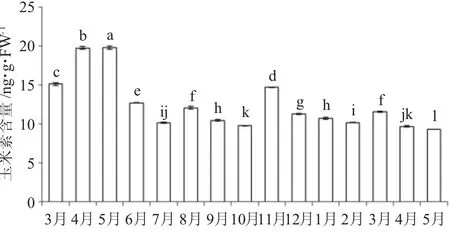
圖7 葉片中玉米素含量月變化

圖8 葉片中脫落酸含量月變化
2.2.5 方差分析
對油茶葉片中內源激素含量進行方差分析的結果(表2)表明,不同月份中,葉片中生長素含量、赤霉素含量、玉米素含量及脫落酸含量均差異極顯著(P=0.000)。

表2 葉片中植物內源激素含量方差分析
3 結果與討論
3.1 油茶葉片中碳氮化合物含量變化
植物葉片中可溶性蛋白、可溶性總糖是植物重要的生命物質,他不僅是衡量植物生命狀態的重要指標,如光合作用效率、受逆境傷害程度,而且一些糖類還可能是重要的信號傳導物質。筆者多年觀察認為,油茶春葉正常生命周期約為15個月,即從3月份(春梢萌發)到翌年5月份(葉片衰老掉落),雖然因樹勢和環境差異,葉片掉落時間會有所變化,但前后差異不超過20天,這與其他文獻出現1年生、2年生和3年生葉片不一致[10,11]。在葉片生長過程中,油茶發生了兩個重要的形態建成,即受精過程和花芽分化,這兩個過程重要時間點分別為11月和5月。本研究顯示,在受精過程中可溶性蛋白和總糖含量較高,蔗糖和果糖含量較低,完成受精后前兩者含量略有下降,后兩者則明顯上升;花芽分化前可溶性蛋白和可溶性總糖含量較高,蔗糖和果糖含量較低,花芽分化完成后,前兩者含量略有下降,而后兩者上升明顯,這與現有研究結果接近[12,13]。油茶葉片在其生長過程中還要經過兩個重要逆境影響時期,即冬季低溫冰凍天氣和夏季高溫干旱天氣,從本研究可以看出,在兩個逆境環境中可溶性蛋白含量變化較平緩;低溫時期果糖含量上升最明顯,在2月25日時達到最高(4.90%),其次是蔗糖含量,在1月25日時最高(7.42%)。
3.2 油茶葉片中內源激素含量變化
植物葉片是絕大部分植物內源激素合成的場所,內源激素水平影響著植物生長發育和形態建成,同時一些激素水平還反映了植物體承受的逆境水平。丁少凈等認為,干旱脅迫使油茶葉片IAA含量下降,ABA含量上升,GA含量先上升后下降,ZR含量下降并維持在較低水平[14]。本研究發現,油茶葉片中植物內源激素含量的月動態變化差異極顯著,葉片中脫落酸含量相對較高,其次為生長素,赤霉素和玉米素含量接近且較低。油茶葉片生長素的含量以春梢快速生長期(4月份)最高(171.19 ng·g FW-1),其次是授粉受精時期,在高溫及果實成熟過程(6~10月)和低溫時段(1~2月)較低,其中在第二年5月份含量最低(35.73 ng·g FW-1);赤霉素含量以春梢生長階段(3~5月)含量較高,其中 4 月份含量最高(23.92 ng·g FW-1),其他時間相對較低,而在 12 月份含量最低(5.01 ng·g FW-1)。玉米素的含量以花芽分化完成時(5月份)最高(19.82 ng·g FW-1),其次是授粉時期,翌年 5 月份最低(9.32 ng·g FW-1),夏季高溫和冬季低溫時段介于二者之間。脫落酸含量春梢快速生長時最高(225.49 ng·gFW-1),翌年4月份最低(125.71 ng·gFW-1)。脫落酸含量是重要的逆境衡量因子[15],從脫落酸相對含量大小可以看出,7月底是油茶高溫傷害最嚴重時期,1月份為冬季低溫傷害較嚴重時期。
總之,葉片生理生化的變化是油茶內外部環境綜合作用的一種生命活動表現,精確把握葉片不同生長階段及不同環境下特定生理生化特征,可為提高油茶的豐產栽培和高效育種提供依據,也可為對油茶進一步深入研究提供一些基礎數據。
[1] 莊瑞林.中國油茶[M].北京:中國林業出版社,2008.
[2] 曹永慶,姚小華,任華東,等.油茶果實成熟過程中內源激素和礦質元素含量的變化特征[J].北京林業大學學報,2015,37(11):76-81.
[3] 陳曉亞,湯章城.植物生理與分子生物學[M].北京:高等教育出版社,2007.
[4] 曲春香,沈頌東,王雪峰,等.用考馬斯亮藍測定植物粗提液中可溶性蛋白質含量方法的研究[J].蘇州大學學報(自然科學版),2006,22(2):82-85.
[5] 張妙霞,孔祥生,郭秀璞,等.蒽酮法測定可溶性糖顯色條件的研究[J].河南科技大學學報(農學版),1997,(4):24-28.
[6] 盧珍華,倪輝,楊遠帆,等.間苯二酚法測定蜂蜜中果糖的研究[J].集美大學學報(自然科學版),2006,11(3):223-226.
[7] Yang Y M,Xu C N,Wang B M,et al.Effects of plant growth regulators on secondary wall thickening of cotton fibres[J].Plant Growth Regulation,2001,35(3):233-237.
[8] 張鈺瑩,張會慧,張萌萌,等.3種丁香葉片PSⅡ光化學活性及光能利用特點[J].森林工程,2016,32(4):13-17.
[9] 唐啟義,馮明光.實用統計分析及其DPS數據處理系統[M].北京:科學出版社,2010.
[10] 胡哲森,李榮生.油茶不同葉齡葉片生理生化指標差異的研究[J].林業科技開發,2000,14(1):30-31.
[11] 張吉祥.油茶結實對不同葉齡葉片部分生理指標和影響[J].浙江林業科技,2000,20(4):75-78
[12] 唐光旭.油茶春梢生長發育與物質轉化的研究[J].經濟林研究,1984,2(2):44-51.
[13] 姜志娜,譚曉風,袁軍,等.油茶果實和葉片中主要營養物質含量的變化規律[J].中南林業科技大學學報,2012,32(5):42-45.
[14] 丁少凈,鐘秋平,袁婷婷,等.干旱脅迫對油茶葉片內源激素及果實生長的影響[J].林業科學研究,2016,29(6):933-939.
[15] 郝格格,孫忠富.脫落酸在植物逆境脅迫研究中的進展[J].中國農學通報,2009,25(18):212-215

