ERK途徑參與未受精蠶卵的孤雌激活
翁宏飚,牛寶龍
(浙江省農業科學研究院 蠶桑所,浙江 杭州 310021)
自從上世紀三十年代發現蠶卵在一定條件下,可少量發生孤雌發育的現象以來,人們開展了大量的家蠶未受精卵的孤雌誘導實驗,通過優化誘導條件,篩選易發品系,建立起高效的家蠶孤雌生殖體系[1~3]。在國內,對家蠶種質庫中的保存品種進行篩選,并通過連續多代的選擇,建立起全球最大的家蠶孤雌生殖種質資源庫,培育的孤雌生殖家蠶品種進入生產實用[4]。在開展家蠶孤雌生殖應用研究的同時,家蠶孤雌生殖機理的研究也在不斷探索中。通過家蠶孤雌生殖發育蠶卵的細胞學研究,發現46℃、18 min的熱激處理,可以使阻滯于第一次減數分裂的染色體結構解體,同源染色體不再分離,直接進入第二次減數分裂模式,染色單體相互分離,從而使得子代染色體組保持與親代相同的2 n[2]。日本學者研究發現,在家蠶嵌合體突變品系的孤雌生殖中,同時存在極體自受精和不完全減數分裂兩種機制,而在可自發發生孤雌生殖的品系M90中,其孤雌生殖發育則主要為不完全減數分裂機制[5]。孤雌生殖品系的轉錄組學研究結果顯示,許多調控途徑參與了家蠶熱激誘導的孤雌生殖發育[6]。
卵母細胞成熟調控是一個復雜的多因子調節過程。在脊椎動物中,卵細胞分裂阻滯于第2次成熟分裂中期,等待受精活化[7]。而在無脊椎動物中,卵母細胞發育過程中的第2次分裂阻滯發生在第1次成熟分裂中期[8]。絲裂原活化蛋白激酶(mitogen-activat?ed protein kinase cascade,MAPK)信號通路是細胞間信號傳遞的重要通路,參與細胞形態、細胞分化及細胞周期的各個環節[9]。MAPK在卵細胞減數分裂的MⅠ期/MⅡ期轉變過程中保持活性,是調節卵母細胞減數分裂的中樞[10]。已有大量研究發現,MAPK信號途徑參與脊椎動物卵細胞的人工活化過程[11~12],在卵受精或孤雌活化后,MAPK發生去磷酸化而失活,分裂阻滯解除,細胞恢復分裂。在對無脊椎動物葉蜂的研究中發現,MAPK信號途徑參與葉蜂的孤雌生殖發育,蜂卵經人工孤雌激活,分裂阻滯解除后,隨著發育時間的延長,磷酸化修飾的MAPK和MEK含量逐漸下降,激活后50 min,已檢測不到磷酸化修飾的激酶[13]。定量比較MAPK信號通路基因在有性生殖品系與孤雌生殖品系間的表達差異,結果顯示信號通路基因的表達,在兩個品系間存在顯著性差異,暗示MAPK信號通路可能參與了家蠶孤雌生殖發育[14]。
MAPK信號通路的核心是幾種蛋白激酶的順序磷酸化激活,MEK是催化MAPK磷酸化修飾的直接分子[15]。U0126是MEK1/2的高效特異性抑制劑。對葉蜂卵的研究中發現,以抑制劑U0126處理蜂卵,可以降低卵內MAPK的磷酸化水平,解除卵細胞分裂阻滯,誘導恢復分裂,達到孤雌誘導的效果[13]。家蠶孤雌生殖首先需要通過熱激處理,解除細胞分裂阻滯,恢復細胞分裂過程,而后在各種機制的維護下完成胚胎發育。本研究以不同濃度的U0126注射羽化前不同時期的雌蛹,羽化后收集未受精卵,46℃、18 min熱激誘導孤雌生殖,調查未受精卵的轉色率、孵化率指標,結果顯示U0126可以促進未受精卵孤雌生殖激活后早期胚胎的發育,提高蠶卵的轉色率。
1 材料與方法
1.1 材料和主要試劑
家蠶孤雌生殖品系無14是原種54A,經連續多代熱激(46℃,18 min)誘導篩選出的PL品系;多化性品系Nastari為浙江省農科院蠶桑所保存蠶品種。
抑制劑U0126購自Selleck公司(美國),溶劑DMSO購自上海生工,未受精卵熱激用水浴、恒溫恒濕箱購自上海博訊公司;protoCOL自動菌落計數儀(synbiosis,Cambridge,UK)為農科院質量標準研究所儀器。
1.2 方法
將U0126粉劑溶于DMSO,配制成10 mmol母液,于-20℃分管保存。使用時用PBS緩沖液稀釋成工作液備用。
熟蠶上蔟結繭后,削繭鑒蛹,雌蛹常規保護至復眼著色。取10 g消特靈粉劑溶于2 L蒸餾水中,配制成蛹體消毒液。將復眼著色雌蛹浸入消毒液中1 min,撈出后放在干凈的吸水紙上晾干保護。在羽化前2 d,按每蛹20 μL的注射量,給雌蛹注射U0126工作液并常規保護至羽化,每個濃度注射10顆雌蛹。蠶卵孤雌生殖誘導及蠶卵保護參照[4]方法進行。由于無14品系孤雌生殖發育良好,蠶卵發育調查時,隨機稱取0.1克蠶卵,統計良卵率和孵化率;多化性品系Nastari蠶卵發育初期不著色,在孵化前2~3 d開始轉色。考慮到Nastari孤雌生殖蠶卵的發育較有性生殖蠶卵慢,因此在有性生殖蠶卵孵化后一周,隨機稱取0.15 g蠶卵,均勻攤于8 mm平皿中,用菌落計數儀統計轉色蠶卵數,并計算單位重量的轉色蠶卵數量,用于統計分析。儀器的設置為:曝光時間:40 ms;排除小顆粒:小于0.1 mm。每個實驗均設3個重復。采用SPSS軟件進行差異顯著性分析。
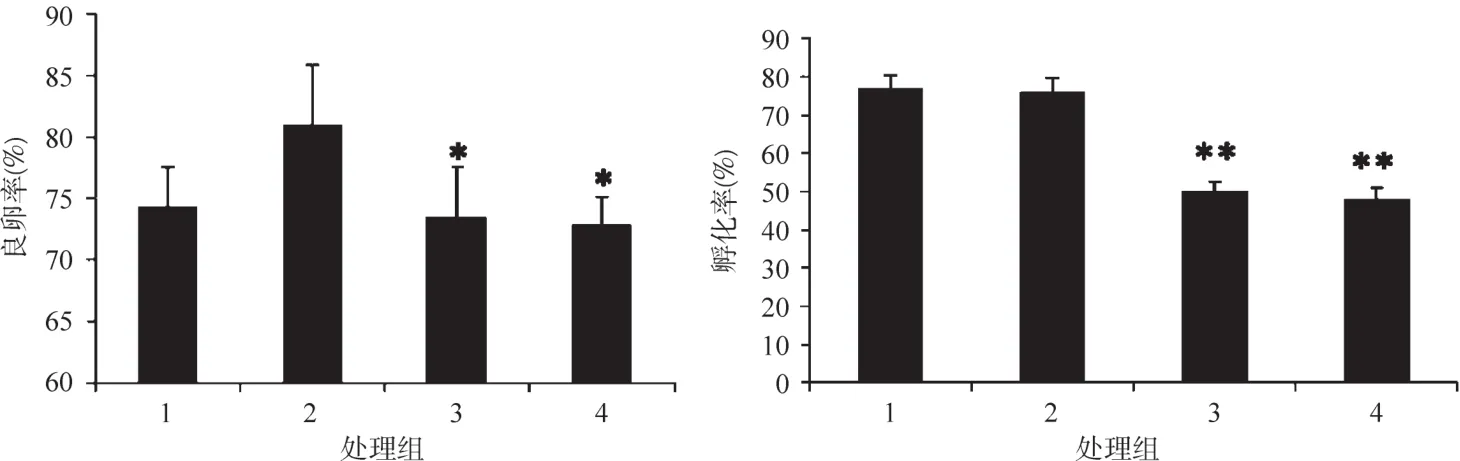
圖1 U0126處理后孤雌生殖品系無14良卵率和孵化率Figure 1 Good egg rate and hatching rateof Wu14with U0126treating
2 結果與分析
2.1 品系無14的孤雌生殖激活
2017年春蠶期,無14上蔟結繭后,于6月3日注射雌蛹,6月5日羽化,常規取卵,孤雌生殖誘導,蠶卵保護及入庫冷藏,8月15出庫調查并開始催青。蠶卵調查結果如圖1。
抑制劑U0126處理孤雌生殖品系無14后,高濃度組的良卵率指標與對照組的相仿,但低濃度組及有機溶劑DMSO組的良卵率顯著下降。蠶卵孵化率指標,對照組與高濃度組無統計差別,而低濃度組及溶劑組則極顯著降低。
2.2 品系Nistari的孤雌生殖激活
2017年秋蠶期,于9月13日注射處理Nistari雌蛹,9月15日羽化,收集未受精卵并進行孤雌生殖熱激誘導,因Nastari品系孤雌生殖孵化率極低,而且蠶卵早期不著色,為判斷發育進度,設置有性生殖蠶卵對照,同步蠶卵保護及催青,有性生殖蠶卵孵化后一周,用自動菌落計數儀調查孤雌生殖的發生情況。結果如圖2。
雖然Nistari經U0126處理后,各處理組均無孵化,但各組的蠶卵轉色情況并不相同。20 μmol/L處理組蠶卵轉色極顯著優于其他處理組;10 μmol/L處理組極顯著好于5 μmol/L組和對照組;5 μmol/L組和對照組的單位卵重轉色卵數則極顯著高于溶劑對照組和1 μmol/L處理組。
3 討論
目前家蠶孤雌生殖發育的調查指標主要有蠶卵著色率(孤雌生殖發生率)及催青后孵化率。普通蠶品種在受精或孤雌生殖激活后,細胞恢復分裂并開始胚胎發育約24 h~28 h,卵內漿膜形成后轉為固有色,再經10 d左右催青而后孵化。現有蠶品種經熱激誘導后,有較高的未受精卵著色率,平均蠶卵著色率為50%左右[4,16-17],部分蠶卵能發育到轉青期和點青期,但極少孵化。本實驗所用的Nistari是多化性熱帶白卵蠶品種,蠶卵激活開始發育后,早期蠶卵不轉色,催青第7 d-8 d左右,蠶卵出現少量著色,在有性生殖蠶卵孵化后5 d內,孤雌生殖蠶卵顏色仍在變化,7 d后蠶卵顏色變化不大。因此,實驗中在有性生殖蠶卵孵化后第7 d,調查孤雌生殖蠶卵的轉色情況,作為Nistari孤雌生殖發育的指標。
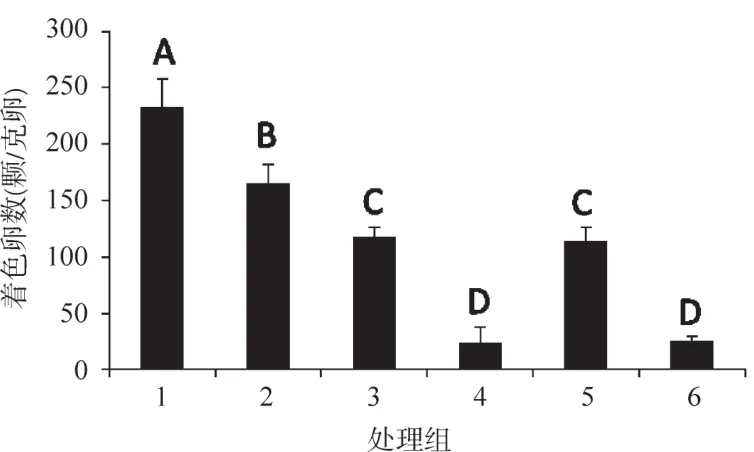
圖2 U0126處理后,每克孤雌生殖蠶卵中的著色卵數Figure 2 Amount of coloring eggs in each gram of parthenogenesis eggs with U0126 treating
本實驗中,經高、中濃度抑制劑處理后,Nistari品系的轉色卵比例極顯著高于對照。已有的研究顯示,家蠶的遺腹卵率大約在10%~15%左右[18],雖然遺腹卵不等同于未成熟卵,但不能排除大部分遺腹卵屬于未成熟卵,孤雌生殖誘導后不能著色而成為不良卵。考慮到用于孤雌生殖誘導的未受精卵為解剖卵,包含了全部未成熟卵,因此抑制劑處理后無14良卵率的提高雖未達顯著水平,但可以確定U0126處理可以使得更多蠶卵被激活而進入胚胎發育,或有利于孤雌生殖蠶卵的發育。Nistari低濃度組和溶劑組的轉色卵指標極顯著低于對照組,以及無14低濃度組和溶劑組的良卵率顯著低于對照組,可能是由于DMSO的細胞毒性,抑制了胚胎發育造成的。而且DMSO的細胞毒性在無14孵化率上也有體現:在低濃度組和溶劑組中,無14的孵化率極顯著地低于對照組。另外,Nistari品系的不滯育和卵發育后期轉色的特點,是合適的家蠶孤雌生殖研究材料。
顯微觀察孤雌生殖轉色卵,可見蠶卵呈現塊狀或帶狀著色斑,而不是有性生殖蠶卵的完全著色形式,因此在統計著色卵指標時,可能因統計人員的不同,而出現不同的統計結果,影響結果分析。本研究中,利用自動菌落計數儀,通過設置合適的參數,可以客觀、高效地統計著色卵數,因而該系統可以在家蠶孤雌生殖研究中應用。
[1] ASTAUROV B L.Artificial parthenogenesis and experi?mental polyploidy in silkworm[J].The Journal of Sericul?tural Science of Japan,1967,36:277-285.
[2] STRUNNIKOV V A.Control over Reproduction,Sex,and Heterosis of the silkworm[M].London:Harwood Academ?ic Publishers,1995.
[3] KLYMENKO V V.Parhenogenesis and cloning in the silkwormBombyx mori L:Problem and prospects[J].J.In?sectBiotech.Sericol,2001,70:155-165.
[4] 王永強,徐孟奎,何秀玲,等.家蠶現行品種孤雌生殖的研究[J].蠶業科學,2001,27(1):20-23.
[5] KUSAKABE T,KIDO K,KITA K,et al.Analysis of artifi?cial andspontaneousparthenogenetic development in mosa?ic mutationsand the parthenogenetic strain of Bombyx mo?ri[J].Invertebrate Reproduction&Development,2004,45(2):101-108.
[6] LIU P,WANG Y,DU X,et al.Transcriptome Analysis of Thermal Parthenogenesis of the Domesticated Silkworm[J].2015,PLOS ONE DOI:10.1371/journal.pone.0135215.
[7] MCCARTER J,BARTLETT B,DANG T,et al.On the control of oocyte meiotic maturation and ovulation in Cae?norhabditis elegans[J].Developmental Biology,1999,205(1):111-128.
[8] MASUI Y.Meiotic arrest in animal oocytes[M].San Di?ego:Academic Press,1985.
[9] SUN Q Y,BREITBRTH,SCHATTEN H.Role of the MAPK cascade in mammalian germ cells[J].Reproduc?tion,Fertility,and Development,1999,11(8):443-450.
[10]DUPRé A,HACCARD O,JESSUS C.Mos in the Oocyte:How to Use MAPK Independently of Growth Factors and Transcription to Control Meiotic Divisions[J].Journal of Signal Transduction,2011,2011(2090-1739):350412.
[11]FAN H Y,SUN Q Y.Involvement of mitogen-activated protein kinase cascade during oocyte maturation and fer?tilization in mammals[J].Biology of Reproduction,2004,70(3):535-547.
[12]吳曉慧,李衛平,狄文.卵母細胞減數分裂轉變過程的調控機制[J].生殖與避孕,2009,29(11):741-745.
[13]DAISUKE S Y,KAZUNORI T,MEGUMI S,et al.Involve?ment of Mos–MEK–MAPK pathway in cytostatic factor(CSF) arrest in eggs of the parthenogenetic insect,Athalia rosae[J].Mechanisms of development,2008,125:996-1008.
[14]翁宏飚,劉培剛,牛寶龍,等.MAPK信號通路參與熱激誘導家蠶未受精卵發生孤雌生殖發育的研究[J].蠶業科學,2016,42(4):0598-0605.
[15]范衡宇,佟超,陳大元,等.MAPK信號通路在卵母細胞減數分裂中的作用[J].科學通報,2002,47(9):650-656.
[16]潘少茜,李寶瑜,廖瓊香,等.家蠶資源品種孤雌生殖力的研究[J].廣東農業科學,1996,1996(3):40-42.
[17]白興榮,廖鵬飛,邵榆嵐,等.云南省部分家蠶品種資源的孤雌生殖發生率調查[J].蠶業科學,2012,38(5):0938-0941.
[18]嚴會超,林健榮,鐘生泉,等.家蠶遺腹卵的研究-Ⅰ.環境條件與家蠶遺腹卵發生的關系[J].廣東蠶業,1997,31(2):22-26.

