290例成人急性髓系白血病臨床特點及治療效果
溫順祝,傅紅春,李曉明,邢宏運
急性髓系白血病(AML)是一類起源于造血干、祖細胞的造血系統惡性腫瘤,具有高度異質性。近年來,隨著各項新的生物檢測技術的出現,AML的診斷越漸細化,治療方案的優化也大大改善了患者的預后。為了明確本地區AML的臨床特點、診療情況及遠期療效,遂對醫院收治的290例成人AML患者資料進行回顧性分析,現報告如下。
1 資料與方法
1.1 資料來源 通過醫院病歷系統,收集2013年5月~2017年5月在西南醫科大學附屬醫院血液內科住院收治的所有確診為AML的患者臨床資料,共290例。
1.2 診斷分型 均根據骨髓及外周血的細胞形態學及Wright-Giemsa染色特點,以FAB分類標準[1]及WHO的血液腫瘤分型標準[2]確診。結合流式細胞術、染色體核型分析、FISH、PCR等檢查結果,通過細胞形態、免疫表型、細胞遺傳學、分子生物學等檢查結果進行分型。
1.3 預后分層 以初診時白血病細胞遺傳學和分子遺傳學的改變,按照成人AML(非急性早幼粒細胞白血病)中國診療指南進行危險度判定[4]:t(16;16)(p13;q22)/inv(16)(p13;q22)、t(8;21)(q22;q22)、NPM1 突變但不伴有FLT3-ITD突變、CEBPA雙突變者,歸為預后良好組;正常核型、t(9;11)(p22;q23)、其他異常核型、inv(16)或 t(8;21)伴有 C-Kit突變者,歸為預后中等組;單體核型、復雜核型(≥3種)且不伴預后良好組核型、-5、-7、5q-、-17 或 abn(17p)、11q23 染色體易位除外 t(9;11)、inv(3)(q21;q26.2)、t(6;9)(p23;q34)、t(9;22)(q34.1;q11.2)、TP53 突 變 、RUNX1(AML1)突變、ASXL1突變、FLT3-ITD突變者,歸為預后不良組。
1.4 治療 根據患者發病情況不同,首次誘導方案主要選擇 DA[DNR:40~60 mg/(m2·d),d 1-3;Ara-c 100~200 mg/(m2·d),d1-7]、IA[IDA 10 mg/(m2·d),d1-3;Ara-c 100~200 mg/(m2·d),d 1-7]或 HA 方案[HHT2.0~2.5 mg/(m2·d),d 1-3~d1-7;Ara-c 100~200 mg/(m2·d),d1-7]。 骨髓抑制期(停化療后第 7~14 d)、恢復期(停化療后第7~14 d)復查骨髓緩解情況,緩解標準參照《血液病診斷及療效標準》[1]。經過1~2個療程的治療獲得完全緩解(CR)后,根據遺傳學預后危險度分組,選擇含有大劑量 Ara-C[≥2.0 g/(m2·d),3 d]的治療方案,進行 3~4個療程鞏固治療[3]。
1.5 隨訪 自確診之日起,每月住院時或者門診隨訪患者,至患者死亡或2017年5月30日止。對于未死亡患者,均于2017年6月進行電話隨訪,確認其目前疾病狀態。
1.6 統計學方法 應用SPSS 17.0進行統計分析,率的比較采用χ2檢驗,Kaplan-Meier方法計算中位生存期和生存率,單變量預后分析按Long-rank法,P<0.05為差異有統計學意義。
2 結果
2.1 臨床特點 290例中,男女之比為1.1∶1;患者年齡14~86歲,中位發病年齡為50歲。按FAB分型診斷,依次為 M2、M5、M4、M1、M6、MO。7 例有骨髓增生異常綜合征(MDS)病史,2例有其他實體腫瘤病史。正常核型占59.8%,異常核型占40.2%,其中復雜核型(≥3種)占14.0%。100例進行了FLT3、NPM1、c-KIT、CEBPA等11種與預后相關的基因突變檢測,其對應基因突變分別為24.0%、17.0%、2.0%、14.0%;143例進行了 AML-ETO、PML-RARa、BCR-ABL、CBFβ-MYH11、MLL 等 43 中白血病融合基因突變檢測,其對應基因突變分別占11.2%、2.1%、2.8%、2.1%、1.4%。 見表 1。

表1 290例成人急性髓系白血病患者臨床特征
2.2 治療及預后 162例(55.9%)確診后選擇放棄化療,只接受對癥支持治療,107例確診后選擇接受化療,另外21例初診后即死亡。在接受化療的107例中,88例(82.2%)確診后用標準DA/IDA/HA誘導方案,治療1~2個療程獲得CR的占70.5%(62例),其中1個療程達到CR的占53.4%(47例),1個療程達到部分緩解(PR)的占11.3%(10例),2個療程未緩解(NR)占9.1%(8例),標準方案的誘導化療相關病死率為9.1%(8例)。
在107例化療患者中,采用標準DA/IDA/HA誘導方案或者其他方案共有81例獲得緩解。緩解后應用含大劑量阿糖胞苷[≥2.0g/(m2·d),3 d]鞏固治療的占28.40%(23/81),未使用含大劑量阿糖胞苷鞏固治療的占71.60%(58/81),其對應的中位無病生存時間(DFS)分別為 12 和 7 個月(P=0.098,圖 1),預計3年總生存(OS)率分別為50.1%和23.7%(P=0.015,圖 2)。
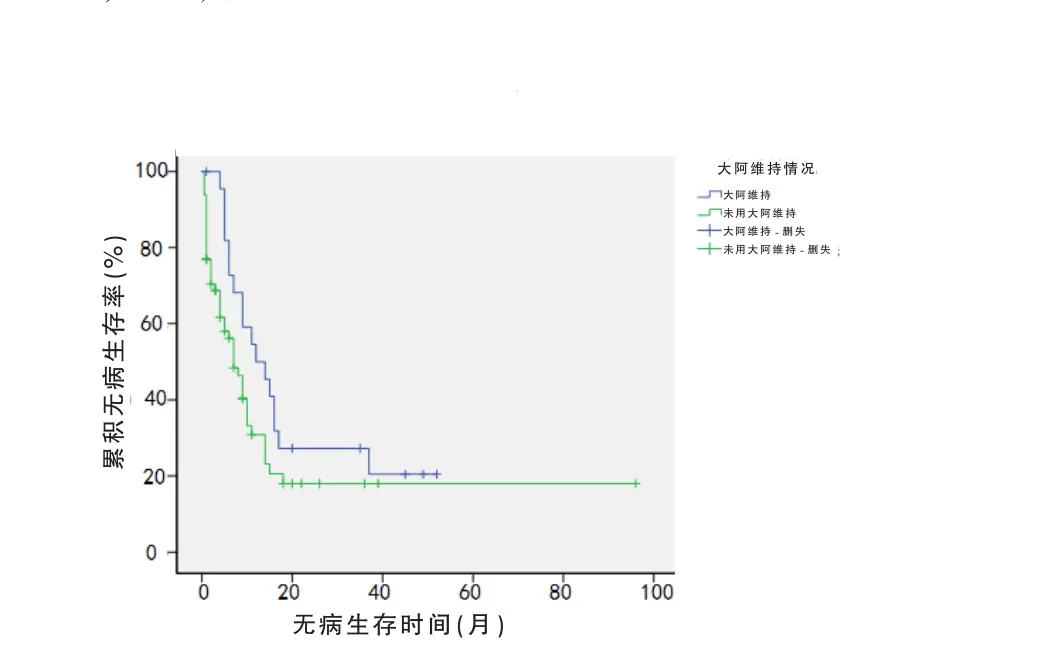
圖1 急性髓系白血病患者不同鞏固方案的DFS(月)
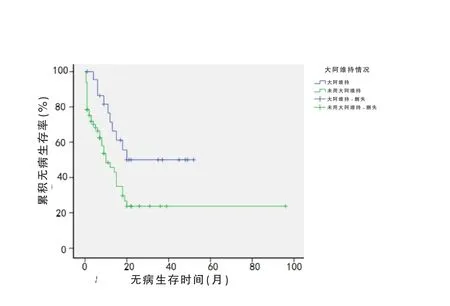
圖2 急性髓系白血病患者不同鞏固方案的OS(月)
3 討論
AML發病以成人尤其中老年人多見,國外報道的中位發病年齡為64歲[1],國內報道的年齡較國外年輕,本組中位發病年齡為50歲,與國內報道基本一致[5-7];本組男女之比為1.1∶1,也與國內外多個中心結果基本一致[5-9]。各個類型發型情況,本研究與國內報道的相同[9],以M2發病最多,M5其次。
AML的不良預后與年齡≥60歲、MDS或MPN病史、高白細胞計數(WBC≥100×109/L)等有關[4],但目前國內主要還是根據初診時白血病細胞遺傳學和分子遺傳學的改變進行預后分層。復雜核型是AML預后不良的因素,本研究中復雜核型占14.0%,與國外報道的10%~34%一致[10]。FLT3基因的突變、過度表達與AML的發生和預后密切相關,國外研究提示,在成人中FLT3的突變率約為20%~35%[11],國內報道為20.9%[5],本組為24%,與國內外數據基本一致。
AML病情進展快,病情重,預后不良。隨著造血干細胞移植技術的開展及新的靶向治療藥物的應用,大大改善了患者預后。但由于造血干細胞移植費用昂貴、供體困難等原因,絕大多數患者不能接受該治療,化療在我國仍然是最主要治療手段。國內化療方案DA/IDA/HA完全緩解率約55%~90%[12],本組為70.5%,處在全國中上水平,但較中國科學院血液病診斷中心的緩解水平82.0%偏低[5],可能與患者依從性差,本地區經濟不發達和化療藥物劑量偏小有關。
近年來,隨著支持治療的改進和新抗感染藥物的出現,AML誘導相關死亡率不斷下降,美國SEER數據庫的流行病學數據提示,AML的誘導死亡率為5.8%[13],中國科學科學院血液病醫院白血病診斷治療中心的誘導死亡率為4.2%[5],而本組為9.1%,略高于上述水平,這可能與治療患者少(107例),患者經濟情況不好,不能選擇更好的支持治療等有關。
用含大劑量Ara-C鞏固強化治療與未使用大劑量Ara-C鞏固強化的兩組DFS無明顯差異(P>0.05),但是預計3年OS率存在統計學差異(P<0.05),說明使用大劑量Ara-C方案的鞏固化療的遠期療效優于不使用大劑量Ara-C鞏固化療的患者。國外癌癥和白血病研究組B用大劑量Ara-C方案進行緩解后鞏固,中位DFS為13.2個月[14],本組為12個月,與國外結果基本一致。宋艷萍等[15]對25例AML取得CR后用含大劑量Ara-C方案進行鞏固化療,所得3年OS率為60%,而本研究3年OS率為50.1%,略低于該水平,可能與本研究將M3患者排除在外有關。
總的來說,本地區的AML臨床特點與國外稍有差別,但是與國內多中心的情況基本一致。基本的DA/IDA/HA化療緩解情況在國內處于中上水平,但較一些大的醫學中心仍然存在一定差距,取得CR后使用含大劑量Ara-C鞏固維持治療遠期預后較不用大劑量Ara-C鞏固維持治療的效果好。而確診后即放棄化療的患者占55.86%,可能與本地經濟情況欠發達,患者不能負擔高昂的治療費用,以及對疾病和化療的誤解密切相關,其具體原因還需要進一步研究。
[1] 張之南,沈悌.血液病診斷及療效標準[M].3版.北京:科技出版社,2008:169-194.
[2] JaffeES,HarrisNL.Pathologyand geneticsoftumorsof haematopoietic and lymphoid tissues[M].Lyon:IARC Press,2001:75-106.
[3] Arber DA,Orazi A,Hasserjian R,et al.The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J].Blood,2016,127(20):2391-2405.
[4] 中華醫學會血液學分會.成人急性髓系白血病(非急性早幼粒細胞白血病)中國診療指南(2017年版)[J].中華血液學雜志,2017,38(3):177-182.
[5] 林冬,周春林,魏輝,等.822例成人急性髓系白血病的臨床特點及療效分析-單中心報道[J].中華血液學雜志,2014,35(12):1058-1064.
[6] 崇禮,張曉波.全國白血病發病情況調查[J].中國醫學科學院學報,1992(1):12-17.
[7] 上海市白血病協作組.2867例急性白血病的臨床分析[J].中華血液學雜志,1999,20(2):91-92.
[8] Medeiros BC,Satram-Hoang S,Hurst D,et al.Big data analysis of treatment patterns and outcomes among elderly acute myeloid leukemia patients in the United States[J].Ann Hematol,2015,94(7):1127-1138.
[9] 全國白血病與再生障礙性貧血流行病學調查協作組.全國白血病發病情況調查[J].中國醫學科學院學報,1992,14(1):12-19.
[10] Van Limbergen H,Poppe B,Michaux L,et al.Identification of cytogenetic subclasses and recurring chromosomal aberrations in AML and MDS with complex karyotypes using m-FISH[J].Genes Chromosomes Cancer,2002,33(1):60-72.
[11] Kottardis PD,Gale RE,Linch DC.Flt3 mutations and leukaemia[J].British Journal Of Haematology,2003,122(4):523-538.
[12] 魏輝.急性髓細胞白血病誘導治療的進展及展望[J].國際輸血及血液學雜,2016,39(4):280-283.
[13] Percival ME,Tao L,Medeiros BC.Improvements in the early death rate among 9380 patients with acute myeloid leukemia after initial therapy:a SEER database analysis[J].Cancer,2015,121(12):2004-2012.
[14] Moore JO,George SL,Dodge RK,et al.Sequential multiagent chemotherapy is not superior to high-dose cytarabine alone as postremission intensification therapy for acute myeloid leukemia in adults under 60 years of age:cancer and leukemia group B study 9222[J].Blood,2005,105(9):3420-3427.
[15] 宋艷萍,張梅,胡凱,等.大劑量阿糖胞苷用于急性髓細胞白血病緩解后治療的臨床觀察[J].實用醫學雜志,2008,24(15):2696-2697.

