醫用β型鈦合金中氧元素的作用
李 強, 馬 東, 周 凱, 潘 登
(上海理工大學 機械工程學院, 上海 200093)
在生物醫用材料中,金屬生物材料占到了70%~80%.對于人體的一些重要的且難以修復的硬組織,金屬生物材料可以進行有效地治療,提高患者的生活質量.醫用鈦合金強度高、韌性好、彈性模量低、耐蝕性好以及良好的生物相容性等優點,近年來得到廣泛的應用[1].然而,純鈦(c.p.Ti)的硬度較低和耐磨性較差;TC4(Ti-6Al-4V)中V元素具有毒性,Al元素也有引起老年癡呆癥的可能;且TC4的彈性模量約為110 GPa,遠高于人骨的彈性模量(10~35 GPa),會出現“應力屏蔽”現象,導致植入體出現骨萎縮和植入體松動或者斷裂[2].β型鈦合金具有更低的彈性模量(50~60 GPa),因此開發以Mo,Zr,Ta,Nb等無毒元素組成的低模量β型鈦合金,成為近年來研究的熱點.
然而,β型鈦合金普遍強度較低.固溶強化和彌散強化是鈦合金主要強化手段.O,N,H等間隙元素的固溶強化為有效的強化方式之一.這些元素僅少量添加,即對鈦合金的相變和力學性能產生重要的影響.O和N是鈦的α相穩定元素,擴大了α相區,提高了β相轉變溫度,它們對鈦合金有著良好的固溶強化作用,并且可以提高硬度和耐磨性.H可以有效地降低β相轉變溫度,但在鈦合金從高溫冷卻時,容易出現氫脆,降低了鈦合金的韌性,故在β鈦合金中使用較少[3].O以TiO2的形式在熔煉過程中加入,是目前研究最為廣泛的間隙元素.本文圍繞O對組織、相變、力學性能和超彈性的作用展開論述,闡述了O的作用,并對今后的發展提出展望.
1 O對β型鈦合金相變和組織的影響
1.1 加O的β型鈦合金的顯微組織
β鈦合金中主要以等軸β相為主.Wei等[4]認為,在Ti-Nb-Ta-Zr合金中,O含量在0.26%~0.53%(無特殊說明時,%均為質量分數)時,隨著O含量的增加,合金晶粒逐漸均勻細化,晶界變得清晰.這是由于O原子容易在晶界和位錯附近偏析,抑制位錯滑移和晶界的遷移,使晶粒生長受到限制,晶粒得到細化.β相中O的溶解度僅為2.0%.當O含量過高時,TiO2聚集會導致合金局部O含量更高.當O沿著晶界擴散到合金內部,就會出現O偏析,導致晶界強度降低,誘導合金脆化[5].由于間隙元素O有很強的固溶強化作用,鈦合金在冷軋狀態時出現透鏡狀孿晶結構,而隨著O含量的增加,冷軋態合金的透鏡狀孿晶結構開始減小.
1.2 O對β型鈦合金″ω相變的影響
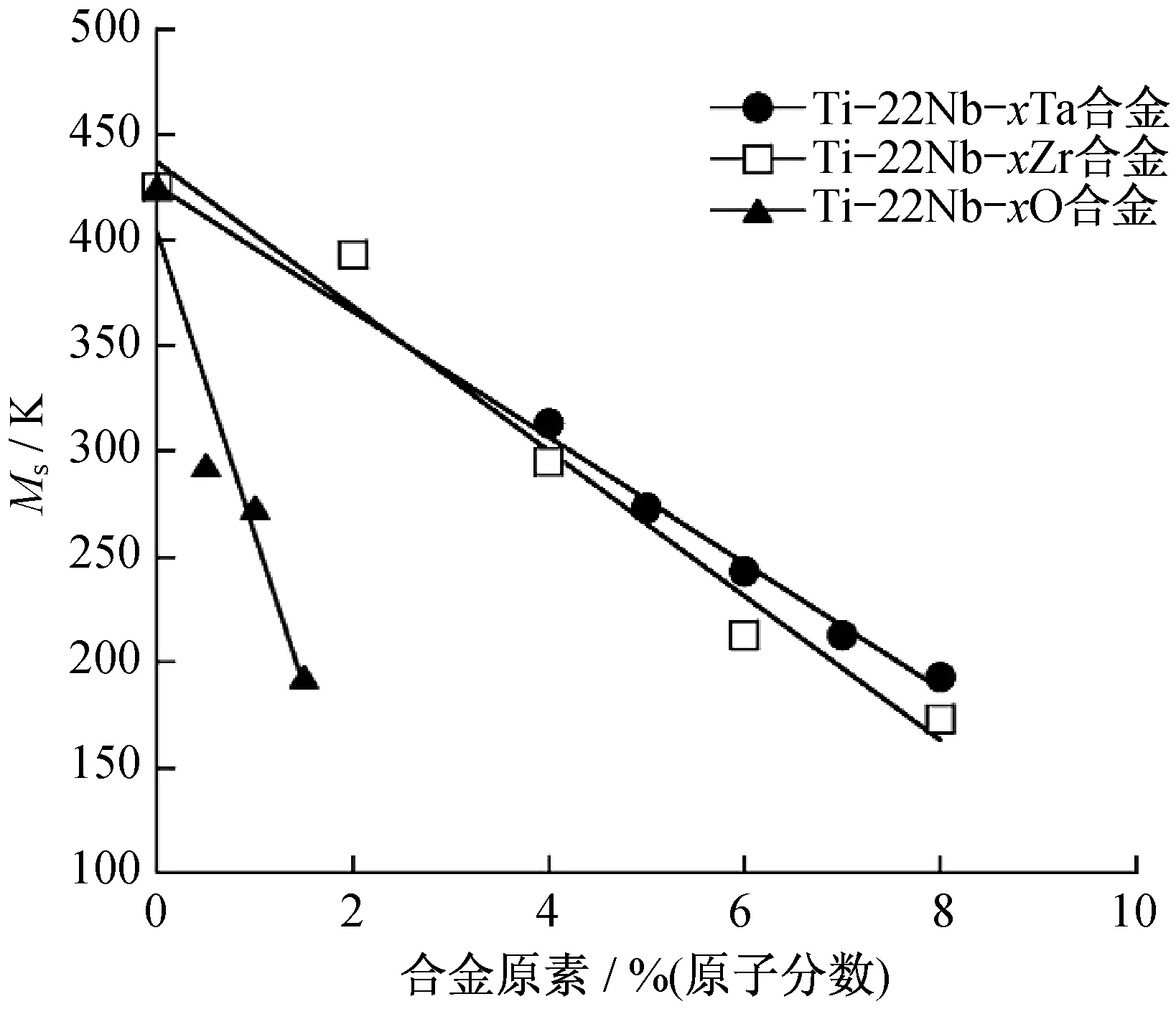
圖1 O對Ti-22Nb合金的馬氏體轉變開始溫度的影響[6]Fig.1 Effect of oxygen on martensitic transformation start temperature of Ti-22Nb alloy[6]

圖2 Ti-23Nb-0.7Ta-2Zr和Ti-23Nb-0.7Ta-2Zr-1.2O合金的光學顯微組織[8]Fig.2 Microstructures of the Ti-23Nb-0.7Ta-2Zr and Ti-23Nb-0.7Ta-2Zr-1.2O alloys observed by optical microscopy[8]
1.3 O對β型鈦合金ω相變的影響
O是間隙元素,占據著晶體體心立方的間隙位置,從而抑制了原子位錯、無熱ω相和變形誘發的ω相的形成.Banerjee等[12]認為無熱ω相和形變誘導ω相的形成是由于晶面坍塌機理而成,見圖3.
圖3 晶面坍塌機理示意圖[12]Fig.3 Schematic illustration of lattice collapse mechanism [12]
De Fontaine等[13]發現,通過加入O可以抑制鈦合金中無熱ω相,并通過蒙特卡洛方法模擬β→ω相變的微觀過程.在此基礎上,Williams等[14]提出了應力場作用機制,認為間隙O的應力場和<111>錯位原子列的應力場存在相互作用,這種相互作用阻礙了<111>錯位原子列的有序化,從而抑制了ω相的產生.
2 O元素對β型鈦合金性能的影響
2.1 O對β型鈦合金力學性能的影響
生物醫用材料中,醫用鈦合金作為硬組織修復和替代等方面材料時必須滿足較高的強度、硬度、良好的塑性和低彈性模量等特點.表1列出了典型醫用鈦合金的力學性能.由表1可知,Ti-15Mo-3Nb-0.3O和Ti-35Nb-5Ta-7Zr-0.4O兩種含O合金具有高強度的同時保持了較低的彈性模量,具有較好的綜合力學性能.同時,添加少量的O能夠明顯提高鈦合金的疲勞強度.
盡管普遍認為添加O會降低鈦合金的塑性,但Geng等[15]在研究添加O的Ti-29Nb-13Ta-4.6Zr(TNTZ)合金中發現,拉伸測試中的伸長率出現反常現象,見圖4.含O量分別為0.14%,0.33%和0.70%的Ti-29Nb-13Ta-4.6Zr合金,其抗拉強度隨O含量的增加而提高,其伸長率先降低后增加.0.33%O的合金伸長率、強度均低于0.70%O的合金[15],其機理還需進一步研究.
表1 典型醫用鈦合金的力學性能[16]Tab.1 Mechanical properties of typical biomedical titanium alloys[16]
圖4 室溫下TNTZ-(0.14,0.33,0.70mass%)O合金的力學性能[15]Fig.4 Mechanical properties of TNTZ-(0.14,0.33,0.70 mass pct) O alloys at roomtemperature[15]
2.2 O對超彈性和形狀記憶的影響
圖5是Ti-23Nb和(Ti-23Nb) -1.0O合金的DSC曲線圖,其中Ti-23Nb合金的Ms為378 K,而(Ti-23Nb) -1.0O合金中沒有任何峰值.圖6為室溫下Ti-23Nb和(Ti-23Nb) -1.0O合金的應力應變曲線,(Ti-23Nb) -1.0O合金不僅強度高,且在卸載后應變基本完全回復(虛線),表現現出了良好的超彈性[10].這種添加O獲得增強的超彈性原因在于加入O提高β相的臨界滑移應力,使其大于產生應力誘發馬氏體相變的臨界應力,避免馬氏體相變前β相產生滑移.類似的,圖7是O含量對Ti-22Nb合金超彈性的影響[17].圖7中,當O含量增加時,合金的屈服強度隨之增加,可恢復變形也隨之增加.
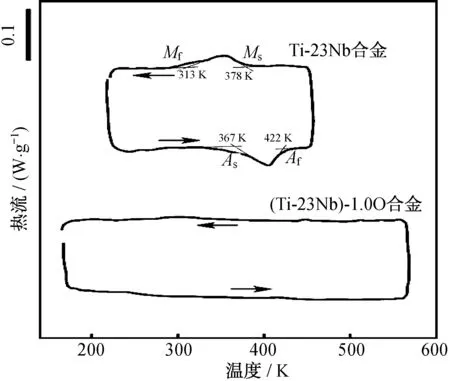
圖5 Ti-23Nb和(Ti-23Nb) -1.0O合金的DSC曲線[10]Fig.5 DSC curves for Ti-23Nb and (Ti-23Nb)-1.0O alloys[10]
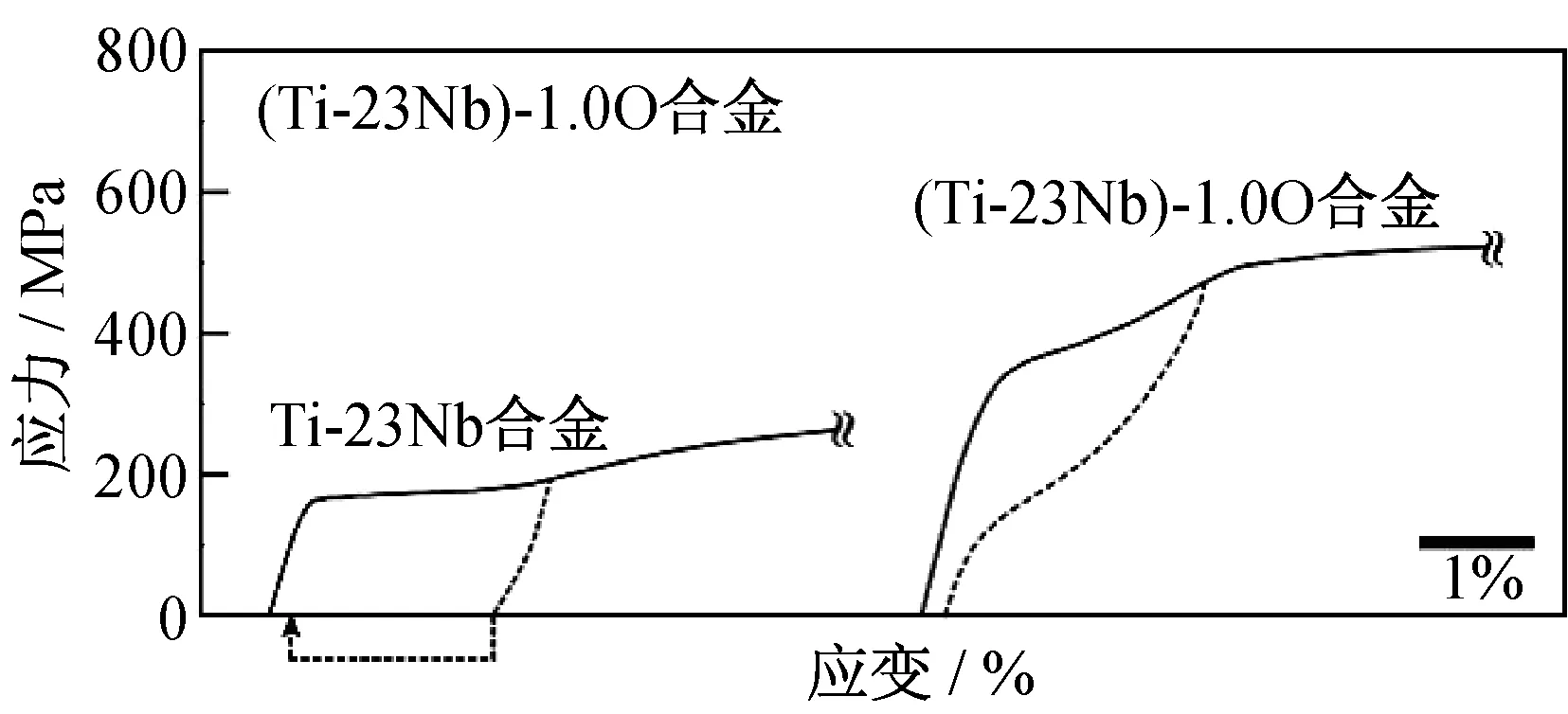
圖6 Ti-23Nb和(Ti-23Nb) -1.0O合金室溫應力應變曲線[10]Fig.6 Stress-strain curves obtained at room temperature for the Ti-23Nb and (Ti-23Nb)-1.0O alloys [10]
3 總結和展望
O對β型鈦合金的作用主要體現在以下兩個方面:
(1) O具有顯著的固溶強化作用,提高了β相的臨界滑移強度,使得合金強度顯著增加.但其對塑性的影響需綜合考慮β相的變形機制和位錯等因素.
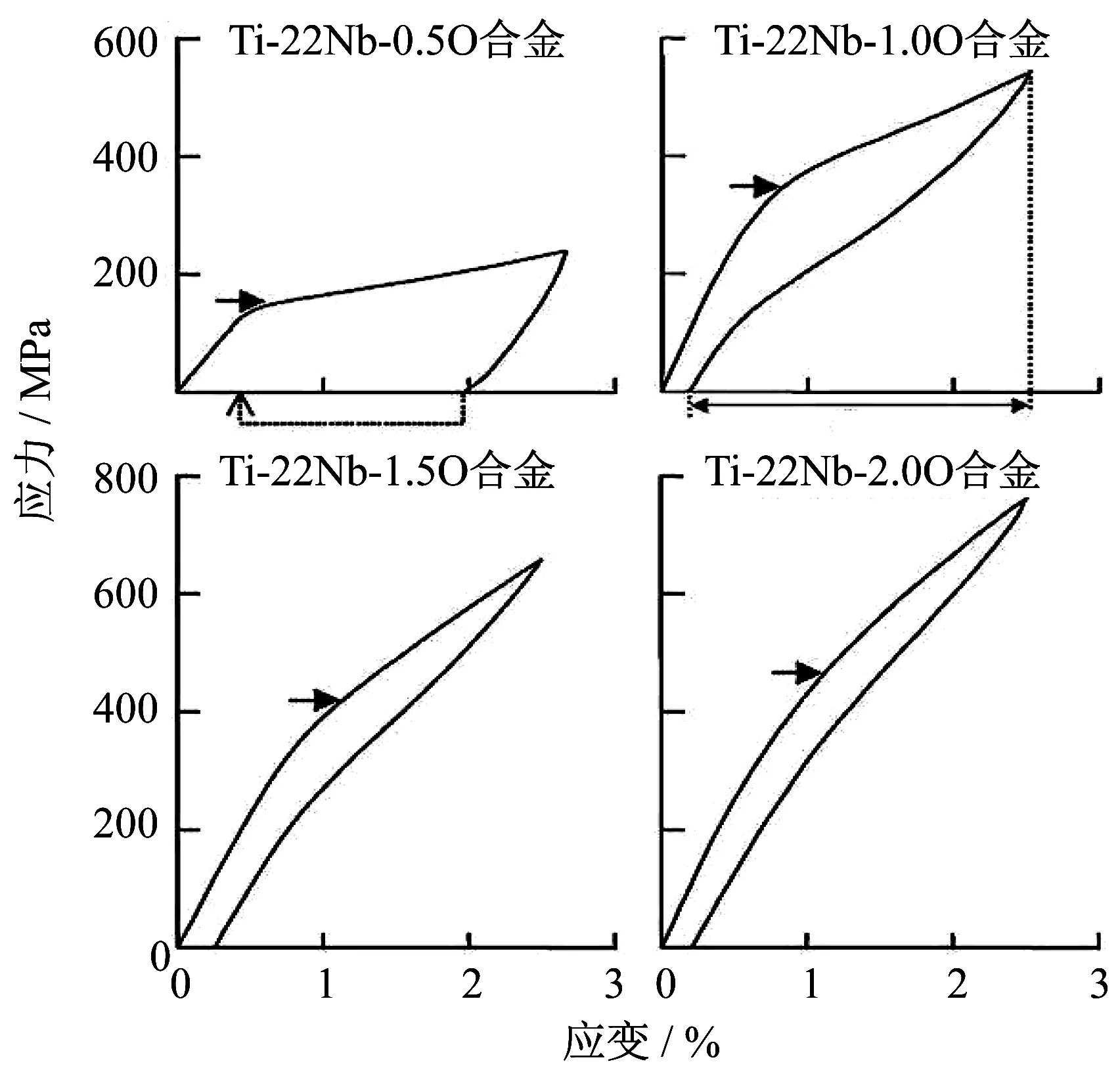
圖7 1 173 K固溶1.8 ks的 Ti-22Nb-(0~2.0)O室溫下應力應變曲線[17]Fig.7 Stress-strain curves at room temperature for the Ti-22Nb-(0-2.0) O alloys subjected to solution treatment at 1 173 K for 1.8 ks[17]
(2) O抑制淬火過程馬氏體轉變,并降低馬氏體轉變的Ms點,與固溶強化相結合,可以提高合金超彈性和形狀記憶效應.
綜上所述,適量O是改善醫用β型鈦合金的有效途徑,合金可以獲得高強度、低模量、良好韌性等優異的綜合力學性能,以及高的超彈性和形狀記憶效應.開發綜合性能更為優異的含O的β型鈦合金及其相關機理探討將是今后主要的研究方向.
[1]趙永慶,陳永楠,張學敏,等.鈦合金相變及熱處理[M].長沙:中南大學出版社,2012.
[2]NIINOMI M.Mechanical properties of biomedical titanium alloys[J].Materials Science and Engineering:A,1998,243(1/2):231-236.
[3]YOSHIMURA H,NAKAHIGASHI J.Ultra-fine-grain refinement and superplasticity of titanium alloys obtained through protium treatment[J].Inernational Journal of Hydrogen Energy,2002,27(7/8):769-774.
[4]WEI Q Q,WANG L Q,FU Y F,et al.Influence of oxygen content on microstructure and mechanical properties of Ti-Nb-Ta-Zr alloy[J].Materials & Design,2011,32(5):2934-2939.
[5]MOFFAT D L,LARBALESTIER D C.The compcetition between martensite and omega in quenched Ti-Nb alloys[J].Metallurgical Transactions A,1988,19(7):1677-1686.
[6]MIYAZAKI S,KIM H Y,HOSODA H.Development and characterization of Ni-free Ti-base shape memory and superelastic alloys[J].Materials Science and Engineering:A,2006,438-440:18-24.
[7]SAITO T,FURUTA T,HWANG J H,et al.Multifunctional alloys obtained via a dislocation-free plastic deformation mechanism[J].Science,2003,300(5618):464-467.
[8]BESSE M,CASTANY P,GLORIANT T.Mechanisms of deformation in gum metal TNTZ-O and TNTZ titanium alloys:A comparative study on the oxygen influence[J].Acta Materialia,2011,59(15):5982-5988.
[9]TANE M,NAKANO T,KURAMOTO S,et al.Low Young’s modulus in Ti-Nb-Ta-Zr-O alloys:Cold working and oxygen effects[J].Acta Materialia,2011,59(18):6975-6988.
[10]TAHARA M,KIM H Y,INAMURA T,et al.Lattice modulation and superelasticity in oxygen-added β-Ti alloys[J].Acta Materialia,2011,59(16):6208-6218.
[11]WEI L S,KIM H Y,MIYAZAKI S.Effects of oxygen concentration and phase stability on nano-domain structure and thermal expansion behavior of Ti-Nb-Zr-Ta-O alloys[J].Acta Materialia,2015,100:313-322.
[12]BANERJEE S,MUKHOPADHYAY P.Transformations related to omegastructures[M].Oxford:Elsevier Science Ltd,2007.
[13]DE FONTAINE D,PATON N E,WILLIAMS J C.The omega phase transformation in titanium alloys as an example of displacement controlled reactions[J].Acta Metallurgica,1971,19(11):1153-1162.
[14]WILLIAMS J C,DE FONTAINE D,PATON N E.The ω-phase as an example of an unusual shear transformation[J].Metallurgical Transactions,1973,4(12):2701-2708.
[15]GENG F,NIINOMI M,NAKAI M.Observation of yielding and strain hardening in a titanium alloy having high oxygen content[J].Materials Science & Engineering A,2011,528(16/17):5435-5445.
[16]ZHAO X F,NIINOMI M,NAKAI M,et al.Optimization of Cr content of metastable β-type Ti-Cr alloys with changeable Young’s modulus for spinalfixation applications[J].Acta Biomaterialia,2012,8(6):2392-2400.
[17]KIM J I,KIM H Y,HOSODA H,et al.Shape memory behavior of Ti-22Nb-(0.5-2.0)O(at%) biomedical alloys[J].Materials Transactions,2005,46(4):852-857.

