腹主動脈瘤組織中HIF-1α、MMP-2及MMP-9的表達及意義
李維顏 張 毅 谷順通 (天津市第五中心醫院血管外科,天津 300450)
腹主動脈瘤組織中HIF-1α、MMP-2及MMP-9的表達及意義
李維顏 張 毅 谷順通 (天津市第五中心醫院血管外科,天津 300450)
目的探討低氧誘導因子(HIF)-1α、基質金屬蛋白酶(MMP)-2及MMP-9在腹主動脈瘤(AAA)組織中的表達及意義。方法采用免疫組化法檢測68例AAA及20例正常腹主動脈組織中HIF-1α、MMP-2及MMP-9的表達,并分析三者與臨床病理參數的關系。結果HIF-1α表達于AAA中膜及外膜平滑肌細胞、巨噬細胞的細胞核中,MMP-2表達于AAA中膜及外膜平滑肌細胞的細胞質中,MMP-9表達于AAA中膜及外膜平滑肌細胞、巨噬細胞的細胞質中,三者在正常腹主動脈組織中均不表達。AAA中HIF-1α、MMP-2及MMP-9的陽性率顯著高于正常腹主動脈(P<0.001)。AAA中動脈瘤直徑≥5.0 cm的患者HIF-1α、MMP-2及MMP-9的表達高于動脈瘤直徑<5.0 cm者(P<0.001);AAA中有發生心腦血管意外史患者HIF-1α、MMP-2及MMP-9的表達高于未發生者(P<0.001)。AAA中HIF-1α、MMP-2及MMP-9與年齡、性別、有無吸煙史及高血壓無關。同時AAA中HIF-1α、MMP-2及MMP-9表達兩兩呈正相關。結論HIF-1α在AAA中高表達,并與MMP-2及MMP-9起協同作用,在AAA的發生發展中起重要作用。
腹主動脈瘤;低氧誘導因子-1α;基質金屬蛋白酶-2;基質金屬蛋白酶-9
腹主動脈瘤(AAA)是一種腹主動脈壁的三層結構持續性擴張到正常腹主動脈直徑的1.5倍以上的動脈退行性疾病,一旦AAA破裂后,得不到及時救治其死亡率達到90%以上,并且其發病率居動脈瘤首位〔1〕。目前研究認為AAA是遺傳、環境、解剖學因素、免疫炎癥反應、血流動力學、病原微生物及平滑肌細胞凋亡等因素共同作用的結果〔2〕。吸煙、高血壓、動脈粥樣硬化、血脂異常等是AAA發生的危險因素,其中動脈粥樣硬化使動脈壁缺血、營養不足,進而使中層膜平滑肌細胞凋亡〔3〕。低氧誘導因子(HIF)-1α是缺血缺氧環境的中心調節因子,其信號通路與眾多血管疾病密切相關,包括動脈粥樣硬化、主動脈瘤、肺動脈高壓與慢性靜脈疾病等〔4,5〕。另外,基質金屬蛋白酶(MMPs)介導的動脈壁彈力纖維及膠原纖維的降解及損傷是AAA病理最直觀的表現。研究顯示,在AAA形成過程中MMPs活性提高〔6〕。同時有研究表明HIF-1α對MMP-2及MMP-9的表達具有調控作用〔7〕,但三種在AAA中的聯合檢測及意義在國內尚未見報道,本研究將對此展開討論。
1 材料與方法
1.1一般資料 取2011年1月至2016年10月天津市第五中心醫院手術,術前經影像學及臨床診斷證實為AAA的患者68例標本,其中男60例,女8例,≥60歲59例,<60歲9例,年齡68~85歲,中位年齡67歲。根據手術前1 w血管造影(CTA)測定的動脈瘤體大小分:≥5.0 cm 43例,<5.0 cm 25例。同時選取20例無腹主動脈病史及血管閉塞性病史的器官移植者或尸檢者的正常腹主動脈作為對照。
1.2主要試劑及儀器 兔抗人HIF-1α、MMP-2及MMP-9多克隆抗體均購自武漢博士德生物技術有限公司;二氯基聯苯胺(DAB)顯色試劑盒購自福州邁新生物技術有限公司。
1.3免疫組化法檢測HIF-1α、MMP-2及MMP-9表達 石蠟標本置于二甲苯、無水酒精、95%、85%、75%酒精中脫蠟。3%過氧化氫酶室溫孵育20 min,于枸櫞酸鹽修復液中置于微波爐中修復5 min。10%山羊血清室溫下封閉30 min。一抗溶液(兔抗人HIF-1α、MMP-2及MMP-9多克隆抗體,稀釋度為1∶200),4℃過夜孵育,二抗溶液室溫下孵育1 h,DAB顯色后沖洗。蘇木素復染、1%鹽酸分化,氨水反藍。梯度酒精中脫水,二甲苯中透明,中性樹脂封片,并于顯微鏡下觀察。以磷酸鹽緩沖液(PBS)液代替一抗作為陰性對照。
1.4結果判斷 HIF-1α蛋白主要以在細胞核中出現棕黃色或棕褐色的顆粒作為陽性表達,MMP-2及MMP-9蛋白以細胞質出現棕黃色及棕褐色的顆粒為陽性表達,由工作經驗豐富的病理科醫師采用雙盲法閱片。在高倍鏡下隨機選擇5個視野,觀察細胞的染色情況。該切片的總得分是陽性細胞百分率乘以染色評分。按細胞的染色程度評分:未染色為0分,淺黃色為1分,棕黃色為2分,棕褐色為3分。按陽性細胞所占百分率評分:未染色為0分,<25%為1分,25%~50%為2分,≥50%為3分。
1.5統計學方法 應用SPSS17.0進行軟件t檢驗、χ2檢驗及Fisher精確概率法檢驗,相關性分析采用Spearman相關分析。
2 結 果
2.1HIF-1α、MMP-2、MMP-9在AAA及正常腹主動脈中的表達 HIF-1α表達于AAA中膜及外膜平滑肌細胞、巨噬細胞的細胞核中,陽性表達呈棕黃色或棕褐色顆粒,在正常腹主動脈組織中不表達。MMP-2表達于AAA中膜及外膜平滑肌細胞的細胞質中,陽性表達呈棕黃色或棕褐色顆粒,在正常腹主動脈組織中不表達。MMP-9表達于AAA中膜及外膜平滑肌細胞、巨噬細胞的細胞質中,陽性表達呈棕黃色或棕褐色顆粒,在正常腹主動脈組織中不表達。AAA中HIF-1α、MMP-2及MMP-9的陽性率〔61例(89.71%),58例(85.29%)、62例(91.18%)〕顯著高于正常腹主動脈(均為0;χ2=19.42、23.71、28.45;均P<0.001)。
2.2HIF-1α、MMP-2及MMP-9表達與AAA臨床病理參數的關系 AAA中動脈瘤直徑≥5.0 cm者HIF-1α、MMP-2及MMP-9的表達高于動脈瘤直徑<5.0 cm者(P<0.001);AAA中有發生心腦血管意外史患者的HIF-1α、MMP-2及MMP-9的表達高于未發生者(P<0.001)。而AAA中HIF-1α、MMP-2及MMP-9的表達與年齡、性別、有無吸煙史及高血壓無關。見表1。
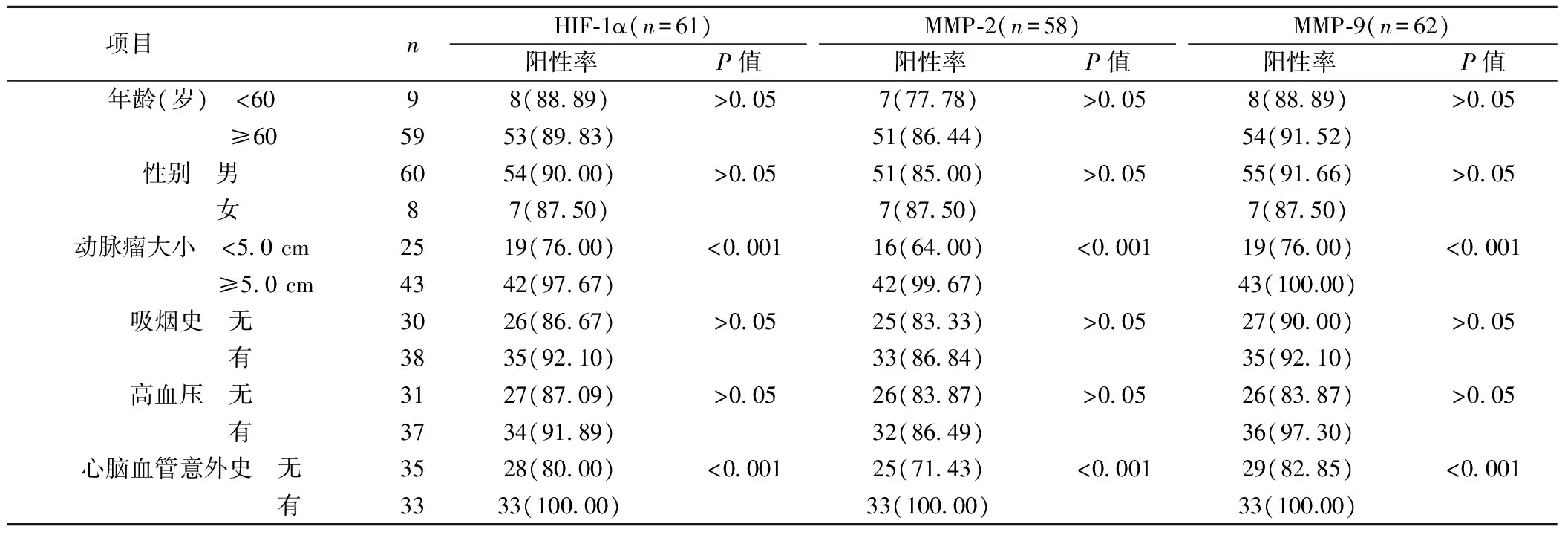
表1 HIF-1α、MMP-2及MMP-9表達與AAA臨床病理參數的關系〔n(%)〕
2.3HIF-1α、MMP-2及MMP-9表達的相關性 AAA中HIF-1α與MMP-2,HIF-1α與MMP-9,MMP-2與MMP-9表達呈正相關(r=0.428、0.452、0.517,均P<0.01)。
3 討 論
腹主動脈壁中膜彈力蛋白及膠原降解,淋巴細胞及巨噬細胞浸潤,平滑肌細胞凋亡及血管新生是AAA組織學最為典型的變化〔2,8〕。而動脈粥樣硬化是AAA發生的危險因素之一,動脈粥樣硬化斑塊使腹主動脈處于缺血狀態,導致動脈壁局部營養缺乏及缺氧,進而導致血栓形成及平滑肌細胞凋亡,加劇AAA的程度〔3〕。HIF-1是缺氧微環境中所產生的一種調控因子,是在肝癌細胞株中發現的一種缺氧元件,主要由HIF-1α及HIF-1β兩種亞基構成,前者為催化亞基,決定著HIF的活性。在正常氧條件下,HIF-1α被羥基化,并通過泛素-蛋白酶體途徑降解。而在缺氧條件下呈幾何倍數的表達。研究顯示HIF-1α信號通路與眾多血管疾病密切相關,包括動脈粥樣硬化、主動脈瘤、肺動脈高壓和慢性靜脈疾病等〔4,5〕。有研究發現在人AAA破裂邊緣發現了HIF-1α的存在〔6〕。也有研究發現HIF-1α能表達于平滑肌及巨噬細胞中〔9〕。同時有研究還發現在血管緊張素Ⅱ 誘導的載脂蛋白E(ApoE)(-/-)小鼠AAA模型成形的28 d中,HIF-1α表達量持續上升〔15〕。本研究結果與研究報道一致〔9,10〕。而且本研究還說明AAA中HIF-1α的高表達提示了瘤體大小、心腦血管病史的有無,與楊世疆等〔11〕的研究通過敲除血管緊張素Ⅱ 誘導的ApoE(-/-)小鼠AAA模型中HIF-1α基因表達后,能顯著減少動脈瘤大小,減弱巨噬細胞浸潤及新生血管形成的研究報道一致。本研究結果提示HIF-1α抑制劑作為AAA的輔助治療藥物無須考慮患者的性別、年齡、吸煙史及高血壓。
彈力蛋白及膠原是腹主動脈細胞外基質的主要成分,正常情況下,二者的合成與降解處于動態平衡當中,維持著腹主動脈的結構與功能,而在病理條件下,由于炎癥細胞(巨噬細胞,淋巴細胞)分泌大量的MMPs,降解彈力蛋白,進一步激活膠原酶,分解膠原蛋白,促使AAA動脈的持續擴張甚至破裂〔8〕。MMPs是一組依賴鈣、鋅離子的中性蛋白水解酶,能夠通過降解細胞外基質成分,參與傷口愈合、妊娠、腫瘤侵襲轉移等。目前研究顯示MMPs活性及表達上升是AAA典型的病理變化,炎癥細胞分泌大量MMPs,降解膠原,膠原分解產物進一步的促使白細胞趨化,浸潤組織,加重AAA〔6〕。其中明膠酶MMP-2能夠降解膠原及彈力蛋白,另外一種分子量最大的明膠酶MMP-9能夠降解Ⅳ型和Ⅴ型膠原和彈力蛋白。目前的研究證實AAA中MMP-2、MMP-9活性,蛋白及mRNA表達均顯著高于正常腹主動脈組織〔6〕。本研究結果與通過抑制MMP-9表達能顯著降低動脈瘤大小的研究報道一致〔6〕,也說明了MMP-2及MMP-9的表達受心腦血管病史的影響,臨床治療上需要考慮此影響。
有研究證實非小細胞肺癌中HIF-1α、MMP-2、MMP-9的表達呈正相關,三者聯合檢測對肺癌的診斷及治療具有顯著意義〔11〕。且低氧能夠誘導人主動脈平滑肌細胞中HIF-1α、MMP-2及MMP-9的高表達〔9〕。在巨噬細胞接觸到鎳后能顯著促進HIF-1α在細胞核內聚集,進而提高MMP-2及MMP-9 mRNA表達。地塞米松能部分通過促進HIF-1α的聚集,加重血管緊張素Ⅱ誘導的AAA,同時還可以提高MMP-2及MMP-9活性〔7〕。從而提示HIF-1α能夠通過調控MMP-2及MMP-9表達在AAA的發生發展中起著重要作用,作為HIF-1α的抑制劑可能成為AAA當前的輔助治療藥物。
1Duncan R,Essat M,Jones G,etal.Systematic review and qualitative evidence synthesis of patient-reported outcome measures for abdominal aortic aneurysm〔J〕.Br J Surg,2017;104(4):317-27.
2Lee MJ,Daniels SL,Drake TM,etal.Risk factors for ischaemic colitis after surgery for abdominal aortic aneurysm:a systematic review and observational meta-analysis〔J〕.Int J Colorectal Dis,2016;31(7):1273-81.
3高 冉,任 夢,李 瑤,等.腹主動脈瘤炎癥機制的研究進展〔J〕.生理科學進展,2016;47(2):88-92.
4Oya K,Sakamoto N,Sato M.Hypoxia suppresses stretch-induced elongation and orientation of macrophages〔J〕.Biomed Mater Eng,2013;23(6):463-71.
5Takahara Y,Tokunou T,Kojima H,etal.Deletion of hypoxia-inducible factor-1alpha in myeloid lineage exaggerates angiotensin II-induced formation of abdominal aortic aneurysm〔J〕.Clin Sci(Lond),2017;131(7):609-20.
6劉凡運,唐 博,孫建明.基質金屬蛋白酶-9在腹主動脈瘤中的研究進展〔J〕.重慶醫學,2017;46(4):543-5.
7Tsai SH,Huang PH,Hsu YJ,etal.Inhibition of hypoxia inducible factor-1alpha attenuates abdominal aortic aneurysm progression through the down-regulation of matrix metalloproteinases〔J〕.Sci Rep,2016;6:28612.
8武亞麗,童雪影,鄭紅波,等.改良大鼠腹主動脈瘤模型的建立〔J〕.中國老年學雜志,2014;34(15):4256-9.
9Erdozain OJ,Pegrum S,Winrow VR,etal.Hypoxia in abdominal aortic aneurysm supports a role for HIF-1alpha and Ets-1 as drivers of matrix metalloproteinase upregulation in human aortic smooth muscle cells〔J〕.J Vasc Res,2011;48(2):163-70.
10Yang L,Shen L,Li G,etal.Silencing of hypoxia inducible factor-1alpha gene attenuated angiotensin -induced abdominal aortic aneurysm in apolipoprotein E-deficient mice〔J〕.Atherosclerosis,2016;252:40-9.
11楊世疆,朱志軍,薛亞軍,等.非小細胞肺癌癌組織HIF-1α及MMP表達研究〔J〕.中華全科醫學,2013;11(4):513-66.
R73
A
1005-9202(2017)24-6145-03;
10.3969/j.issn.1005-9202.2017.24.060
李維顏(1979-),男,主治醫師,主要從事血管外科疾病的腔內手術治療研究。
〔2017-09-27修回〕
(編輯 袁左鳴/滕欣航)

