佛手果低聚糖超聲波輔助水浸提工藝研究
呂瑤瑤,李若蹊,張延杰,夏 雨,王 娟
(1.華南理工大學食品科學與工程學院,廣東 廣州 510641;2.咀香園健康食品(中山)有限公司,廣東 中山 528437)
佛手果低聚糖超聲波輔助水浸提工藝研究
呂瑤瑤1,2,李若蹊1,張延杰2,夏 雨2,王 娟1
(1.華南理工大學食品科學與工程學院,廣東 廣州 510641;2.咀香園健康食品(中山)有限公司,廣東 中山 528437)
利用超聲波輔助水提取技術,以腌制佛手果為原料,考察提取時間、超聲時間、提取溫度、料液比對佛手果低聚糖提取得率的影響,采用正交試驗對佛手果低聚糖的提取工藝進行優化,從單因素試驗、正交試驗結果以及節約能源角度,得出最佳工藝條件為:提取時間2 h,超聲時間20 min,提取溫度80℃,料液比1∶8,在此條件下,佛手果低聚糖得率為5.99(±0.15)%。采用體外結合膽酸鹽實驗評價佛手果低聚糖的降血脂功能,結果顯示,佛手果低聚糖對膽酸鈉(SC)、牛磺膽酸鈉(STC)的吸附能力較強,其結合量分別為20.30(±0.39)、19.61(±0.71)μmol/mg,對甘氨膽酸鈉(SGC)吸附能力較弱,其結合量只為14.38(±2.23)μmol/mg,提示佛手果低聚糖可能具有一定的降血脂功能。
佛手果;低聚糖;超聲波;提取;降血脂
低聚糖(Oligosaccharide),又稱寡糖,是由2~10個單糖通過末端的還原性羥基與其他單糖的羥基形成糖苷鍵,糖苷鍵縮聚連接形成的直鏈或支鏈的低度聚合糖[1]。低聚糖結構復雜,種類繁多,使低聚糖多樣的功能有了分子結構上的解釋,體現在生物的新陳代謝過程中[2]。低聚糖作為一種有著多種生理功能,熱量低甜度小,對人體無毒副作用且生產原料充足的小分子物質有著極大的研究空間和研究潛力,其保健功能的開發有著無限前景,可作為新型保健食品的材料和添加劑,滿足人們對保健品更細致和更養生的要求。
前人研究多側重于佛手果多糖、揮發油和黃酮類物質[3-4],對于佛手低聚糖的研究暫時是一片空白,而陳摯等[5]在胡蘆巴調血脂研究時發現低聚糖在調血脂功能等多方面效果優于多糖。目前低聚糖物理提取手段有溶劑浸提法、超聲波輔助浸提法、微波輔助浸提法、超高壓輔助浸提法和膜分離法[6-8]。提取生物活性成分時,為了保留其活性和性質常常采用超聲波[9]或超高壓等提取溫度較低,對成分保留較為完好的方法。本試驗主要針對佛手果低聚糖的提取工藝方法及其降血脂功能,選擇在超聲波輔助下使用水浴浸提法進行研究,與傳統水浴浸提法相比提取效率更高,并優化提取工藝。低聚糖含量測定使用苯酚-硫酸法,依據顯色狀況判斷其糖種類,利用紫外分光光度計測定吸光值計算含量,研究不同工藝條件下低聚糖得率的變化[10],并采用體外結合膽酸鹽法測定佛手果低聚糖對3種膽酸鹽的吸附量,初步研究其降血脂效果[11-12],為佛手果低聚糖的進一步研究提供一定的數據支持。
1 材料與方法
1.1 試驗材料
新鮮佛手果、腌制佛手果,均由廣東展翠食品有限公司提供。
JY92-ⅡDN超聲波細胞粉碎儀,寧波新芝生物股份有限公司;SHA-B恒溫水浴振蕩器,常州奧華儀器有限公司;SHZ-D(Ⅲ)循環水式真空泵,鞏義市予華儀器公司;紫外/可見分光光度計,日本島津公司;TDL-5-A離心機,上海安亭科學儀器廠;TDL-5-A離心機,上海安亭科學儀器廠;RE-52AA真空旋轉蒸發器,上海亞榮生化儀器廠;JA1003電子天平,上海精密科學儀器有限公司。
1.2 試驗方法
1.2.1 佛手果低聚糖提取 按照一定的料液比將佛手果與水混合,提取(超聲波輔助水浸提,超聲波功率650 W),離心、抽濾去除果渣,旋蒸濃縮,濃縮至原體積1/4左右,servage法去除蛋白質,4倍體積無水乙醇沉淀,去除脂類、多糖,靜置,離心(3 000 r/min,15 min),收集上清液,旋蒸濃縮,濃縮液即為佛手果低聚糖粗提取液[8,13]。
1.2.2 低聚糖含量測定[14-15]采用苯酚-硫酸法對低聚糖進行測定。其原理是樣品溶液中的可溶性糖與濃硫酸反應脫水后,生成糖醛或糖醛衍生物。糖醛衍生物能與苯酚發生縮合反應,生成有色物質。樣品中糖種類不同可呈現不同顏色反應—單糖可反應顯紫紅色,低聚糖則呈棕黃色。在490 nm處己糖有最大吸收峰,吸收值與糖含量呈線性關系,據此可測得所含低聚糖量,并根據其顏色不同確定糖種類[14-15]。
標準曲線的繪制:稱取干燥的105℃無水葡萄糖150 mg于500 mL容量瓶中,配制成0.30 mg/mL標準葡萄糖溶液,按表1配制成階梯濃度的葡萄糖標準溶液,以2.0 mL蒸餾水作為空白對照。

表1 葡萄糖標準溶液的配制
每支試管中加入6%苯酚溶液1.0 mL,混勻后迅速加入7.0 mL濃硫酸,立即置于冷水浴中。20 min后于490 nm處測定吸光值,繪制標準曲線,見圖1。

圖1 葡萄糖標準曲線
得回歸方程:y = 10.94x + 0.017,R2=0.999,表明在490 nm波長下,吸光度值與葡萄糖含量有良好的線性關系。
樣品溶液的測定:將所獲得的粗沉淀溶解于250 mL蒸餾水,吸取5 mL于100 mL容量瓶中配制成樣品溶液。準確吸取樣品溶液0.5 mL于20 mL具塞試管中,用蒸餾水補充至2.0 mL。向試管中分別加入1.0 mL 6%的苯酚溶液后搖勻,再迅速加入濃硫酸7.0 mL,并將試管置于冷水浴中冷卻。取2.0 mL蒸餾水于試管中依次加入苯酚和硫酸溶液作為空白對照。待20 min后即可于490 nm波長處測定樣品的吸光度。每組樣品測量兩次取平均值。依據標準曲線計算樣品溶液中的低聚糖含量,得出低聚糖得率:

1.2.3 佛手果低聚糖提取的單因素試驗 選取料液比、浸提溫度、超聲時間、提取時間進行單因素試驗,考察這些因素對佛手果低聚糖提取效果的影響[16]。
1.2.4 佛手果低聚糖提取的正交試驗 在單因素試驗基礎上,采用4因素3水平按L9(34)正交設計優化佛手果低聚糖的提取工藝,各因素及水平設計如表2所示,每個處理3次重復[17-18]。

表2 佛手果低聚糖提取正交試驗因素水平
1.2.5 降血脂功能測定 采用所測定目標成分對膽酸鹽吸附率的方法表示低聚糖降血脂的能力。移取0.5 mL低聚糖粗糖液于試管中,用pH=6.8的磷酸緩沖液補至2 mL;并以2 mL磷酸緩沖液為空白對照,分別加入2 mL膽酸鹽(牛磺膽酸鈉STC、甘氨膽酸鈉SGC、膽酸鈉SC)溶液,37℃恒溫振蕩1 h,離心(4 000 r/min,20 min),取1.5 mL上清液于具塞試管中,加入4.5 mL 60%的硫酸溶液混合均勻,70℃水浴20 min,冰浴5 min,紫外分光光度計387 nm處測定吸光度,3次重復[19]。

圖2 膽酸鹽的標準曲線
標準曲線繪制:準確分別稱量膽酸鈉(SC)、牛磺膽酸鈉(STC)、甘氨膽酸鈉(SGC)各0.0216、0.0268、0.0244 g于50 mL容量瓶中,配制成1 μmol/mL標準膽酸鹽溶液,按表配制成階梯濃度的膽酸鹽標準溶液。以1.5 mL緩沖液作為空白對照。所得標準曲線見圖2,得膽酸鈉(SC)標準曲線為y = 2.828x + 0.008,R2= 0.994。牛磺膽酸鈉(STC)的標準曲線為y =1.757x + 0.063,R2=0.997。甘氨膽酸鈉(SGC)的標準曲線為y = 2.356x + 0.003,R2=0.996。

表3 膽酸鹽標準溶液的配制
2 結果與分析
2.1 佛手果低聚糖提取單因素試驗
2.1.1 提取時間對佛手果低聚糖的影響 稱取30 g腌制佛手果于500 mL燒杯中,選取料液比1∶10 g/mL,浸提溫度80℃,超聲時間10 min,測定提取時間分別為1.0、1.5、2.0、2.5和3.0 h時佛手果低聚糖的得率,結果見圖3。由圖3可知,當提取時間在1~3 h時,佛手果低聚糖的得率隨提取時間的延長不斷升高,當提取時間為2.5 h時,低聚糖得率達到最高、為3.40%,隨后呈現下降趨勢。提取時間越長,原料中的成分在溶劑中溶解和擴散得越充分和完全,提取率越高。但成分量是一定的,當擴散達到平衡后提取率不再增加。此時若再延長提取時間,反而會使雜質增多,使目標成分的溶出受到影響,且提取效率較低,造成能源浪費。
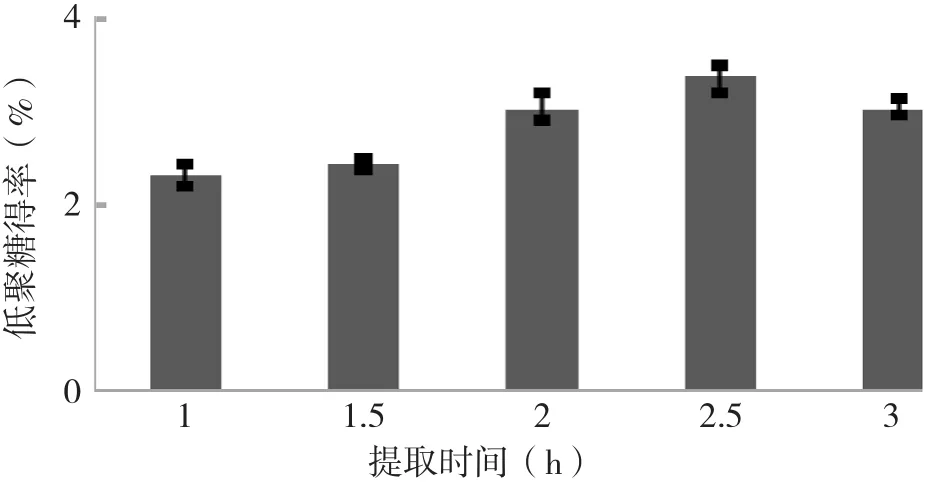
圖3 不同提取時間的低聚糖得率
2.1.2 超聲時間對佛手果低聚糖的影響 稱取30 g腌制佛手果于500 mL燒杯中,選取料液比1∶10 g/mL,浸提溫度80℃,提取時間2 h,測定超聲提取時間5、10、15、20和25 min時佛手果低聚糖的得率,結果如圖4所示。由圖4可知,在5~25 min超聲時間范圍內提取時,佛手果低聚糖得率先隨超聲時間的延長逐漸增加,當超聲時間為15 min時低聚糖得率最高、為2.02%,隨后呈下降趨勢。超聲時間在20、25 min時,低聚糖得率沒有顯著差異。隨著超聲時間增加,細胞被破碎的愈加完全,成分的溶出更加徹底,而低聚糖得率增加。當擴散平衡后,增加超聲時間也不會繼續增加成分的溶出。超聲時間過長會使溶液中雜質增多阻礙糖分溶出,同時隨著溶液溫度上升,劇烈的波動可能導致成分破壞,導致低聚糖得率略有下降,造成能源浪費。

圖4 不同超聲時間的低聚糖得率
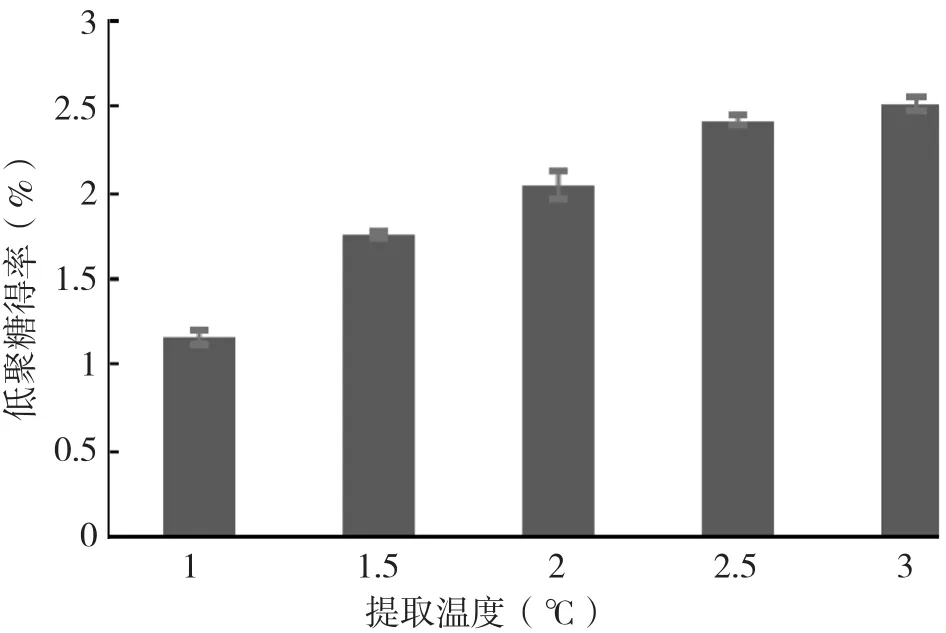
圖5 不同提取溫度的低聚糖得率
2.1.3 提取溫度對佛手果低聚糖的影響 稱取30 g腌制佛手果于500 mL燒杯中,選取料液比1∶10 g/mL,提取時間2 h,超聲時間10 min,測定提取溫度 40、50、60、70、80℃時佛手果低聚糖的得率,結果見圖5。由圖5可知,在40~80℃提取時,佛手果低聚糖得率隨提取溫度的提高呈上升趨勢,提取溫度為80℃時低聚糖得率最高、為2.52%,但與70℃時的得率沒有顯著性差異。溫度的提高有助于細胞內成分更快地擴散到溶劑中,增加糖分在溶劑中的溶解率。當溫度達70℃后,繼續升溫對低聚糖得率的增加不明顯。
2.1.4 料液比對佛手果低聚糖的影響 稱取30 g腌制佛手果于500 mL燒杯中,選取提取時間2 h,浸提溫度80℃,超聲時間10 min,料液比分別為 1∶4、1∶6、1∶8、1∶10和 1∶12時佛手果低聚糖的得率,結果見圖6。由圖6可知,在1∶4~1∶12料液比范圍內提取時,佛手果低聚糖得率隨料液比的降低呈先升高再下降隨后趨于平緩的趨勢。當料液比為1∶6時,低聚糖得率最高、為1.78%。溶劑用量增加,增大了佛手果與溶劑的接觸面積,有利于佛手果低聚糖在溶劑中的溶解。但料液比過小,即溶劑用量過多,會導致后續旋轉蒸發去除溶劑時耗時過長,使低聚糖遭到破壞。同時溶劑用量過多會使佛手果飄浮在溶劑表面,超聲時,超聲波經過溶劑的反射后能量較弱,導致超聲對佛手果的作用減弱,造成低聚糖得率降低。

圖6 不同料液比的低聚糖得率
2.2 佛手果低聚糖提取正交試驗
由表4可知,測超聲波輔助水浴提取佛手果低聚糖的得率受4種因素影響,由R值RB>RA>RC>RD(即1.07>0.62>0.58>0.57)判斷,得影響因素B>A>C>D(即超聲時間>提取時間>提取溫度>料液比)。所得最佳低聚糖提取工藝條件為A2B3C3D3,即提取時間2.5 h,超聲時間20 min,提取溫度80℃,料液比1∶8。該組合不存在于原實驗組中,按優化參數做驗證實驗,結果顯示在該工藝條件下低聚糖得率為5.99(±0.15)%,為最佳提取工藝條件。
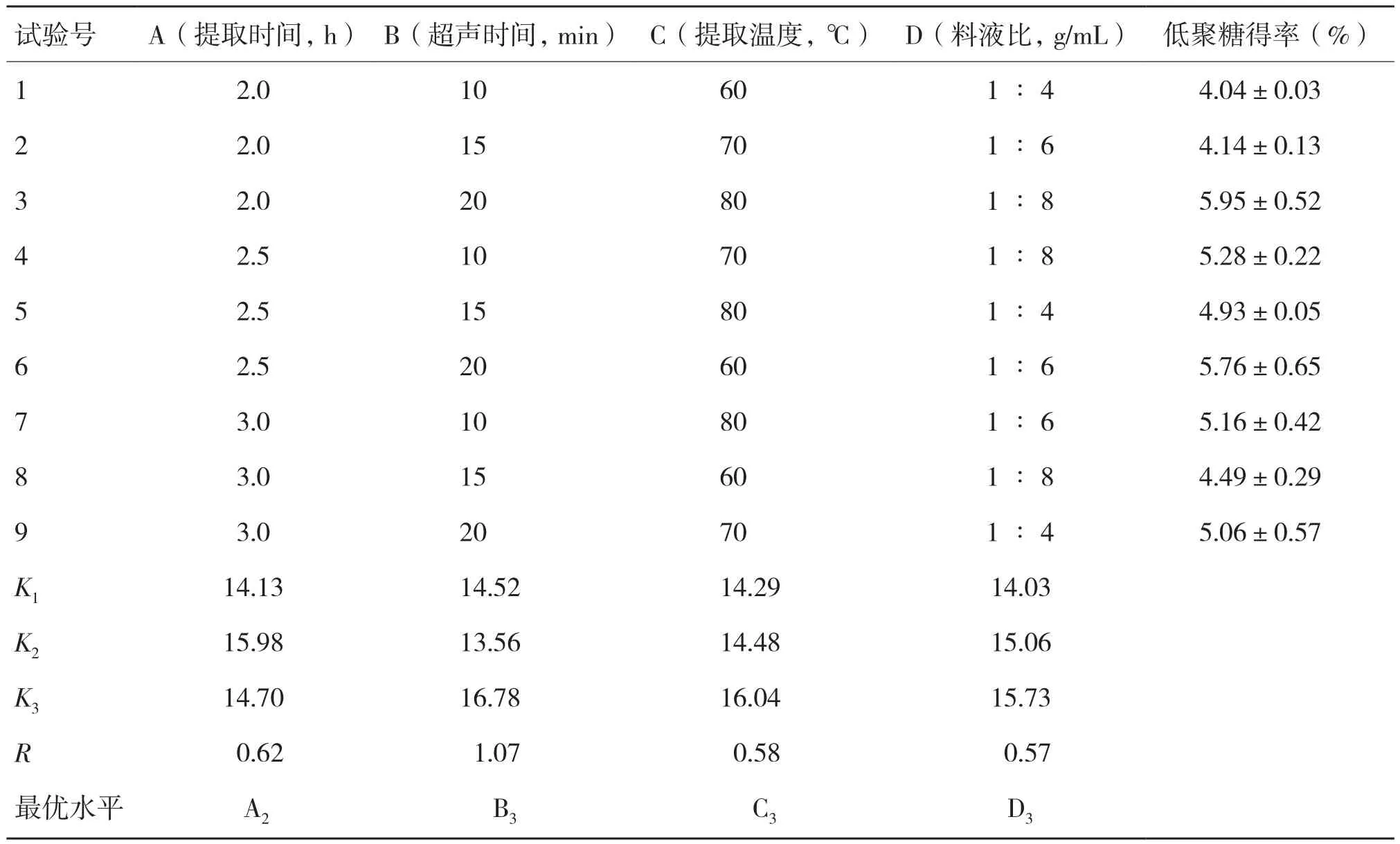
表4 佛手果低聚糖提取條件正交試驗結果
2.3 降血脂功能結果分析
腌制佛手低聚糖粗品與膽酸鹽結合量的結果如下:與膽酸鈉(SC)的結合量為20.30(±0.39)μmol/mg低聚糖;與牛磺膽酸鈉(STC)的結合量為19.61(±0.71)μmol/mg低聚糖;與甘氨酸鈉(SGC)的結合量為14.38(±2.23)μmol/mg低聚糖。
由上可知,佛手果的低聚糖對甘氨膽酸鈉(SGC)吸附能力最弱[20],而對膽酸鈉(SC)和牛磺膽酸鈉(STC)無明顯差別,其吸附能力SGC<SC≈STC。而佛手低聚糖對膽酸鹽的結合量,與夏雨等[10]測量的佛手果多糖相比可發現,低聚糖對膽酸鹽有較好的吸附效果,其吸附能力與佛手黃酮相當,與陳摯等[5]先提取胡蘆巴多糖,再加入纖維素酶進行降解得到胡蘆巴低聚糖所得出的低聚糖在調血脂功能等多方面效果優于多糖結論相似。說明佛手低聚糖有較好的降低膽固醇含量的效果,可能具有較強的降血脂能力,還需要后續實驗驗證。
3 結論與討論
本試驗采用單因素和正交試驗對佛手果低聚糖的提取工藝進行優化,結果表明,4個因素對低聚糖提取效果的影響由大到小依次為:超聲時間>提取時間>提取溫度>料液比;正交試驗結果表明,佛手果低聚糖提取的最佳工藝條件為提取時間2.5 h,超聲時間20 min,提取溫度80℃,料液比1∶8,此時提取的佛手果低聚糖得率最高、為5.99(±0.15)%,但與在試驗號3工藝條件下提取的得率沒有顯著性差異,因此從節約能源角度考慮,選擇提取時間2 h、超聲時間20 min、提取溫度80℃、料液比1:8為最佳工藝條件。
本試驗還采用體外結合膽酸鹽試驗對佛手果低聚糖降血脂[21]能力進行評價,結果表明佛手果低聚糖對膽酸鹽具有一定的吸附力,具有一定的降血脂功能。本試驗對于降血脂功能的測定采取了體外實驗的膽酸鹽結合法,但對于生物是否真的有降血脂功效,需要進一步的動物實驗驗證[22]。
[1] 劉蘭花,姜竹茂,劉云國,等. 功能性低聚糖的制備、功能及應用研究進展[J]. 中國食品添加劑,2015(12):158-166.
[2] 王乃強. 我國低聚糖的研發現狀與前景[J]. 精細與專用化學品,2007(12):1-5.
[3] 嚴瑋. 佛手化學成分和藥理作用研究進展[J].實用中醫藥雜志,2015(31):788-790.
[4] 楊繼,葉安,陸智明,等. 金佛手果葉多糖的體外抗氧化活性研究[J]. 東南園藝,2015(4):7-10.
[5] 陳摯,雷亞亞,黑晶,等. 胡蘆巴多糖及低聚糖調血脂活性研究[J]. 中草藥,2015,46(8):1184-1189.
[6] 趙迎春,盧家炯. 超聲波輔助提取雪蓮果中低聚果糖及其純化的初步研究[J]. 廣西輕工業,2010(1):1-8.
[7] 周泉城. 超聲波輔助提取經膨化大豆粕中低聚糖工藝[J]. 農業工程學報,2008,24(5):245-249.
[8] 唐雪娟. 香蕉低聚糖的分離、結構鑒定及品種比較[D]. 廣州:華南理工大學,2014.
[9] 陳文超,張錦華,葉崢,等. 響應面法優化超聲波輔助提取蘋果渣低聚糖的工藝[J]. 食品工業科技,2017(12):278-286.
[10] 夏雨,王雁勝,張延杰,等. 佛手果營養與活性成分測定及降血脂功能研究[J]. 食品科技,2016(2):70-73.
[11] 張沛然,郭改會. 高血脂癥的中西醫臨床診治[J]. 中國臨床醫生,2012,40(3):18-20.
[12] 許麗萍,柳毅. 高血脂癥的防治[J]. 中國醫藥指南,2013(9):793-794.
[13] 姚飛,張向前. 陜北木棗中低聚糖的提取及其功效研究[D]. 延安:延安大學,2015.
[14] 廖春龍,邱奇琦,印遇龍等. 薄層色譜-苯酚-硫酸法分析大豆低聚糖中棉籽糖含量[J]. 食品科學,2010(16):200-203.
[15] 趙寧,問亞琴,潘秋紅. 苯酚-硫酸法測定干紅葡萄酒中的多糖含量[J]. 中外葡萄與葡萄酒,2011(5):9-12.
[16] 王振斌,劉加友,馬海樂,等. 無花果多糖提取工藝優化及其超聲波改性[J]. 農業工程學報,2014,30(10):262-269.
[17] 蔣梅峰,林勤保. 大棗低聚糖的分離純化及結構分析[J]. 食品科學,2008(8):376-378.
[18] 陳宏陽. 人參低聚糖提取分離純化及活性研究[D]. 長春:吉林農業大學,2013.
[19] 鄧志匯,黃惠華. 茶鮮葉和茶花水提液對膽酸鹽的結合及其降血脂機理的研究[J]. 食品科學,2011(19):96-99.
[20] 趙秀玲. 佛手生理活性成分的研究進展[J]. 食品工業科技,2012(21):393-399.
[21] 顏騰龍,易有金. 藥食兩用中藥降血脂作用研究進展[J]. 食品安全質量檢測學報,2014(3):934-941.
[22] Vincenzo Mollace ,Hypolipemic and hypoglycaemic activity of bergamot polyphenols:From animal models to human studies[J]. Fitoterapia,2011(82):309-316.
Study on ultrasonic assistant water extraction processing of Bergamot oligosaccharides
LYU Yao-yao1,2,LI Ruo-xi1,ZHANG Yan-jie2,XIA Yu2,WANG Juan1
(1. School of Food Science and Engineering,South China University of Technology,Guangzhou 510641,China;2.Juxiangyuan Health Food (ZhongShan) Co.,Ltd. ,Zhongshan 528437,China)
Using preserved Bergamot as raw material,the extraction technology of ultrasonic assisted-water was studied. To optimize the extraction process of bergamot oligosaccharides technology,extraction time,ultrasonic time,extraction temperature,ratio of material to watek chosen as factors which affected the extraction rate by orthogonal test. Considering the results of single factor experiment,orthogonal experiment results and energy conservation,the optimum extraction technology was as follows: extraction time 2 h,ultrasonic time 20 min,extraction temperature 80℃,and ratio of material to water 1∶8. The yield of bergamot oligosaccharide can reach 5.99(±0.15)% under these conditions. The capabilities of bergamot oligosaccharide which reduced blood lipid function was estimated as index by bile salt-binding experiment. The results suggested that bergamot oligosaccharide presented stronger binding ability to sodium cholate (SC),sodium taurocholate (STC),which accounted for 20.30(±0.39)μmol/mg,19.61(±0.71)μmol/mg,respectively,while it presented weaker binding ability to glycocholate(SGC),which accounted for 14.38(±2.23)μmol/mg. Therefore,bergamot oligosaccharide have function of reducing blood lipid.
bergamot;oligosaccharides;ultrasonic;extraction ;lowering blood lipid
S666.9
A
1004-874X(2017)08-0106-07
呂瑤瑤,李若蹊,張延杰,等. 佛手果低聚糖超聲波輔助水浸提工藝研究[J].廣東農業科學,2017,44(8):106-112.
2017-03-06
廣東省產學研合作項目(2014B090904044,2016B090918093)
作者簡介:呂瑤瑤(1988-),女,碩士,工程師,E-mail:881003yy@163.com
王娟(1981-),女,博士,副教授,E-mail:wangjuan@scut.edu.cn
(責任編輯 白雪娜)

