水飛薊素抑制草魚肝細胞脂質蓄積的作用及其機制研究
蕭培珍 吉 紅 張寶彤 葉元土 孫 健 楊 洲 李雪賢 田晶晶
(1. 西北農林科技大學動物科技學院, 楊陵 712100; 2. 北京市營養源研究所水產動物系統營養研究開放實驗室, 北京 100069;3. 蘇州大學基礎醫學與生命科學學院, 蘇州 215123)
水飛薊素抑制草魚肝細胞脂質蓄積的作用及其機制研究
蕭培珍1吉 紅1張寶彤2葉元土3孫 健1楊 洲1李雪賢1田晶晶1
(1. 西北農林科技大學動物科技學院, 楊陵 712100; 2. 北京市營養源研究所水產動物系統營養研究開放實驗室, 北京 100069;3. 蘇州大學基礎醫學與生命科學學院, 蘇州 215123)
為探究水飛薊素(Silymarin)對草魚肝細胞脂質蓄積的作用及其機理, 體外培養草魚肝細胞, 在用400 μmol/L油酸對其進行蓄脂誘導的同時, 采用不同質量濃度的水飛薊素處理24h, 檢測了肝細胞活力、脂質蓄積狀況、抗氧化指標和脂質代謝相關基因表達狀況。結果顯示, 水飛薊素質量濃度在75—125 μg/mL對草魚肝細胞活力無影響(P>0.05); 與單獨采用油酸進行蓄脂誘導的油酸組比較, 水飛薊素和油酸共同處理的水飛薊素組中, 隨著水飛薊素質量濃度的增加, 肝細胞內的脂質含量逐漸降低, 且水飛薊素質量濃度在100—150 μg/mL時的肝細胞脂質蓄積水平顯著降低(P<0.05); 與油酸組相比, 100 μg/mL水飛薊素處理組的脂質含量以時間依賴性的模式顯著降低(P<0.05), 還原型谷胱甘肽含量顯著升高(P<0.05), 脂肪酸合成酶和硬脂酰輔酶A去飽和酶1的mRNA表達量顯著下調(P<0.05)。研究表明, 水飛薊素能夠抑制草魚肝細胞脂質蓄積, 其作用可能與其抑制脂質合成基因的表達有關; 同時, 水飛薊素可能通過提高肝細胞的抗氧化能力發揮保護肝細胞的作用。
水飛薊素; 脂質蓄積; 肝細胞; 草魚; 油酸
飼料油脂不僅能夠為魚體提供能量, 而且是養殖魚類必需脂肪酸的重要來源[1]。研究表明, 提高飼料中脂肪水平能夠節約蛋白質, 提高魚體生長性能, 這已成為當前水產飼料配方技術發展的主要方向之一[2,3]。然而, 過量的脂肪攝入, 會抑制養殖對象生長, 引發脂質在魚體組織如肝胰臟和腹腔脂肪組織中的過度蓄積, 進而引起魚類出現高脂血癥、脂肪肝和脂質過氧化反應等癥狀[4—8]。由于飼料能量攝入過多或營養素不平衡導致肝細胞內脂質過度蓄積, 引起肝細胞脂肪變, 稱為魚類營養性脂肪肝[9]。當前幾乎所有的主要養殖魚類均有發生脂肪肝的報道, 脂肪肝不僅造成魚體對攝入能量的浪費,而且嚴重威脅著魚類健康[10,11]。因此, 預防養殖魚類脂肪肝的發生, 對提高魚類生產性能、改善魚類健康狀況具有重要意義。
水飛薊素(Silymarin)是一種黃酮類植物提取物, 從紫花水飛薊(Silybum marianumL.)的干燥果實中提取, 主要由4種黃酮類化合物組成, 包含水飛薊賓A和B (Silibinin A and B)、異水飛薊素賓A和B(Isosilibinin A and B)、水飛薊亭(Silychristin)、水飛薊寧(Silydianin)[12,13]。在哺乳動物上, 水飛薊素具有保護肝臟、抗氧化、抗炎、抗癌等作用[14—16]。在魚類上, 水飛薊素能夠修復CCl4誘導的鯉肝損傷[17], 降低虹鱒血漿膽固醇含量[18], 抑制斑馬魚的脂質蓄積[19]。本研究室前期研究發現, 水飛薊素能夠降低高脂日糧誘導的草魚肝臟脂質含量的增加[20]。
草魚(Ctenopharyngodon idellus)屬于草食性魚類, 是我國主要的淡水養殖品種之一, 2015年總產量為5.68×109kg, 占全國淡水魚總產量的20.91%(中國漁業統計年鑒, 2016)。有學者指出, 草魚對飼料脂肪的利用能力較低[4,21]。然而, 在實際生產中, 草魚飼料脂質水平越來越高, 導致魚體脂肪肝現象頻繁發生。研究報道, 過量的游離脂肪酸攝入引起肝臟脂質過度蓄積, 導致肝細胞出現脂肪變性, 同時過量的游離脂肪酸也是產生脂毒性的重要介質, 引起細胞受損[22]。因此, 研究草魚脂肪肝防控技術具有重要的理論和應用上的意義。目前, 關于水飛薊素降脂作用的研究有一些報道[19,23—25], 但評價手段較為單一。在哺乳動物上, 有學者通過構建細胞離體培養體系, 采用游離脂肪酸誘導建立脂肪肝細胞模型, 對一些功能性成分進行篩選[26—30], 在魚類上,杜金梁等[31]用油酸構建了建鯉原代脂肪肝細胞損傷模型, 并獲得了澤瀉提取物對油酸誘導的脂肪肝具有保護作用, 而有關就水飛薊素作用離體評價的研究還未見報道。因此, 本研究采用油酸與水飛薊素共同處理草魚肝細胞的技術路線, 探討水飛薊素對草魚肝細胞脂質蓄積的作用和分子機制, 為養殖魚類脂肪肝的防治和功能性飼料添加劑的開發提供參考資料。
1 材料與方法
1.1 主要試劑
M199培養基、胎牛血清和無脂肪酸牛血清白蛋白購自Gibco公司, 水飛薊素、油紅O、MTT和油酸均購自Sigma公司, 二甲亞砜(Dimethyl sulfoxide, DMSO)、碳酸氫鈉、無水乙醇等化學試劑均為國產分析純。Trizol、反轉錄試劑盒及熒光定量試劑盒購自TaKaRa公司。
1.2 草魚肝細胞的培養
草魚肝細胞(L8824)購自中國典型培養物保藏中心(China Center for Type Culture Collection,CCTCC)。將肝細胞置于10%胎牛血清的M199培養液中, 并于28℃、5% CO2飽和濕度培養箱中培養。隔天換液, 待細胞生長至匯合后, 用于試驗。
1.3 油酸溶液和水飛薊素溶液的配制
油酸用無水乙醇配制成100 mmol/L貯存液, 保存于–20℃, 使用前用2%無脂肪酸牛血清白蛋白的M199培養基將油酸稀釋成10 mmol/L儲備液。之后用10%胎牛血清的M199培養液配置成400 μmol/L油酸溶液待用。
水飛薊素用DMSO溶液配制成10 mg/mL貯存液, 保存于–20℃, 使用前用10%胎牛血清的M199培養液配制成不同質量濃度(5、25、50、75、100、125、150和200 μg/mL, 簡寫為SM5、25、50、75、100、125、150和200)的水飛薊素工作液待用。
1.4 試驗處理
根據本實驗室前期研究成果, 選用400 μmol/L油酸處理草魚肝細胞, 作為誘導肝細胞脂肪化的濃度[32]。
試驗組別設為對照組、油酸組和水飛薊素處理組。其中: 對照組為不經任何處理的, 用10%胎牛血清的M199培養液培養肝細胞24h, 為正常肝細胞組(Control); 油酸組(OA組)為用含400 μmol/L油酸的培養液培養肝細胞24h; 水飛薊素處理組(SM組)為用含有400 μmol/L油酸并同時添加不同質量濃度的水飛薊素的培養液培養肝細胞24h。
1.5 MTT法評估水飛薊素對肝細胞活力的影響
采用MTT法, 分別評估了不同質量濃度水飛薊素對未加油酸和同時添加油酸的草魚肝細胞活力的影響。具體操作如下:
(1) 將草魚肝細胞均勻接種于96孔板(150 μL/孔), 28℃, 5% CO2培養24h。之后, 更換為含有不同質量濃度(5、25、50、100和200 μg/mL)水飛薊素的培養液培養肝細胞24h, 然后MTT法評估水飛薊素對未加油酸的肝細胞活力的影響。
(2) 將草魚肝細胞均勻接種于96孔板(150 μL/孔), 28℃, 5% CO2培養24h。之后, 更換為含有油酸和不同質量濃度(75、100、125 μg/mL)水飛薊素的培養液培養肝細胞24h, 然后MTT法評估水飛薊素對添加油酸的肝細胞活力的影響。
MTT法操作步驟為: 細胞經上述處理后, 向每孔加入20 μL的MTT溶液(5 mg/mL), 在28℃、5%CO2條件下繼續培養4h, 吸棄培養液, 用PBS洗1次,吸棄, 每孔加入150 μL DMSO, 于28 ℃孵育10 min,溶解細胞中的甲臢。用Gen5 酶標儀于490 nm波長處測定吸光值, 每組6個重復。
1.6 油紅O染色提取法及試劑盒法測定細胞甘油三酯含量
將草魚肝細胞均勻接種于96孔板, 根據1.4方式處理肝細胞后, 吸棄培養基, 每孔用PBS洗2次, 加入10%的甲醛溶液固定30min, PBS洗2次, 加入新鮮配制的油紅O染液浸染15min, 之后用PBS清洗2次,于倒置顯微鏡下觀察細胞內脂滴的染色情況, 拍照記錄。之后每孔加入150 μL的異丙醇萃取脂質, 用Gen5 酶標儀于490 nm波長處測定吸光值。每組6個重復。
此外, 用甘油三酯試劑盒定量測定細胞內甘油三酯含量(北京普利萊基因技術有限公司), 進一步確定水飛薊素抑制脂質積累的質量濃度。
1.7 抗氧化指標的檢測
將草魚肝細胞均勻接種于24孔板, 按照1.4方式處理肝細胞后, 吸棄培養基, 胰蛋白酶消化細胞, 待細胞接近圓球形時, 立即加入含10%胎牛血清的M199培養液終止消化, 用移液器反復輕輕吹打, 收集細胞懸液, 1000 r/min離心5min, 棄上清液, 加PBS吹打均勻, 1000 r/min離心5min, 棄上清液, 收集細胞待用, 用于抗氧化指標測定。
抗氧化指標包括超氧化物歧化酶(Superoxide dismutase, SOD)和還原型谷胱甘肽(Reduced glutathione, GSH), 均采用試劑盒進行測定(南京建成生物工程研究所)。細胞蛋白含量用Bradford蛋白濃度測定試劑盒測定蛋白含量(碧云天生物技術有限公司)。
1.8 實時定量PCR檢測脂質代謝相關基因mRNA的表達
將草魚肝細胞均勻接種于24孔板, 按照1.4方式處理肝細胞后, 吸棄培養基, PBS清洗2次, 提取總RNA, 并反轉錄。采用CFX-96實時定量PCR儀(Bio-Rad, USA)測定相關基因的mRNA表達量。20 μL反應體系, 包括: 上下游引物(10 mmol/μL)各0.6 μL、cDNA 1 μL、2×SYBR Premix ExTaqTMII 10 μL、滅菌雙蒸水加至20 μL。反應條件是: 95℃,10s; 95℃, 15s; 57℃, 15s; 40個循環。實時定量檢測基因β-actin、FAS、ACC、SCD1、ATGL、HSL、CPT1的引物序列見表1。在反應結束后, 利用溶解曲線對產物的唯一性進行分析。β-actin作為內參,相對定量法比較Ct值(2–ΔΔCt), 計算基因表達量, 并作圖分析, 每組3個重復。
1.9 統計分析
所有數據均以平均值±標準誤(Mean±SE)表示。采用SPSS18.0軟件中的單因素方差分析(Oneway ANOVA)以及Duncan氏多重比較,t-檢驗對數據進行統計學分析。顯著水平為P<0.05, 極顯著水平為P<0.01。

表1 實時定量PCR引物序列Tab. 1 Primers used in real-time quantitative PCR
2 結果
2.1 水飛薊素對草魚肝細胞活力的影響
首先評估了水飛薊素對未加油酸的草魚肝細胞活力影響(圖1), 結果顯示, 與對照組比較, 水飛薊素質量濃度在25—100 μg/mL時顯著增加了細胞活力(P<0.05), 而在5和200 μg/mL時均與對照組無顯著差異(P>0.05)。
進一步評估了水飛薊素和油酸共同處理草魚肝細胞24h后, 對肝細胞活力的影響(圖2), 結果顯示, 與對照組比較, 油酸組(OA組)顯著提高了肝細胞活力(P<0.05)。與油酸組(OA組)比較, SM75、SM100組均顯著提高了細胞活力(P<0.05), 而SM125組無顯著影響(P>0.05)。這表明水飛薊素質量濃度在75—125 μg/mL并同時添加400 μmol/L油酸對草魚肝細胞活力無抑制作用。
2.2 水飛薊素對草魚肝細胞脂質蓄積的抑制作用
采用不同質量濃度的水飛薊素和油酸處理草魚肝細胞24h后, 通過油紅O染色對細胞形態進行了觀察(圖3A), 隨著水飛薊素質量濃度的增加, 草魚肝細胞內紅色脂滴含量呈現出減少的趨勢, 且脂滴變小, 顏色變淺。同時, 用油紅O染色提取比色法定量分析細胞內脂質含量(圖3B), 結果顯示, 與對照組比較, 油酸組(OA組)的脂質含量顯著增加(P<0.05)。與油酸組(OA組)比較, SM5組的脂質含量顯著增加(P<0.05), 之后隨著水飛薊素質量濃度的增加, 肝細胞內的脂質含量逐漸降低, 且水飛薊素質量濃度在100—150 μg/mL時的脂質含量顯著降低(P<0.05)。
進一步用甘油三酯試劑盒定量檢測肝細胞甘油三酯含量(圖4), 結果顯示水飛薊素100 μg/mL處理肝細胞24h后, 肝細胞內甘油三酯含量顯著低于油酸組(OA組), 但高于對照組(P<0.05); 油酸組(OA組)肝細胞內甘油三酯含量則顯著高于對照組(P<0.05)。
2.3 水飛薊素對草魚肝細胞脂質蓄積抑制作用的時間依賴關系
研究了水飛薊素對草魚肝細胞脂質蓄積抑制作用的時間依賴關系(圖5)。選擇質量濃度為100 μg/mL的水飛薊素處理肝細胞, 油紅O染色提取比色法定量分析細胞脂質含量(圖5B)。結果顯示, 與油酸組(OA組)相比, 隨著水飛薊素處理時間的延長, 在12h時肝細胞脂質含量出現顯著降低(P<0.05), 在18h和24h時肝細胞內脂質含量均極顯著降低(P<0.01)。油紅O染色后光學顯微鏡觀察細胞形態(圖5A), 隨著水飛薊素處理時間的延長, 在同一時間點肝細胞內的紅色脂滴少且顏色淺于油酸組。
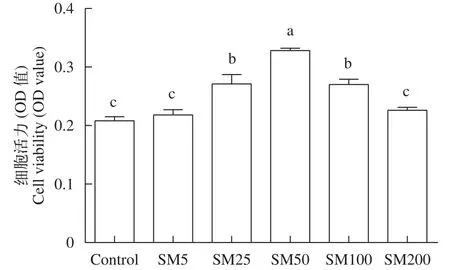
圖1 水飛薊素對草魚肝細胞活力的影響(平均值±標準誤, n=6)Fig. 1 Effect of silymarin on the viability of grass carp hepatocytes (mean±SE, n=6)
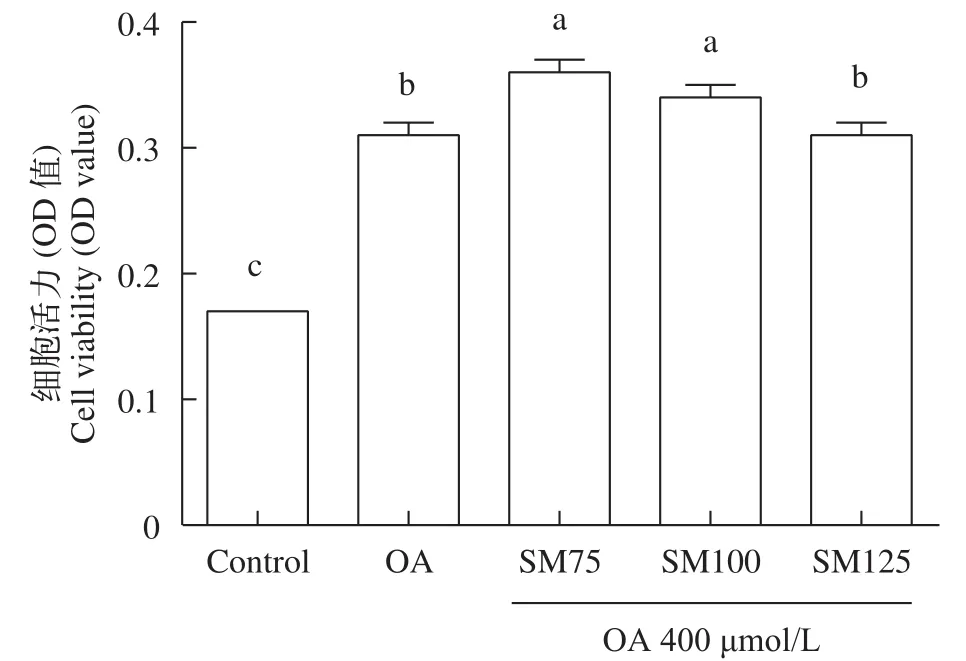
圖2 水飛薊素和油酸共同處理24h對草魚肝細胞活力的影響(平均值±標準誤, n=6)Fig. 2 Effect of silymarin and oleic acid on the viability of grass carp hepatocytes (means±SE, n=6)
2.4 水飛薊素對草魚肝細胞抗氧化能力的影響
結果表明(圖6), SM100組的GSH含量顯著高于油酸組(OA組)(P<0.05), 但與對照組無差異(P>0.05); 油酸組(OA組)的GSH含量低于對照組, 但無統計學差異(P>0.05)(圖6B)。SOD活性在對照組、油酸組(OA組)和SM100組間均無顯著差異(P>0.05)(圖6A)。
2.5 水飛薊素對草魚肝細胞脂質代謝相關基因表達的影響
與對照組相比(圖7), 油酸組(OA組)SCD1的mRNA表達量顯著上調, 而ATGL、HSL和CPT1的mRNA表達量則顯著下調(P<0.05); 油酸組(OA組)FAS的mRNA表達量呈增加趨勢, 但與對照組間無統計學差異(P>0.05)。與油酸組(OA組)比較,SM100組的FAS和SCD1的mRNA表達量均顯著下調(P<0.05)。SM100組的ACC、ATGL、HSL、CPT1的mRNA表達量與油酸組相比呈降低趨勢, 但均無顯著差異(P>0.05)。
3 討論
3.1 水飛薊素對肝細胞活力的影響
在哺乳動物上, 體外建立脂肪肝細胞模型, 進行外源性活性功能成分篩選, 是一種常用研究手段,而在魚類上的相關研究報道較少。Okamoto等[26]用0.1和1 mmol/L油酸培養HepG2 24h, 成功造成肝細胞脂肪變性。Ricchi等[27]用0.66和1.32 mmol/L油酸成功誘導3種肝細胞系(HepG2, WRL-68和HuH-7細胞)脂肪變性。本研究室用油酸成功誘導了草魚肝細胞脂質蓄積, 即油酸濃度在400 μmol/L培養24h時能夠促進草魚肝細胞脂質蓄積且有利于增強細胞活力[32]。因此, 本研究選用400 μmol/L油酸用于誘導草魚肝細胞脂質蓄積。MTT和油紅O染色法提取脂質結果顯示油酸組的細胞活力和脂質含量均顯著高于對照組, 表明400 μmol/L油酸能夠增加草魚肝細胞的活力并誘導脂質蓄積, 進一步證實了上述研究結果。有研究報道指出, 水飛薊素(30 μmol/L)和水飛薊賓(100 μmol/L)對原代培養的大鼠肝細胞產生損傷作用[33]。Venkataramanan等[34]報道0.25 mmol/L (48h)水飛薊素對原代培養的人肝細胞活力無抑制作用, 而水飛薊素在0.5 mmol/L (48h)時對細胞活力產生抑制作用。Zhang等[35]用水飛薊素(100 μmol/L)和棕櫚酸(200 μmol/L)共同處理HepG2和BRL-3A細胞, 發現添加水飛薊素后能夠降低棕櫚酸對細胞的毒性作用。在本研究中, 水飛薊素處理未加油酸的肝細胞結果表明, 水飛薊素質量濃度在5—200 μg/mL時對細胞活力無抑制作用,且25—100 μg/mL時能夠增強細胞活力。進一步分析水飛薊素和油酸共同處理草魚肝細胞結果, 發現水飛薊素質量濃度在75—125 μg/mL并同時添加400 μmol/L油酸對肝細胞活力無抑制作用。
3.2 水飛薊素對肝細胞脂質蓄積的抑制作用及其調控機制

圖3 油紅O染色法評估水飛薊素對草魚肝細胞脂質蓄積的影響(平均值±標準誤, n=6)Fig. 3 Effects of silymarin on intracellular lipid accumulation in grass carp hepatocytes (mean±SE, n=6)
水飛薊素是一種黃酮類植物提取物, 具有保護肝臟和緩解胰島素耐受, 影響糖脂代謝的作用[36—38]。在大鼠上發現, 水飛薊素降低了高脂血癥或CCl4誘導增加的大鼠血液總脂質, 甘油三酯和膽固醇含量[25,39]。Zhang等[35]用水飛薊素與棕櫚酸共同處理BRL-3A和HepG2細胞, 發現水飛薊素抑制了細胞脂質蓄積。在本實驗中, 水飛薊素顯著降低了油酸誘導草魚肝細胞中甘油三酯的蓄積, 這與我們先前在體研究中發現的水飛薊素能夠降低高脂日糧誘導增加的草魚肝脂含量結果一致[20], 表明水飛薊素對草魚肝細胞脂質蓄積具有抑制作用, 有利于保護肝臟。此外, 時間依賴關系結果表明, 隨著水飛薊素處理肝細胞時間的延長, 抑制脂質蓄積的效果顯著。
本研究進一步分析了水飛薊素對肝細胞脂質蓄積抑制的調控機制。乙酰輔酶A羧化酶(Acetyl-CoA carboxylase, ACC)和脂肪酸合酶(Fatty acid synthase, FAS)是調節脂質合成的關鍵限速酶[40,41],硬脂酰輔酶A去飽和酶1(Stearoyl-CoA desaturases 1, SCD1)是軟脂酸去飽和合成單不飽和脂肪酸的調控酶[42]。甘油三酯脂酶(Adipose triglyceride lipase, ATGL)和激素敏感酶(Hormone-sensitive lipase, HSL)是調控甘油三酯水解的關鍵酶[43]。肉毒堿棕櫚酰轉移酶(Carnitine palmitoyltransferase 1,CPT1)是影響線粒體脂肪酸β-氧化的限速酶[44]。在本研究中, 與對照組相比, 油酸組脂質分解相關基因(ATGL、HSL、CPT1)的mRNA表達量顯著下調,而脂質合成基因SCD1的mRNA表達量顯著上調,同時FAS的mRNA表達量呈增加趨勢, 表明油酸能夠抑制肝細胞中脂質分解, 促進脂質合成, 這可能是導致肝細胞脂質增加的主要原因[28]。黃酮可降低非酒精性脂肪肝大鼠的肝臟脂質蓄積, 其抑制作用與抑制脂質合成有關[45]。在體研究指出, 水飛薊素可降低高果糖日糧飼喂大鼠的FAS基因表達量[37]。在本研究中, 與油酸組比較, 水飛薊素處理組的FAS和SCD1基因表達量顯著下調, 表明水飛薊素可能通過下調肝細胞內脂質合成來抑制脂質蓄積, 這可能是導致肝細胞內甘油三酯含量降低, 改善油酸誘導肝細胞脂肪蓄積的主要原因。
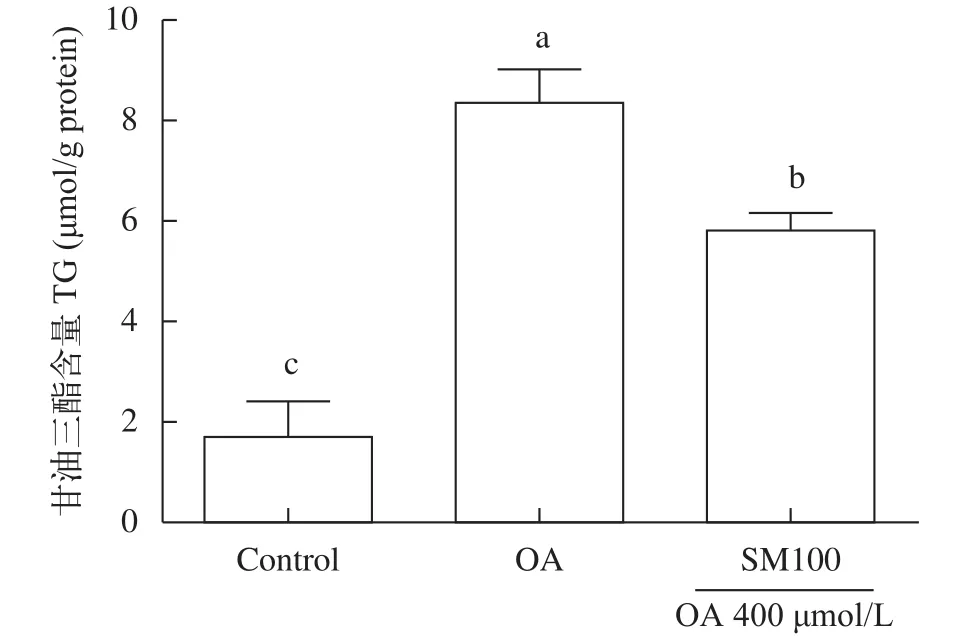
圖4 水飛薊素對草魚肝細胞甘油三酯含量的影響(平均值±標準誤, n=3)Fig. 4 Effect of silymarin on triacylglycerol (TG) contents in grass carp hepatocytes (mean±SE, n=3)
3.3 水飛薊素對肝細胞抗氧化能力的影響

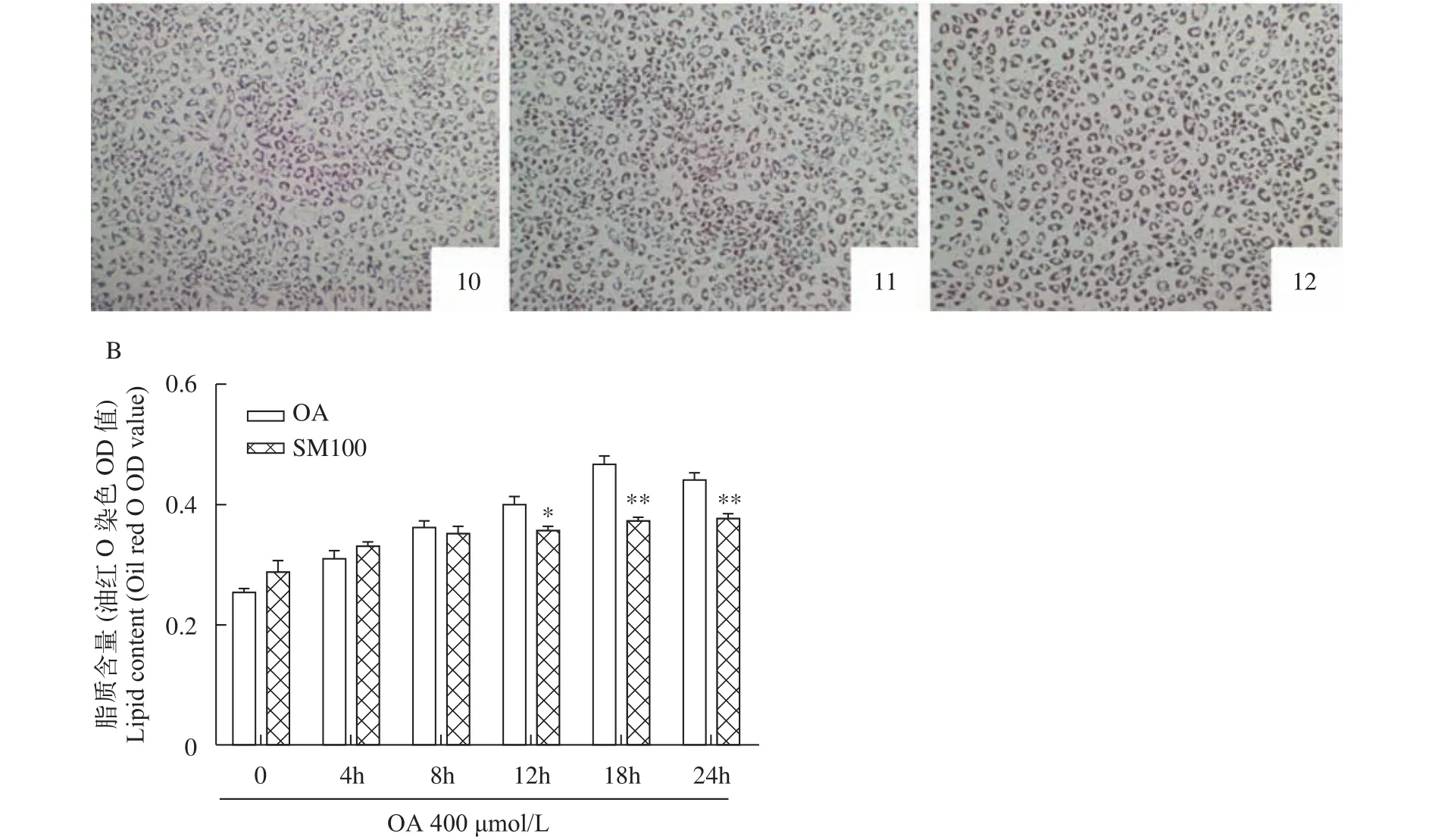
圖5 水飛薊素對草魚肝細胞脂質蓄積的時間依賴關系(平均值±標準誤, n=6)Fig. 5 Effect of silymarin on lipid accumulation in grass carp hepatocytes for 0, 4h, 8h, 12h, 18h or 24h (mean±SE, n=6)
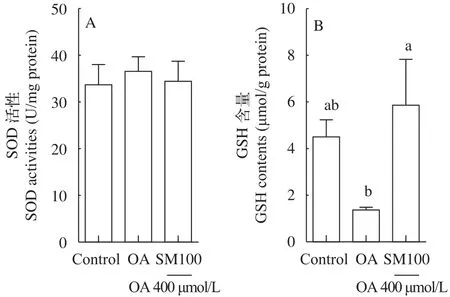
圖6 水飛薊素對草魚肝細胞抗氧化能力的影響(平均值±標準誤, n=3)Fig. 6 Effect of silymarin on antioxidant capabilities in grass carp hepatocytes (mean±SE, n=3)
肝細胞對甘油三酯的儲存能力有限。當過量游離脂肪酸蓄積在肝細胞內, 導致產生過量的活性氧(Reactive oxygen species, ROS), 引起氧化應激發生, 造成脂毒性, 導致細胞損傷或死亡[46,47], 并使得營養性脂肪肝進一步向肝纖維化和肝壞死轉變[9]。ROS是不穩定的活性分子, 依賴于細胞內抗氧化系統的清除作用。SOD屬于抗氧化酶, 可清除游離的自由基進而保護細胞的抗脂質過氧化反應[48];GSH用于維持細胞內氧化還原狀態的平衡, 作為谷胱甘肽過氧化物酶和谷胱甘肽轉移酶的底物, 對清除自由基起了關鍵作用[49]。水飛薊素具有抗氧化、抗炎、抗癌等作用[16,17]。已有研究發現, 水飛薊素處理棕櫚酸誘導的HepG2細胞后, 不僅提高了細胞中GSH含量, 而且改善了棕櫚酸誘導的AKT酶活性的降低, 并緩解了細胞死亡[50]。在體研究中, 水飛薊賓不僅能夠調節脂質平衡, 而且可顯著降低酒精性脂肪肝炎大鼠ROS含量, 抑制氧化應激介導的脂毒性作用, 最終阻止了肝臟損傷的發展[38]。在本研究中, 水飛薊素處理肝細胞后, GSH含量增加, 表明水飛薊素能夠促進肝細胞的抗氧化能力的提高, 這將有助于抵抗細胞內ROS的產生, 保護肝細胞[17]。然而, 有關水飛薊素對肝細胞氧化應激和脂質蓄積影響的內在作用機制有待進一步研究。
4 結論
本研究發現, 水飛薊素能夠抑制油酸誘導的草魚肝細胞脂質蓄積, 改善肝細胞的脂肪變性狀況,其作用機制可能與其抑制脂質合成基因的表達有關; 同時水飛薊素能夠提高肝細胞的抗氧化能力,表明水飛薊素或可作為一種具有開發潛力的魚用降脂及抗氧化因子。另外, 研究認為, 結合在體飼養試驗, 通過建立細胞離體培養模型進行微量成分作用機制研究和功能性添加劑的篩選, 可作為開展水產動物營養學研究和飼料開發的有效方法。
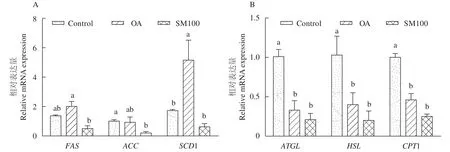
圖7 RT-PCR測定水飛薊素對草魚肝細胞脂質代謝相關基因的影響(平均值±標準誤, n=3)Fig. 7 Effects of silymarin on the relative expression of the lipid metabolism related genes in grass carp hepatocytes (mean±SE, n=3)
[1]Tocher D R. Metabolism and functions of lipids and fatty acids in teleost fish [J].Reviews in Fisheries Science,2003, 11(2): 107—184
[2]Tang J, Wang A L, Miao Y T,et al. Protein-sparing effects andLPLgene expressions of dietary lipids in the juvenile soft-shelled turtle,Pelodiscussinensis[J].Aquaculture Research, 2016, 47(2): 579—590
[3]Hung L T, Binh, V T T, Truc N T T,et al. Effects of dietary protein and lipid levels on growth, feed utilization and body composition in red-tailed catfish juveniles(Hemibagrus wyckioides, Chaux amp; Fang 1949) [J].Aquaculture Nutrition, 2017, 23(2): 367—374
[4]Du Z Y, Liu Y J, Tian L X,et al. Effect of dietary lipid level on growth, feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella) [J].Aquaculture Nutrition, 2005, 11(2): 139—146
[5]Guo X, Liang X, Fang L,et al. Effects of dietary non-protein energy source levels on growth performance, body composition and lipid metabolism in herbivorous grass carp (Ctenopharyngodon idella Val.) [J].Aquaculture Research, 2013, 46(5): 1197—1208
[6]Jin Y, Tian L, Zeng S,et al. Dietary lipid requirement on non-specific immune responses in juvenile grass carp(Ctenopharyngodon idella) [J].Fish amp; Shellfish Immuno-logy, 2013, 34(5): 1202—1208
[7]Lu K L, Xu W N, Li J Y,et al. Alterations of liver histology and blood biochemistry in blunt snout breamMegalobrama amblycephalafed high-fat diets [J].Fisheries Science, 2013a, 79(4): 661—671
[8]Zhao P F, Li F J, Chen X R,et al. Dietary lipid concentrations influence growth, liver oxidative stress, and serum metabolites of juvenile hybrid snakehead (Channa argus×Channa maculata) [J].Aquaculture International, 2016,24(5): 1—12
[9]Du Z Y. Causes of fatty liver in farmed fish: a review and new perspectives [J].Journal of Fisheries of China, 2014,38(9): 1628—1638 [杜震宇. 養殖魚類脂肪肝成因及相關思考. 水產學報, 2014, 38(9): 1628—1638]
[10]Lu K L, Xu W N, Li X F,et al. Hepatic triacylglycerol secretion, lipid transport and tissue lipid uptake in blunt snout bream (Megalobrama amblycephala) fed high-fat diet [J].Aquaculture, 2013b, 408—409(9): 160—168
[11]Nanton D A, Lall S P, Ross N W,et al. Effect of dietary lipid level on fatty acid β-oxidation and lipid composition in various tissues of haddock,Melanogrammus aeglefinusL [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2003,135(1): 95—108
[12]Colturato C P, Constantin R P, Maeda A S,et al. Metabolic effects of silibinin in the rat liver [J].Chemico-biological Interactions, 2012, 195(2): 119—132
[13]Lee D Y W, Liu Y. Molecular Structure and Stereochemistry of Silybin A, Silybin B, Isosilybin A, and Isosilybin B, Isolated fromSilybum marianum(Milk Thistle) [J].Journal of Natural Products, 2003, 66(9): 1171—1174
[14]Ludovico A, Gabriella A, Raffaele C,et al. Milk thistle for treatment of nonalcoholic fatty liver disease [J].Hepatitis Monthly, 2011, 11(3): 173—177
[15]Shaker E, Mahmoud H, Mnaa S. Silymarin, the antioxi-dant component andSilybum marianumextracts prevent liver damage [J].Food and Chemical Toxicology, 2010,48(3): 803—806
[16]Surai P F. Silymarin as a natural antioxidant: An overview of the current evidence and perspectives [J].Antioxidants, 2015, 4(1): 204—247
[17]Jia R, Cao L, Du J,et al. The protective effect of silymarin on the carbon tetrachloride (CCl4)-induced liver injury in common carp (Cyprinus carpio) [J].In Vitro Cellular amp; Developmental Biology-Animal, 2013, 49(3):155—161
[18]Banaee M, Sureda A, Mirvaghefi A R,et al. Effects of long-term silymarin oral supplementation on the blood biochemical profile of rainbow trout (Oncorhynchus mykiss) [J].Fish Physiology and Biochemistry, 2011,37(4): 885—896
[19]Suh H J, Cho S Y, Kim E Y,et al. Blockade of lipid accumulation by silibinin in adipocytes and zebrafish [J].Chemico-Biological Interactions, 2015, 227: 53—62
[20]Xiao P Z, Ji H, Ye Y T,et al. Dietary silymarin supplementation promotes growth performance and improves lipid metabolism and health status in grass carp (Ctenopharyngodon idellus) fed diets with elevated lipid levels[J].Fish Physiology and Biochemistry, 2017, 43(1):245—263
[21]Du Z Y, Clouet P, Zheng W H,et al. Biochemical hepatic alterations and body lipid composition in the herbivorous grass carp (Ctenopharyngodon idella) fed high-fat diets [J].British Journal of Nutrition, 2006, 95(5):905—915
[22]Savary S, Trompier D, Andréoletti P,et al. Fatty acids -induced lipotoxicity and inflammation [J].Current Drug Metabolism, 2012, 13(10): 1358—1370
[23]Chou C, Chen Y, Hsu M,et al. Effect of silymarin on lipid and alcohol metabolism in mice following long-term alcohol consumption [J].Journal of Food Biochemistry, 2012,36(3): 369—377
[24]El-Sheikh N M, El-Fattah H M A. Counteracting methionine choline-deficient diet-induced fatty liver by administration of turmeric and silymarin [J].Journal of Applied Sciences Research, 2011, 7(12): 1812—1820
[25]Metwally M A A, Elgellal A M, Elsawaisi S M. Effects of silymarin on lipid metabolism in rats [J].World Applied Sciences Journal, 2009, 6(12): 1634—1637
[26]Okamoto Y, Tanaka S, Haga Y. Enhanced GLUT2 gene expression in an oleic acid-induced in vitro fatty liver model [J].Hepatology Research, 2002, 23(2): 138—144
[27]Ricchi M, Odoardi M R, Carulli L,et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes [J].Journal of Gastroenterology and Hepatology, 2009, 24(5): 830—840
[28]Ou T T, Man-Jung Hsu, Chan K C,et al. Mulberry extract inhibits oleic acid-induced lipid accumulation via reduction of lipogenesis and promotion of hepatic lipid clearance [J].Journal of the Science of Food and Agriculture, 2011, 91(15): 2740—2748
[29]Wu C H, Lin M C, Wang H C,et al. Rutin inhibits oleic acid induced lipid accumulation via reducing lipogenesis and oxidative stress in hepatocarcinoma cells [J].Journal of Food Science, 2011, 76(2): T65—T72
[30]Kang O H, Kim S B, Seo Y S,et al. Curcumin decreases oleic acid-induced lipid accumulation via AMPK phosphorylation in hepatocarcinoma cells [J].European Review for Medical amp; Pharmacological Sciences, 2013,17(17): 2578—2586
[31]Du J L, Cao L P, WangT,et al. Protective effects of Rhizoma Alismatis extract on hepatocyte steatosis injury induced by Oleic acid in Jian Carp (Cyprinus carpio var.JIAN) [A]. Academic Annual Meeting of China Society of Fisheries [C]. 2015 [杜金梁, 曹麗萍, 王濤, 等. 澤瀉提取物對油酸誘導建鯉脂肪肝細胞損傷的保護作用.中國水產學會學術年會論文摘要集. 2015]
[32]Li X, Sun J, Ji H,et al. Influence of fatty acids on lipid accumulation and apoptosis status of grass carpCtenopharyngodon idellushepatocytein vitro[J].Acta Hydrobiologica Sinica, 2017, 41(1): 56—64 [李雪賢, 孫健, 吉紅, 等. 脂肪酸影響草魚肝細胞脂質蓄積狀態及誘導其凋亡的離體研究. 水生生物學報, 2017, 41(1): 56—64]
[33]Sainz-Pardo L A, Anundi I, Miguez M P,et al. The effects of silymarin on the attachment and viability of primary cultures of rat hepatocytes [J].Toxicology in Vitro, 1994, 8(4): 577—579
[34]Venkataramanan R, Ramachandran V, Komoroski B J,et al. Milk thistle, a herbal supplement, decreases the activity of CYP3A4 and uridine diphosphoglucuronosyl transferase in human hepatocyte cultures [J].Drug Metabolism and Disposition, 2000, 28(11): 1270—1273
[35]Zhang Y, Hai J, Cao M,et al. Silibinin ameliorates steatosis and insulin resistance during non-alcoholic fatty liver disease development partly through targeting IRS-1/PI3K/Akt pathway [J].International Immunopharmacology,2013, 17(3): 714—20
[36]Chen I S, Chen Y C, Chou C H,et al. Hepatoprotection of silymarin against thioacetamide-induced chronic liver fibrosis [J].Journal of the Science of Food and Agriculture, 2012, 92(7): 1441—1447
[37]Prakash P, Singh V, Jain M,et al. Silymarin ameliorates fructose induced insulin resistance syndrome by reducingde novohepatic lipogenesis in the rat [J].European Journal of Ppharmacology, 2014, 727: 15—28
[38]Salamone F, Galvano F, Cappello F,et al. Silibinin modulates lipid homeostasis and inhibits nuclear factor kappa B activation in experimental nonalcoholic steatohepatitis[J].Translational Research, 2012, 159(6): 477—486
[39]Hassan H A, El-Gendy A M. Evaluation of silymarin and/or ginger effect on induced hepatotoxicity by carbon tetrachloride in male albino rats [J].Egyptian Journal of Hospital Medicine, 2003, 12: 101—112
[40]Davis M S, Solbiati J, Cronan J E. Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis inEscherichia coli[J].Journal of Biological Chemistry, 2000, 275(37): 28593—28598
[41]Jensen-Urstad A P L, Semenkovich C F. Fatty acid synthase and liver triglyceride metabolism: housekeeper or messenger [J]?Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5):747—753
[42]Ntambi J M, Miyazaki M. Regulation of stearoyl-CoA desaturases and role in metabolism [J].Progress in Lipid Research, 2004, 43(2): 91—104
[43]Schweiger M, Schreiber R, Haemmerle G,et al. Adipose triglyceride lipase and hormone-sensitive lipase are the major enzymes in adipose tissue triacylglycerol catabolism [J].Journal of Biological Chemistry, 2006, 281(52):40236—40241
[44]Kerner J, Hoppel C. Fatty acid import into mitochondria[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2000, 1486(1): 1—17
[45]Zhang S, Zheng L, Dong D,et al. Effects of flavonoids from Rosa laevigata Michx fruit against high-fat diet-induced non-alcoholic fatty liver disease in rats [J].Food Chemistry, 2013, 141(3): 2108—2116
[46]Singal A K, Jampana S C, Weinman S A. Antioxidants as therapeutic agents for liver disease [J].Liver International, 2011, 31(10): 1432—1448
[47]Feldstein A E, Werneburg N W, Canbay A,et al. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-α expression via a lysosomal pathway [J].Hepatology, 2004, 40(1): 185—194
[48]Fridovich I. Superoxide radical and superoxide dismutases [J].Annual Review of Biochemistry, 1995, 64(1):97—112
[49]Masella R, Di Benedetto R, Varì R,et al. Novel mechanisms of natural antioxidant compounds in biological systems: involvement of glutathione and glutathione-related enzymes [J].The Journal of Nutritional Biochemistry,2005, 16(10): 577—586
[50]Song Z, Song M, Lee D Y,et al. Silymarin prevents palmitate-induced lipotoxicity in HepG2 cells: involvement of maintenance of Akt kinase activation [J].Basic and Clinical Pharmacology and Toxicology, 2007,101(4): 262—268
INHIBITORY EFFECT OF SILYMARIN ON OLEIC ACID-INDUCED LIPID ACCUMULATION IN GRASS CARP (CTENOPHARYNGODON IDELLUS)HEPATOCYTES IN VITRO
XIAO Pei-Zhen1, JI Hong1, ZHANG Bao-Tong2, YE Yuan-Tu3, SUN Jian1, YANG Zhou1,LI Xue-Xian1and TIAN Jing-Jing1
(1. College of Animal Science and Technology, Northwest A amp; F University, Yangling 712100, China; 2. Open Lab for Aquatic Animal Nutrition, Beijing Research Institute for Nutritional Resources, Beijing 100069, China; 3. Key Laboratory of Aquatic Nutrition of Jiangsu Province, School of Biology and Basic Medical Sciences, Soochow University, Suzhou 215123, China)
The objective of this study was to explore the mechanism and effect of silymarin on hepatocytes lipid accumulation of grass carp (Ctenopharyngodon idellus) induced by oleic acid (OA). Hepatocytes were treated at 400 μmol/L OA with or without silymarin to observe the cell viability by 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) and the lipid accumulation by Oil Red O stain. We also tested the effects of silymarin on the antioxidant capacities and the expression of lipid metabolism related gene in hepatocytes in grass carp detected by RT-PCR.The results showed that the cell viability was not affected by the treatment of 400 μmol/L OA with 75—125 μg/mL silymarin in presence for 24h (P>0.05). The intracellular lipid content of hepatocytes decreased significantly after the treatment of 400 μmol/L OA with 100—150 μg/mL silymarin for 24h by Oil Red O stain (P<0.05). Compared with the OA group, SM100 group showed time-dependent trend on the decreasing lipid accumulation (P<0.05). Reduced glutathione (GSH) contents were higher in SM100 group than those in the OA group. The expressions of fatty acid synthase(FAS) and stearoyl-CoA desaturases 1 (SCD1) mRNA were significantly downregulated in SM100 group compared with those in the OA group (P<0.05). These results demonstrated silymarin exerted an inhibitory effect on lipid accumulation by decreasing lipogenesis, and enhanced antioxidative ability in grass carp hepatocytes. Silymarin may shed light on the prevention of fatty liver.
Silymarin; Lipid accumulation; Hepatocyte; Grass carp; Oleic acid
S963.7
A
1000-3207(2017)06-1301-10
2017-01-04;
2017-03-17
陜西省水產健康生態養殖技術集成與示范(2014-TS-36)資助 [Supported by the Technical Integration and Demonstration of Aquaculture Health Ecology in Shaanxi Province (2014-TS-36)]
蕭培珍(1980—), 女, 山西忻州人; 博士研究生在讀; 主要研究方向為水生生物研究方法與技術。E-mail: peizhenxiao2012@163.com
吉紅(1967—), 男, 河南靈寶人; 博士, 教授, 博士生導師; 主要研究方向為水產動物營養與飼料。E-mail: jihong@nwsuaf.edu.cn

