四個羅非魚選育品種抗鏈球菌病能力差異研究
祝璟琳 鄒芝英 李大宇 肖 煒 徐 跑 楊 弘 薛良義
(1. 寧波大學海洋學院, 寧波 315211; 2. 中國水產科學研究院淡水漁業研究中心,農業部淡水漁業和種質資源利用重點實驗室, 無錫 214081)
四個羅非魚選育品種抗鏈球菌病能力差異研究
祝璟琳1,2鄒芝英2李大宇2肖 煒2徐 跑2楊 弘2薛良義1
(1. 寧波大學海洋學院, 寧波 315211; 2. 中國水產科學研究院淡水漁業研究中心,農業部淡水漁業和種質資源利用重點實驗室, 無錫 214081)
為篩選出抗病力優良的羅非魚品種, 以奧利亞羅非魚“夏奧1號”、尼羅羅非魚“99”埃及品系、吉富羅非魚“中威1號”和奧尼羅非魚為研究對象, 33℃水溫暫養7d后分別進行無乳鏈球菌人工感染實驗, 連續7d統計累計死亡率, 并于人工感染后0、24h、48h和72h采集血液和組織樣本, 研究這4個羅非魚選育品種抗鏈球菌病能力的差異。結果顯示: 感染7d后奧尼羅非魚的累計死亡率最低; 奧尼羅非魚的谷草轉氨酶(AST)感染前后始終都低于其余3個品種羅非魚(P<0.05); 埃及尼羅和奧尼在感染72h后球蛋白(GLO)分別顯著升高1.13倍和1.41倍;奧尼羅非魚白蛋白/球蛋白(A/G)在感染前后沒有顯著性變化(P>0.05), 而其余3個品種羅非魚A/G比值在感染后都顯著性降低(P<0.05); 埃及尼羅的堿性磷酸酶(AKP)在感染72h后顯著降低(P<0.05), 奧利亞和吉富的AKP表現為先上升后下降, 奧尼的AKP感染前后沒有顯著性變化(P>0.05); 各品種羅非魚血清中的乳酸脫氫酶(LDH)感染后都顯著升高(P<0.05); 奧利亞、吉富和奧尼羅非魚的超氧化歧化酶(SOD)感染48h時都顯著升高(P<0.05); 奧尼羅非魚在感染前后溶菌酶(LZM)活性都顯著高于其余3個品種羅非魚(P<0.05)。組織病理學結果顯示:吉富和奧尼肝細胞水腫變性, 而奧利亞和埃及尼羅出現大面積肝細胞脂肪變性; 每個品種羅非魚均呈現嚴重的脾炎, 奧利亞、埃及尼羅和吉富的脾臟中大量鐵血黃素沉積; 每種羅非魚呈現不同程度的腎小球萎縮, 腎小管上皮細胞變性、壞死。研究表明奧尼羅非魚抗鏈球菌病能力最強, 感染后血清中AST水平與肝受損程度呈一定的正相關, LZM水平和羅非魚抗鏈球菌病能力呈一定的正相關。
品種; 羅非魚; 無乳鏈球菌; 生化指標; 溶菌酶; 抗病力; 組織病理
羅非魚(Oreochromisspp.)自1956年開始引進我國, 現已成為我國第六大養殖魚類, 吉富羅非魚(Oreochromis niloticus♀×Oreochromis niloticus ♂)和奧尼羅非魚(Oreochromis niloticus♀×Oreochromis aureus♂)是目前的主要養殖品種。“中威1號”新品種是吉富羅非魚的代表性品種之一, 是以2006年從世界漁業中心新引進的60個家系吉富羅非魚為原始親本, 采用家系選育和BLUP育種值評價技術通過5代連續選育獲得[1]。奧尼羅非魚通常以尼羅羅非魚♀×奧利亞羅非魚♂通過雜交育種途徑獲得, 其親本尼羅羅非魚(Oreochromis niloticus)和奧利亞羅非魚(Oreochromis aureus)以群體選育為主。
目前魚類的選育指標以生長指標作為主要衡量指標, 而對抗逆性和健康狀況指標相對考慮較少。很多學者認為血液學指標評價對評估野生和養殖魚類的健康狀態至關重要[2—4]。血液學指標因為能提供魚體應激程度, 代謝異常, 生殖機能障礙和疾病的基本信息, 可作為魚體生理和病理變化的較好指示指標[5]。而對病原菌感染后的魚體進行組織病理學研究, 有利于疾病的診斷, 并為研究病原的感染機制提供依據[6]。Chen等[7]研究了羅非魚感染創傷弧菌(Vibrio vulnificus)和海豚鏈球菌(Streptococcus iniae)后的血清生化指標和病理變化之間的關聯, 發現肝臟、腸和腎的病理受損嚴重程度和谷丙轉氨酶(ALT)、谷草轉氨酶(AST)呈正相關, 而和Na+、Cl–、膽固醇和總蛋白呈負相關。徐曉津等[8]對大黃魚(Larimichthys crocea)感染哈維氏弧菌(Vibrio harveyi)后血液生化指標的變化及組織病理學進行研究, 發現血清指標的測定可以作為大黃魚哈維氏弧菌病細菌感染的指標, 病魚的肝、腎等發生了嚴重病變, 肝、腎功能不全。目前羅非魚高密度、高集約化養殖方式導致鏈球菌病頻繁暴發[9],其病原菌2008年前以海豚鏈球菌為主, 2008年后以無乳鏈球菌(Streptococcus agalactiae)為主[10]。國內外研究表明, 羅非魚的生長最適宜溫度是29—31℃,水溫高于32℃時, 羅非魚更容易感染無乳鏈球菌[6,9]。本文以奧尼羅非魚及其親本奧利亞羅非魚和埃及尼羅羅非魚為對象, 并與吉富羅非魚相比較, 研究這4個羅非魚選育品種在水溫33℃時抗鏈球菌能力的差異, 初步篩選出抗病力優良的羅非魚品種, 探索羅非魚抗病機理, 并了解選育途徑對魚類抗病力的影響。
1 材料與方法
1.1 無乳鏈球菌
病原菌保存于本實驗室, 編號LB110808-2, 經16S rDNA分子鑒定為無乳鏈球菌(GenBank登錄號:JQ990153)。
1.2 實驗用魚
奧利亞羅非魚、埃及尼羅羅非魚、吉富羅非魚和奧尼羅非魚均來自農業部羅非魚遺傳育種中心, 奧利亞羅非魚為“夏奧1號”新品種(登記號: GS-01-002-2006), 魚體質量為(60.71±5.63) g; 尼羅羅非魚為1999年引自埃及農業部和農墾部水產研究中心實驗室的埃及品系, 魚體質量為(59.65±4.59) g;奧尼羅非魚(登記號: GS-02-001-1996)為埃及尼羅♀ד夏奧1號”奧利亞羅非魚♂的雜交子一代, 魚體質量為(63.65±4.84) g; 吉富羅非魚為“中威1號”新品種(登記號: GS-01-003-2014), 魚體質量為(65.38±5.27) g。人工感染實驗前在實驗室分別于(33±1)℃水溫下暫養7d, 養殖桶體積為360 L, 每天投喂2次。
1.3 人工感染實驗
將經鑒定的無乳鏈球菌原種從冰箱中取出, 復壯后接種于腦心浸液液體培養基(BHI)中, 28℃200 r/min擴大培養24h后, 4000 r /min離心 5min, 用無菌的8.5 g/L NaCl溶液洗滌后配成1.5×109CFU/mL的菌懸液原液。開展人工感染實驗Ⅰ研究4個羅非魚選育品種對無乳鏈球菌的抗病力差異, 同時開展人工感染實驗Ⅱ研究低濃度腹腔注射無乳鏈球菌后對4個羅非魚選育品種的血清生化指標和組織病理的影響。
人工感染實驗Ⅰ: 將菌懸液原液用8.5 g/L無菌NaCl溶液稀釋成1.5×108CFU/mL的菌液, 每個品種設置3個養殖桶, 每桶10尾, 每尾魚腹腔注射0.3 mL菌液。對照組注射等量的8.5 g/L NaCl溶液。攻毒后連續7d觀察記錄死亡尾數, 并及時撈出死魚。
人工感染實驗Ⅱ: 將菌懸液原液用8.5 g/L無菌NaCl溶液稀釋成1.5×107CFU/mL的菌液, 每個品種設置3個養殖桶, 每桶20尾, 每尾魚腹腔注射0.3 mL菌液, 同時設置相應的對照組注射等量的8.5 g/L NaCl溶液。
實驗期間溶解氧保持在5 mg/L以上, 水溫(33±1)℃, 實驗期間不投喂。人工感染3d后每個羅非魚選育品種隨機取瀕死的羅非魚解剖, 無菌操作取腦和腎臟組織在血平板上分離、純化病原菌, 并用梅里埃API 20 Strep試劑條進行快速鑒定。
1.4 采樣與處理
在人工感染實驗Ⅱ中, 魚感染0、24h、48h和72h分別從每個養殖桶中取2尾魚, 每個時間點每個羅非魚選育品種共6尾魚用MS-222(200 mg/L)快速麻醉, 進行尾靜脈取血, 室溫靜置2h后4000 r/min離心10min分離血清, 保存于–20℃冰箱中。同時取感染72h后4個羅非魚選育品種的肝臟、脾臟和腎臟用波恩氏液固定后進行組織病理學觀察。
1.5 血清生化指標測定
每個品種的血清在日立7600全自動生化分析儀上檢測下列指標: 谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、白蛋白(ALB)、球蛋白(GLO)和乳酸脫氫酶(LDH)試劑盒購自日本和光純藥工業株式會社, 堿性磷酸酶(AKP, 試劑盒購自四川邁克生物科技股份有限公司, 超氧化歧化酶(SOD)試劑盒購自寧波美康生物科技有限公司。溶菌酶(LZM)試劑盒購自南京建成生物工程研究所, 具體操作按照使用說明進行。
1.6 組織病理學觀察
[11]的方法, 將組織從固定液里取出,用70%酒精洗滌至無色; 組織依次進行梯度脫水;二甲苯透明; 石蠟包埋; KD2258型切片機連續切片,厚度為4—7 μm; 脫蠟和水化; 蘇木精-伊紅(HE)染色后將切片放入梯度酒精里脫水和透明; 中性樹膠封片后用尼康80i顯微鏡觀察并拍照保存。
1.7 數據分析
數據利用Excel 2007軟件進行初步處理, 再用SPSS 18.0軟件進行單因素方差(One-Way ANOVA)分析, Duncan’s法多重比較檢驗差異性, 用Origin 8.0軟件作圖,P<0.05表明差異顯著。實驗數據以平均值±標準差(Mean±SD)表示。
2 結果
2.1 四個羅非魚選育品種抗鏈球菌病能力差異比較
在人工感染后, 4個品種的瀕死羅非魚都表現出全身發黑, 游姿失衡等鏈球菌病的典型癥狀, 在感染3d后一些瀕死羅非魚顯示角膜混濁, 突眼等現象, 解剖魚體后發現肝臟充血、脾臟充血腫大等,無菌操作分離的細菌經API 20 Strep鑒定為無乳鏈球菌。人工感染實驗Ⅰ中, 對照組均沒有發現羅非魚死亡, 而試驗組感染3d后奧尼羅非魚的累計死亡率(40%)和奧利亞羅非魚(50%)差異不顯著(P>0.05), 但顯著低于吉富羅非魚(76.67%)和埃及尼羅羅非魚(96.67%)(P<0.05)。感染4d后奧利亞羅非魚累計死亡率為73.33%, 顯著高于奧尼羅非魚(46.67%)(P<0.05)。感染7d后奧尼羅非魚的累計死亡率(53.33%)顯著低于吉富羅非魚(86.67%)、奧利亞羅非魚(90%)和埃及尼羅羅非魚(96.67%)(P<0.05), 而奧利亞羅非魚、埃及尼羅羅非魚和吉富羅非魚之間的累計死亡率差異不顯著(P>0.05)(圖1)。
2.2 四個羅非魚選育品種感染無乳鏈球菌后血清谷丙轉氨酶和谷草轉氨酶活力的變化
由表1可知, 埃及尼羅羅非魚和奧尼羅非魚的血清谷丙轉氨酶(ALT)感染前后沒有顯著性變化(P>0.05), 而奧利亞羅非魚表現為先上升后下降, 吉富羅非魚卻一直保持上升趨勢, 但埃及尼羅羅非魚的ALT在感染前就顯著高于其余3個品種(P<0.05),感染72h后奧利亞羅非魚和奧尼羅非魚的ALT活力顯著低于埃及尼羅和吉富羅非魚(P<0.05)。奧利亞和吉富羅非魚在感染24h時AST就顯著升高(P<0.05), 而埃及尼羅和奧尼羅非魚的AST在感染48h后才顯著升高(P<0.05), 但埃及尼羅羅非魚的AST在感染前就顯著高于其余3個品種的羅非魚(P<0.05), 而奧尼羅非魚的AST活力在感染前后每個時間點都比其余3個品種羅非魚要低(P<0.05)。
2.3 四個羅非魚選育品種感染無乳鏈球菌后血清球蛋白和白蛋白/球蛋白的變化
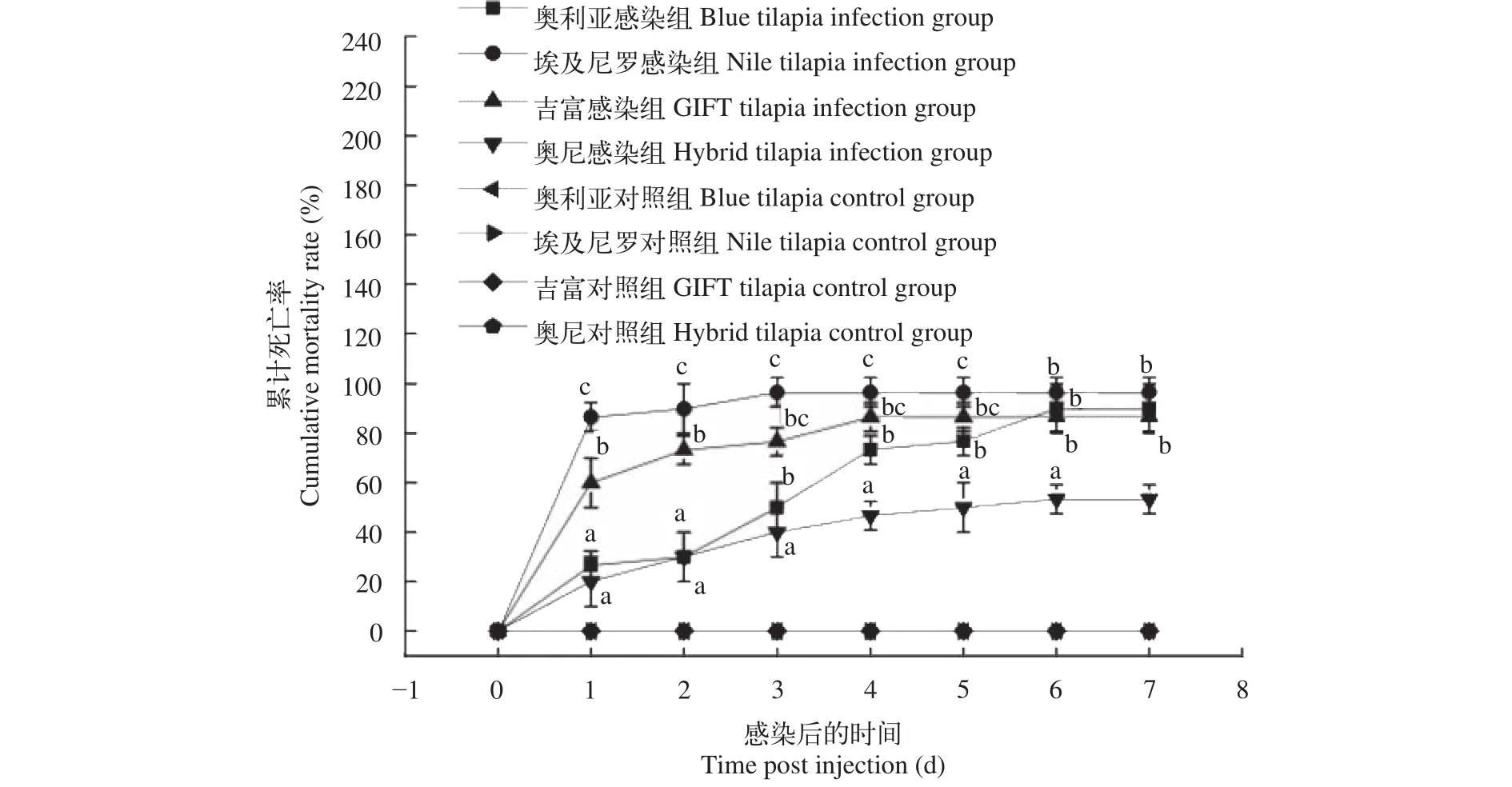
圖1 四個羅非魚選育品種感染無乳鏈球菌后的累計死亡率Fig. 1 The cumulative mortality of four Oreochromis spp. bleeding species infected by S. agalactiae

表1 四個羅非魚選育品種感染無乳鏈球菌后血清的谷丙轉氨酶和谷草轉氨酶的變化Tab. 1 The comparison on serum glutamic-pyruvic transaminase and glutamic-oxaloacetic transamnase activities of four Oreochromis spp.bleeding species infected by S. agalactiae (n=6; x±SD)

表2 四個羅非魚選育品種感染無乳鏈球菌后血清的球蛋白和白蛋白/球蛋白的變化Tab. 2 The comparison on serum globulin and albumin/globulin activities of four Oreochromis spp. bleeding species infected by S.agalactiae (n=6; x±SD)
由表2可知, 埃及尼羅羅非魚和奧尼羅非魚在感染72h后血清GLO水平分別顯著升高1.13倍和1.41倍(P<0.05), 但感染前奧尼羅非魚GLO水平顯著低于埃及尼羅羅非魚(P<0.05), 而奧利亞羅非魚和吉富羅非魚GLO水平在感染前后沒有顯著性差異(P>0.05), 感染72h后各品種之間GLO水平沒有顯著性差異(P>0.05); 奧尼羅非魚A/G在感染前后沒有顯著性變化(P>0.05), 而奧利亞羅非魚在感染48h后顯著降低(P<0.05), 埃及尼羅羅非魚和吉富羅非魚A/G在感染72h后顯著性降低(P<0.05)。
2.4 四個羅非魚選育品種感染無乳鏈球菌后血清堿性磷酸酶和乳酸脫氫酶的變化
由表3可知, 埃及尼羅羅非魚的AKP在感染72h后顯著降低(P<0.05), 奧利亞和吉富羅非魚的AKP表現為先上升后下降, 在感染24h時達到峰值,但在感染72h時和感染前沒有顯著性差異(P>0.05),奧尼羅非魚的AKP感染前后沒有顯著性變化(P>0.05), 并且在感染前后各時間點都顯著低于其余品種羅非魚(P<0.05)。感染前和感染48h后吉富和奧尼羅非魚的LDH顯著低于埃及尼羅和奧利亞羅非魚(P<0.05)。奧利亞羅非魚的LDH感染后一直持續顯著升高(P<0.05), 在感染后72h其值為感染前的3.22倍, 而埃及尼羅、吉富和奧尼羅非魚的LDH卻先升高后降低, 感染48h后達到峰值, 分別為感染前的2.31倍、6.53倍和7.28倍。
2.5 四個羅非魚選育品種感染無乳鏈球菌后血清超氧化物歧化酶和溶菌酶的變化
由表4可知, 奧利亞和奧尼羅非魚的SOD感染48h后顯著升高(P<0.05), 吉富羅非魚的SOD在感染48h時顯著升高(P<0.05), 感染72h后恢復到感染前水平, 埃及尼羅羅非魚的SOD感染前后沒有顯著性變化(P>0.05), 但其值都顯著高于其余各品種(P<0.05)。奧利亞羅非魚LZM在感染48h后顯著降低(P<0.05), 感染72h后又顯著升高到感染前水平,埃及尼羅和奧尼羅非魚在感染48h后顯著升高(P<0.05), 而吉富羅非魚在感染72h后才顯著升高(P<0.05), 奧尼羅非魚在各時間點LZM活性都顯著高于其余品種羅非魚(P<0.05)。
2.6 四個羅非魚選育品種感染無乳鏈球菌后的組織病理學變化
在人工感染無乳鏈球菌后, 4個羅非魚選育品種的肝臟、脾臟和腎臟均表現出顯著的病理學變化。奧利亞羅非魚: 與對照組肝臟相比(圖版Ⅰ-1),感染組肝臟脂肪變性, 見許多大小不等的脂肪空泡,肝索排列紊亂(圖版Ⅰ-2); 與對照組脾臟相比(圖版Ⅰ-3), 感染組脾臟含鐵血黃素沉積, 脾實質細胞水腫, 淋巴細胞, 單核細胞浸潤(圖版Ⅰ-4); 與對照組腎臟相比(圖版Ⅰ-5), 感染組腎小球輕微萎縮, 腎小管上皮細胞顆粒變性, 并見少量淋巴細胞浸潤(圖版Ⅰ-6)。埃及尼羅羅非魚: 與對照組肝臟相比(圖版Ⅰ-7), 感染組肝臟嚴重脂肪變性、壞死, 淋巴細胞浸潤(圖版Ⅰ-8); 與對照組脾臟相比(圖版Ⅰ-9),感染組脾臟含鐵血黃素沉積, 周圍見淋巴細胞浸潤,血漿蛋白滲出呈淀粉樣變性(圖版Ⅰ-10); 與對照組腎臟相比(圖版Ⅰ-11), 感染組腎小球嚴重萎縮空泡化, 腎小管上皮細胞嚴重變性、壞死(圖版Ⅰ-12)。吉富羅非魚: 與對照組肝臟相比(圖版Ⅰ-13), 感染組肝細胞水腫, 細胞內玻璃樣變, 血管壁見淋巴細胞浸潤(圖版Ⅰ-14), 與對照組脾臟相比(圖版Ⅰ-15),感染組脾充血呈淀粉樣變性, 含鐵血黃素沉積和巨噬細胞浸潤(圖版Ⅰ-16), 與對照組腎臟相比(圖版Ⅰ-17), 感染組腎小球萎縮空泡化, 腎間質淋巴細胞浸潤(圖版Ⅰ-18); 奧尼羅非魚: 與對照組肝臟相比(圖版Ⅰ-19), 感染組肝索排列紊亂, 肝細胞水腫顆粒變性, 靜脈周圍見纖維樣變性(圖版Ⅰ-20), 與對照組脾臟相比(圖版Ⅰ-21), 感染組脾充血呈淀粉樣變性, 大量巨噬細胞浸潤(圖版Ⅰ-22), 與對照組腎臟相比(圖版Ⅰ-23), 感染組腎小球萎縮, 腎小管上皮細胞顆粒變性(圖版Ⅰ-24)。
3 討論
3.1 四個羅非魚選育品種感染無乳鏈球菌后抗病力差異分析
目前我國羅非魚具有穩定遺傳性狀的品種有11個, 生產上常用的尼羅羅非魚、奧利亞羅非魚、“新吉富”羅非魚(NEW GIFT tilapia,O. niloticus♀×O. niloticus♂)等養殖品種采用群體選育路線, 吉富羅非魚采用家系選育路線。由于羅非魚種間雜交后代在一些生產性狀上表現出明顯雜種優勢, 生產中也被廣泛采用, 如奧尼雜交羅非魚。強俊等[12]研究表明, 感染海豚鏈球菌4d后吉富羅非魚和“新吉富”羅非魚累積死亡率顯著高于紅羅非魚(Red tilapia,Oreochromisspp.)和埃及尼羅羅非魚(O. niloticusEgypt strain), 而本文研究表明感染3d后吉富羅非魚的累積死亡率顯著低于埃及尼羅羅非魚, 但感染4d后兩者之間的累積死亡率沒有顯著性差異,這可能是因為不同的品種對不同鏈球菌的易感性不同, 或者不同鏈球菌毒力差異所致。Huang等[13]比較了新吉富羅非魚, 奧尼羅非魚和吉奧羅非魚(NEW GIFTO. niloticus♀×O. aureus♂)對無乳鏈球菌的抗病力差異, 發現奧尼羅非魚抗病力最強。柯劍等[14]用嗜水氣單胞菌浸泡感染奧利亞、尼羅、奧尼、吉富、莫荷(O. mossambica♀×O. hornorum♂)5個品種羅非魚, 表明奧利亞和奧尼羅非魚抗病力相對較好, 本實驗顯示感染無乳鏈球菌7d后奧尼羅非魚的累計死亡率最低。結果表明雜交育種獲得的奧尼雜交魚抗病力不僅超過親代埃及尼羅羅非魚和奧利亞羅非魚, 而且超過了家系選育獲得的吉富羅非魚, 證明了雜交育種是行之有效的品種培育的手段之一, 能顯著增強魚體抗病力。
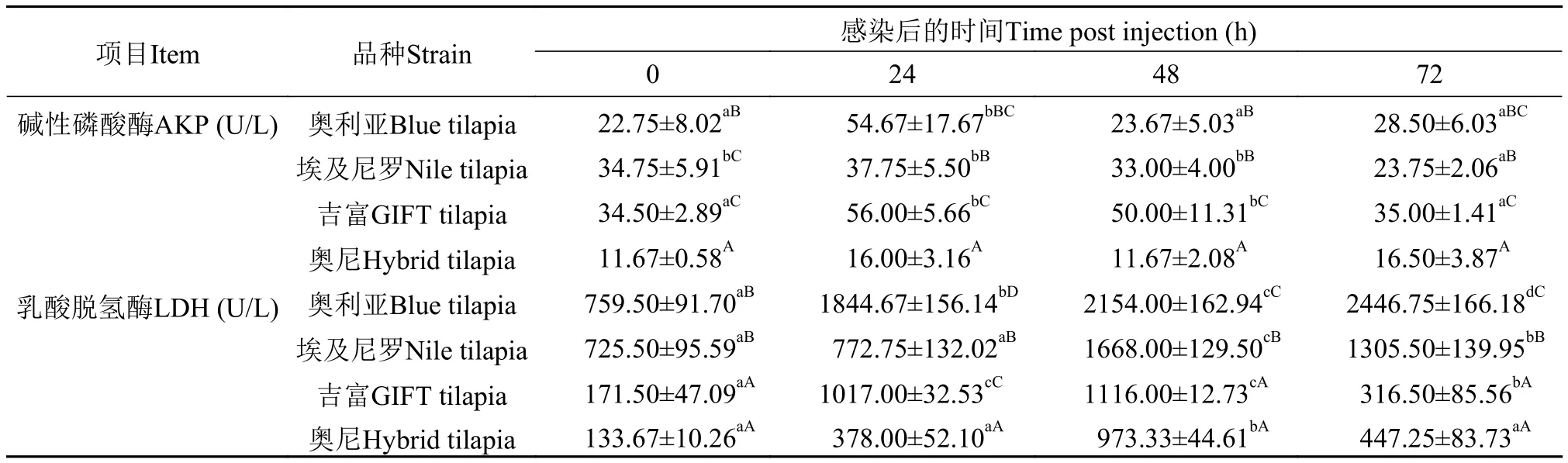
表3 四個羅非魚選育品種感染無乳鏈球菌后血清的堿性磷酸酶和乳酸脫氫酶的變化Tab. 3 The comparison on serum alkaline phosphatasel activity and lactic dehydrogenase of four Oreochromis spp. bleeding species infected by S. agalactiae (n=6; x±SD)

表4 四個羅非魚選育品種感染無乳鏈球菌后血清的超氧化物歧化酶和溶菌酶的變化Tab. 4 The comparison on serum superoxide dismutase and lysozyme activities of four Oreochromis spp. bleeding species infected by S.agalactiae (n=6; x±SD)
3.2 四個羅非魚選育品種感染無乳鏈球菌后血清生化指標的變化
血液生化指標是反映魚類的生理代謝狀態變化和魚體對病原菌生理響應的有力指標, 能評估魚體的健康狀態[5]。已有研究表明, 魚體被病原菌感染后血清中ALT和AST含量都會顯著增加, 如羅非魚被創傷弧菌(Vibrio vulnificus)和海豚鏈球菌感染后[7], 大黃魚(Pseudosciaena crocea)被哈維氏弧菌(Vibrio harveyi)感染后[8], 鯰(Silurus asotus)被愛德華氏菌(Edwardsiella tarda)感染后[15]。ALT、AST是肝臟受損傷重要的指示酶[16], 本試驗中奧利亞羅非魚和吉富羅非魚的ALT和AST在感染12h后就顯著上升, 埃及尼羅和奧尼羅非魚的AST在感染48h后才顯著升高, 而埃及尼羅和奧尼的ALT感染前后沒有顯著性變化, 奧尼羅非魚的AST在感染前后始終都低于其余3個品種羅非魚, 說明奧尼羅非魚的抗病力較強, 肝臟受損較輕, 但埃及尼羅的ALT和AST在攻毒前就顯著高于其余3個品種的羅非魚, 可能是因為埃及尼羅羅非魚相比較其余3種羅非魚對高溫的耐受性較差, 在暫養1周的時候受到高溫應激肝臟就已經受損[17]。
球蛋白(GLO)主要在肝的淋巴組織生成, 參與機體免疫反應, 較高的血清球蛋白含量對應著較強的免疫力[18]。強俊等[12]研究表明, 不同品系羅非魚感染海豚鏈球菌96h后, 埃及尼羅與紅羅非魚GLO顯著上升(P<0.05), 而吉富羅非魚與新吉富羅非魚的GLO沒有顯著變化(P>0.05)。本試驗中埃及尼羅羅非魚和奧尼羅非魚在感染72h后GLO分別顯著升高1.13倍和1.41倍, 而奧利亞和吉富羅非魚GLO在感染前后沒有顯著性差異, 說明奧尼羅非魚對應著較強的免疫力。A/G比值可以衡量機體正常的蛋白質維持程度[12,17]。強俊等[12]研究表明埃及尼羅與紅羅非魚隨感染時間的延長, A/G比值基本呈下降趨勢。我們之前的研究表明埃及尼羅羅非魚在高溫應激下無乳鏈球菌感染后A/G的比值攻毒后呈下降趨勢[17]。本試驗中奧尼羅非魚A/G在感染前后沒有顯著性變化, 而奧利亞羅非魚, 埃及尼羅羅非魚和吉富羅非魚A/G比值在感染后都顯著性降低, 說明感染無乳鏈球菌后奧尼羅非魚體內的蛋白維持程度最好, 能較好地抵抗病原菌的侵染。
非特異性免疫防御機制作為魚類抵抗病原的第一道屏障, 在維持魚類機體健康和抗病原防御中具有重要的作用[19]。AKP和LDH是除SOD和LZM之外魚體血清中的重要的非特異免疫酶。AKP是一種重要的代謝調控酶, 參與鈣磷代謝和磷酸基團的轉移, 并且能夠通過改變病原體的表面結構提高機體對病原體的識別和吞噬能力, 有助于增強魚體的抗病力[12,17]。不同品系羅非魚感染海豚鏈球菌96h血清中AKP顯著降低[12], Yu等[15]報道患遲緩愛德華菌病的鲇血清中AKP降低, 推測可能與貧血相關, 這通常是代謝活動減弱的結果。我們之前研究表明高溫應激下羅非魚感染無乳鏈球菌后AKP表現為先上升后下降[17]。本研究中埃及尼羅羅非魚的AKP在感染72h后顯著降低, 奧利亞和吉富羅非魚的AKP表現為先上升后下降, 奧尼羅非魚的AKP感染前后沒有顯著性變化, 說明無乳鏈球菌感染對埃及尼羅羅非魚代謝活動影響最大, 對奧尼羅非魚影響最小。LDH含量增高, 是病魚肌肉組織受損的表征[20]。金珊等[21]報道加州鱸(Micropterus salmoides)患白云病后血液中LDH顯著上升, 但大黃魚感染哈維氏弧菌后LDH卻沒有顯著性變化[8],這可能是因為哈維氏弧菌感染對大黃魚的肌肉損傷影響較小。本試驗中感染無乳鏈球菌后各品種羅非魚血清中的LDH都顯著升高, 感染前和感染48h后吉富和奧尼羅非魚的LDH顯著低于埃及尼羅和奧利亞羅非魚, 說明無乳鏈球菌感染對各品種羅非魚的肌肉都造成了損傷, 而埃及尼羅和奧利亞羅非魚在試驗前暫養階段高水溫就對魚體肌肉有了一定的損傷。
SOD作為抗氧化酶, 能夠清除有危害性的活性氧, 使機體防御過氧化損害, 并與免疫水平相關, 有助于增強機體的免疫功能和抗病能力[17]。高溫應激下無乳鏈球菌感染96h內SOD表現為先升高后降低, 升高的原因可能是魚體遭到無乳鏈球菌侵襲后,激活了該誘導酶, 下降則可能是因為病原菌感染而導致活性氧自由基的水平超過了魚體自身的清除閡值, SOD活性受到了抑制[17]。本試驗中奧利亞、吉富羅非魚和奧尼羅非魚的SOD感染48h時都顯著升高, 說明無乳鏈球菌感染誘導了SOD的表達, 只有埃及尼羅羅非魚的SOD感染前后沒有顯著性變化, 但其值都顯著高于其余各品種的值, 我們之前的研究表明埃及尼羅羅非魚在33℃SOD水平顯著高于29℃, 說明高溫應激造成埃及尼羅機體損傷,使魚體SOD升高以抵御損傷[17]。LZM由白細胞釋放, 作為是魚類最常見的體液免疫指標之一, 在抗菌活動中起著重要作用[22]。Huang等[13]報道LZM水平和魚體抵抗無乳鏈球菌侵染的能力有一定的相關性, 奧尼羅非魚比新吉富羅非魚和吉奧羅非魚LZM水平更高, 對鏈球菌感染也有更高的抵抗力,LZM水平可作為抗鏈球菌品系的選育指標。與此類似的是, 具有更高LZM水平的虹鱒和鯉魚家系對嗜水氣單胞菌具有更強的抵抗力[23,24]。本試驗中奧尼羅非魚在各時間點溶菌酶活性都顯著高于其余各品種羅非魚, 說明奧尼羅非魚對無乳鏈球菌的抗病力最強。
3.3 四個羅非魚選育品種感染無乳鏈球菌后組織病理的變化
對魚體進行組織病理學檢查, 有利于疾病的診斷[6,17]。我們之前的研究表明羅非魚感染無乳鏈球菌后會引起各內臟器官的廣泛充血、水腫、變性和炎性細胞浸潤, 嚴重的細胞壞死[11]。高溫應激會對魚體的肝臟、脾臟和腎臟造成輕微病變, 無乳鏈球菌感染12h后脾臟就發生了嚴重充血, 感染24h后脾臟呈淀粉樣變性, 壞死, 感染48h后腎小球均發生萎縮, 腎小管上皮細胞脫落壞死[17]。在本試驗中,人工感染無乳鏈球菌后, 4個品種羅非魚的肝臟、脾臟和腎臟均出現不同程度的病理變化, 其中吉富羅非魚和奧尼羅非魚肝索排列紊亂, 肝細胞水腫變性,而奧利亞羅非魚和埃及尼羅羅非魚肝臟中大面積肝細胞脂肪變性, 最終使肝代謝受到阻礙, 引起肝功能障礙, 其病理學變化程度與血清中AST值有一定的相關性, 感染72h后奧利亞羅非魚和埃及尼羅羅非魚血清中的AST值顯著高于吉富羅非魚和奧尼羅非魚, Chen等[7]也研究表明了羅非魚感染創傷弧菌與海豚鏈球菌后肝和腎的病理學變化嚴重程度與血液中的ALT和AST呈正相關。每個品種的羅非魚感染無乳鏈球菌后都引起了嚴重的脾炎, 大量巨噬細胞或者淋巴細胞等炎性細胞浸潤, 這可能是因為脾臟作為免疫器官, 優先響應吞噬鏈球菌[25]。此外, 奧利亞、埃及尼羅和吉富羅非魚的脾臟中大量鐵血黃素沉積, 說明這3種羅非魚明紅細胞大量被破壞, 溶血嚴重, 造成脾臟造血功能較低, 導致貧血以及免疫功能降低, 致使機體抵抗力降低[11]。病原菌產生的毒素致使奧利亞羅非魚和奧尼羅非魚腎小球輕微萎縮, 腎小管上皮細胞顆粒變性, 埃及尼羅羅非魚和吉富羅非魚腎小球嚴重萎縮空泡化,腎小管上皮細胞嚴重變性、壞死, 說明鏈球菌感染造成羅非魚腎功能障礙。海豚鏈球菌的感染也能引起羅非魚腎小管上皮細胞的相似的病變, 造成腎小球的濾過及腎小管的重吸收作用減弱, 腎臟機能降低, 以致體內滲透壓及水鹽失衡。
綜上所述, 奧尼羅非魚在4個羅非魚選育品種中抗鏈球菌病能力最強; 4個羅非魚選育品種感染無乳鏈球菌后肝臟、脾臟和腎臟均出現不同程度的病理變化, 血清中AST水平與肝受損程度呈一定的正相關, LZM水平和羅非魚抗鏈球菌病能力呈一定的正相關。
參考文獻:
[1]Xu P, Dong Z J, Zhu W B. GIFT strain tilapia (Oreochromis niloticus♀×Oreochromis niloticusreochromis nilotic ♂) “Zhongwei No.1” [J].Fisheries of China, 2015,(9): 45—47 [徐跑, 董在杰, 朱文彬. 吉富羅非魚“中威1號”. 中國水產, 2015, (9): 45—47]
[2]Terry C H, Jenifer L C, Stephen A S. Hematology and plasma chemistry reference intervals for cultured tilapia(OreochromisHybrid) [J].Veterinary Clinical Pathology,2008, 29(1): 7—12
[3]Okorie-Kanu C O, Unakalamba N J. Normal haematological and blood biochemistry values of cultured Heteroclarias hybrid in South East Nigeria [J].Comparative Clinical Pathology, 2014, 24(5): 1—6
[4]Mozanzadeh M T, Yaghoubi M, Yavari V,et al. Reference intervals for haematological and plasma biochemical parameters in sobaity sea bream juveniles (Sparidentex hasta, Valenciennes 1830) [J].Comparative Clinical Pathology, 2015, 24(6): 1501—1507
[5]Clauss T M, Dove A D M, Arnold J E. Hematologic disorders of fish [J].Veterinary Clinics of North America Exotic Animal Practice, 2008, 11(3): 445—462
[6]Wongsathein D. Factors affecting experimentalStreptococcus agalactiaeinfection in tilapia,Oreochromis niloticus[D]. Scotland: The University of Stirling. 2012
[7]Chen C, Wooster G A, Bowser P R. Comparative blood chemistry and histopathology of tilapia infected withVibrio vulnificusorStreptococcus iniaeor exposed to carbon tetrachloride, gentamicin, or copper sulfate [J].Aquaculture, 2004, 239(1—4): 421—443
[8]Xu X J, Xu B, Wang J,et al. Studies on blood chemistry indices and histopathology ofPseudosciaena croceaartificially challenged withVibrio harveyi[J].Journal of Fisheries of China, 2010, 34(4): 618—625 [徐曉津, 徐斌, 王軍, 等. 大黃魚感染哈維氏弧菌后血液生化指標的變化及組織病理學觀察. 水產學報, 2010, 34(4):618—625]
[9]Zhu J L, Yang H, Zou Z Y,et al. Isolatiom, identification and drug sensitivity test of patholgenic streptococcus from tilapiasOreochromis niloticuscultured in Hainan[J].Oceanologia et Limnologia Sinica, 2010, 41(4):590—596 [祝璟琳, 楊弘, 鄒芝英, 等. 海南養殖羅非魚(Oreochromis niloticus) 致病鏈球菌的分離、鑒定及其藥敏試驗. 海洋與湖沼, 2010, 41(4): 590—596]
[10]Chen M, Li L P, Wang R,et al. PCR detection and PFGE genotype analyses of streptococcal clinical isolates from tilapia in China [J].Veterinary Microbiology, 2012,159(3-4): 526—530
[11]Zhu J L, Zou Z Y, Li D Y,et al. Pathological changes in tilapia (Oreochromis niloticus) naturally infected byStreptococcus agalactiae[J].Journal of Fisheries of China, 2014, 38(11): 1937—1944 [祝璟琳, 鄒芝英, 李大宇, 等. 尼羅羅非魚無乳鏈球菌病的病理學研究. 水產學報, 2014, 38(11): 1937—1944]
[12]Qiang J, Yang H, Wang H,et al. Studies on blood biochemical indices and expression of hepatic HSP70 mRNA of different tilapia strains artificially challenged withStreptococcus iniae[J].Journal of Fisheries of China,2012, 36(6): 958—968 [強俊, 楊弘, 王輝, 等. 海豚鏈球菌感染對不同品系羅非魚血液生化指標和肝臟HSP70 mRNA表達的影響. 水產學報, 2012, 36(6): 958—968]
[13]Huang B F, Zou L L, Xie J G,et al. Immune responses of different species of tilapia infected withStreptococcus agalactiae[J].Journal of Fish Diseases, 2013, 36(8):747—752
[14]Ke J. Bacteria pathogeny isolation, identification and primary comparative study of disease resistance in Tilapia species [D]. Shanghai Ocean University. 2011 [柯劍. 羅非魚病原菌分離鑒定及不同品系間抗病力初步比較.上海海洋大學. 2011]
[15]Yu J H, Han J J, Park S W. Haematological and biochemical alterations in Korean catfish,Silurus asotus, experimentally infected withEdwardsiella tarda[J].Aquaculture Research, 2010, 41(2): 295—302
[16]?ehulka J, Mina?ík B. Blood parameters in brook trout Salvelinus fontinalis (Mitchill, 1815), affected by columnaris disease [J].Aquaculture Research, 2007, 38(11):1182—1197
[17]Zhu J L, Li D Y, Zou Z Y,et al. The impact of high temperature stress on serum biochemical parameters and histopathology of tilapiaOreochromis niloticusinfected byStreptococcus agalactiae[J].Journal of Fisheries of China, 2016, 40(3): 445—456 [祝璟琳, 李大宇, 鄒芝英,等. 高溫應激下無乳鏈球菌感染對尼羅羅非魚血清生化指標和組織病理的影響. 水產學報, 2016, 40(3):445—456]
[18]Moran C U H F. Innate and adaptive immunity in teleost fish: a review [J].Veterinarni Medicina, 2011, 56(10):486—503
[19]Magnadottir B. Innate immunity of fish (overview) [J].Fish amp; Shellfish Immunology, 2006, 20(2): 137—151
[20]Zhou Y, Guo W C, Yang Z G,et al. Studies on the blood biochemical indice of “Mad Swim Disease” eel,Anguilla anguillaL [J].Acta Hydrobiologica Sinica, 2002, 26(3):314—316 [周玉, 郭文場, 楊振國, 等. 歐洲鰻鱺“狂游病”血液生化指標研究. 水生生物學報, 2002, 26(3):314—316]
[21]Jin S, Wang G L, Zhao Q S,et al. Preliminary studies on pathogen and hemopathology of the white cloud disease inMicropterus salmoides[J].Acta Hydrobiologica Sinica, 2005, 29(2): 184—188 [金珊, 王國良, 趙青松, 等. 加州鱸白云病的病原及血液病理的初步研究. 水生生物學報, 2005, 29(2): 184—188]
[22]He Z G, Wang J L, Wu Y A. Effect of dietary lipid levels on serum biochemical indeces, immune responses and antioxidant capability of juvenile Furong crucian carp (Furong carp ♀×Red crucian carp♂) [J].Acta Hydrobiologica Sinica, 2016, 40(4): 655—662 [何志剛, 王金龍, 伍遠安, 等. 飼料脂肪水平對芙蓉鯉鯽幼魚血清生化指標、免疫反應及抗氧化能力的影響. 水生生物學報,2016, 40(4): 655—662]
[23]R Ed K H, Fevolden S E, Fjalestad K T. Disease resistance and immune characteristics in rainbow trout (Oncorhynchus mykiss) selected for lysozyme activity [J].Aquaculture, 2002, 209(1-4): 91—101
[24]Ardó L, Jeney Z, Adams A,et al. Immune responses of resistant and sensitive common carp families following experimental challenge withAeromonas hydrophila[J].Fish amp; Shellfish Immunology, 2010, 29(1): 111—116
[25]Chen D, Wang K, Geng Y,et al. Pathological changes in cultured channel catfishIctalurus punctatusspontaneously infected withStreptococcus iniae[J].Diseases of Aquatic Organisms, 2011, 95(3): 203—208
STUDY ON RESISTANT DIFFERENCE AMONG FOUR BLEEDING SPECIES OF TILAPIA OREOCHROMIS SPP. FOLLOWING STREPTOCOCCUS AGALACTIAE CHALLENGE
ZHU Jing-Lin1,2, ZOU Zhi-Ying2, LI Da-Yu2, XIAO Wei2, XU Pao2, YANG Hong2and XUE Liang-Yi1
(1. College of Marine Science, Ningbo University, Ningbo 315211, China; 2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences, Wuxi 214081, China)
The aim of this paper was to identify a tilapia strain that is the most resistant to the infection ofStreptococcus agalactiae. The serum biochemical parameters and histopathology of Blue tilapia (Oreochromis aureus) “Xia’ao No.1”, Nile tilapia (Oreochromis niloticus) “99 strain”, GIFT tilapia (Oreochromis niloticus♀×Oreochromis niloticus♂) “Zhongwei No.1”, Hybrid tilapia (Oreochromis niloticus♀×Oreochromis aureus♂) infected byS. agalac
tiaewere investigated. They were cultured on (33±1) ℃. All fish were acclimated to the laboratory conditions for one week then artificially inducedS. agalactiaeto the fish. The cumulative mortality was recorded at different time points.Blood and tissue samples were collected at 0, 12h, 24h, 48h and 72h after infection. The result showed that the cumulative mortality of Hybrid tilapia was significantly lower than that of other species; Glutamic-oxaloacetic transamnase(AST) activity of Hybrid tilapia was consistently lower than that of other three strains (P<0.05); compared with initial measurement, globulin of Nile tilapia and Hybrid tilapia increased by 1.13 times and 1.41 times respectively at 72h after infection. Albumin/globulin (A/G) index of Hybrid tilapia showed no significantly difference (P>0.05), while that of other three species was significantly lower after infection (P<0.05); Alkaline phosphatase (AKP) activity of Nile tilapia decreased significantly at 72h after infection (P<0.05) while AKP levels of Blue tilapia and GIFT tilapia increased first followed by decrease, and AKP of Hybrid tilapia showed no significantly difference (P>0.05). Lactic dehydrogenase (LDH) of all four strains increased significantly on the progress of disease after infection (P<0.05). Superoxide dismutase (SOD) activities of Blue tilapia, GIFT tilapia and Hybrid tilapia increased significantly at 48h after infection (P<0.05). Lysozyme (LZM) activities of Hybrid tilapia were consistently higher than that of other three strains(P<0.05). Hepatocytes of GIFT and Hybrid tilapia showed hydropic degeneration, while hepatocytes of Blue tilapia,Nile tilapia showed highly vacuolation and macrovesicular steatosis. The spleen of all challenged strains showed had serious splenitis while the spleen of Blue tilapia, Nile tilapia and GIFT tilapia contained a large number of hemosiderin deposition. Renal glomerular atrophy, degeneration and necrosis in renal tubule epithelial cell were apparent after infection. The results indicated that Hybrid tilapia was the most resistant toS. agalactiae; AST in serum was correlated positively with liver damage; LZM level was correlated positively with the anti-Streptococcusability.
Species;Oreochromisspp.;Streptococcus agalactiae; Biochemical parameters; Lysozyme (LZM);Resistance to disease; Histopathology
S941
A
1000-3207(2017)06-1232-10
2016-09-30;
2017-05-23
現代農業產業技術體系建設專項(CARS-49); 中央級公益性科研院所基本科研業務費專項(2015JBFM27、2017JBFZ03、2015JBFM08)資助 [Supported by the Earmarked Fund for China Agriculture Research System (CARS-49); the Special Scientific Research Funds for Central Non-profit Institutes, Chinese Academy of Fishery Sciences (2015JBFM27, 2017JBFZ03,2015JBFM08)]
祝璟琳(1983—), 男, 浙江省武義縣人; 博士研究生; 研究方向為羅非魚育種與病害防治。E-mail: zhujl@ffrc.cn
楊弘, 研究員;E-mail: yangh@ffrc.cn; 薛良義, 教授;E-mail: xueliangyi@nbu.edu.cn
10.7541/2017.153


圖版Ⅰ 四個羅非魚選育品種感染無乳鏈球菌后肝臟、脾臟和腎臟的組織病理變化PlateⅠ Histopathological changes in liver, spleen and kidney of four Oreochromis spp. bleeding species infected by Streptococcus agalactiae

