三疣梭子蟹HMGBa基因克隆及其應答不同病原入侵的表達特征
三疣梭子蟹HMGBa基因克隆及其應答不同病原入侵的表達特征
為研究三疣梭子蟹(Portunus trituberculatus)高遷移率族蛋白B (High-mobility group box protein,HMGB)在其先天免疫中發揮的功能, 利用RACE技術首次克隆得到了三疣梭子蟹HMGBa基因, 命名為PtHMGBa。其cDNA序列全長1030 bp, 其中5′端非編碼區(UTR)為94 bp, 3′端非編碼區(UTR)為255 bp, 開放閱讀框(ORF)為681 bp, 編碼一個含有227個氨基酸, 分子量25.82 kD, 理論等電點為5.94的蛋白質。PtHMGBa蛋白包含2個HMG盒結構域和一個酸性尾部結構域。分析表明, 三疣梭子蟹HMGBa氨基酸序列與凡納濱對蝦(Litopenaeus vannamei) HMGBa相似度最高。實時熒光定量PCR結果顯示,PtHMGBa基因在血細胞和肝胰腺的表達量最高, 在眼柄中表達量最低。在副溶血弧菌和WSSV感染過程中,PtHMGBa基因在肝胰腺和血細胞中均出現了表達上調。其中, 經副溶血弧菌感染后, 該基因在上述2種組織中分別于48h和6h達到表達量的峰值; 經WSSV感染后, 該基因在2種組織中均在12h達到表達量的峰值。結果表明PtHMGBa基因參與了三疣梭子蟹抵御外來病原的免疫響應, 研究為深入開展三疣梭子蟹和其他甲殼動物的免疫調控機理提供了科學依據。
三疣梭子蟹; 高遷移率蛋白B; 基因克隆; 先天免疫; 表達分析
三疣梭子蟹(Portunus trituberculatus)是一種重要的海洋經濟動物, 在中國、朝鮮、日本等海域均有分布, 在我國黃渤海及東海分布尤為廣泛, 其肉質鮮美, 營養豐富, 是我國重要的海水養殖品種之一[1,2]。但隨著養殖規模的不斷擴大, 苗種質量參差不齊, 再加上水體環境惡化, 造成其病害也日趨嚴重, 給養殖產業帶來了巨大的經濟損失。有研究表明, 在蝦蟹混養池中, 三疣梭子蟹也可感染對蝦白斑綜合征病毒(WSSV)并造成三疣梭子蟹組織病變乃至死亡[3]。另外, 副溶血弧菌(Vibrio parahemolyticus)也可造成三疣梭子蟹感染發病, 表現為游動遲緩、肝胰腺色淡、鰓混且附有污物等癥狀[4]。然而, 三疣梭子蟹等無脊椎動物沒有類似于哺乳動物的B淋巴細胞和T淋巴細胞, 不能產生抗體, 因此也不具有獲得性免疫系統[5], 但其具有獨特的先天性免疫系統, 可以通過免疫信號通路級聯反應清除入侵機體的病原微生物。
高遷移率族蛋白(High-mobility group protein,HMG protein)最初在牛胸腺中被發現, 因其在聚丙烯酰胺凝膠電泳中遷移率快而得名。HMGB蛋白是一種典型的HMG家族蛋白, 在調節DNA重組、修復、復制和基因轉錄方面均起著重要作用[6]。近來研究發現, 脊椎動物中的HMGB1可由凋亡細胞或經IL-1β等炎癥因子激活的細胞釋放到細胞外[7—9],并與先天免疫信號通路TLR家族中的TLR2、TLR4、TLR9等受體結合[10—12], 調節多種免疫炎癥反應。HMGB蛋白有著典型的結構域, 即位于蛋白N端及中部的2個HMG盒結構域和1個C端富含酸性氨基酸的尾部結構域[13]。
目前對HMGB家族基因的研究大多在脊椎動物中, 在無脊椎動物, 特別是甲殼動物中的研究較少, 僅有凡納濱對蝦(Litopenaeus vannamei)的LvHMGBa、LvHMGBb基因被克隆, 結果表明經WSSV感染后,LvHMGBa和LvHMGBb均出現了表達上調[14]。然而, HMGB家族基因在三疣梭子蟹免疫調控中發揮的功能還未見文獻報道。我們利用RACE技術首次克隆出了三疣梭子蟹HMGBa基因的cDNA全長序列, 命名為PtHMGBa, 并且對其序列進行了分析, 闡明了其系統進化關系。利用實時熒光定量PCR檢測副溶血弧菌和WSSV感染后三疣梭子蟹肝胰腺和血細胞中PtHMGBa的表達變化,旨在為進一步研究三疣梭子蟹PtHMGBa基因在先天免疫中發揮的作用提供科學依據。
1 材料與方法
1.1 實驗材料
本實驗所用的三疣梭子蟹均取自中國水產科學研究院黃海水產研究所實驗基地山東省昌邑市海豐水產養殖有限責任公司, 體重為(33.5±3) g, 放置于整理箱(560 mm×360 mm×280 mm)中暫養7d,水溫保持在(20±2)℃、鹽度33, pH 8.2。暫養期間持續充氧, 每天換水清污, 換水量為原水量的1/3,每天定時投喂餌料, 保留活力形態均較好的個體。
1.2 RNA的提取及RACE第一鏈合成
用Trizol法分別提取三疣梭子蟹各組織總RNA,采用紫外分光光度計與瓊脂糖凝膠電泳等方法, 將提取得到的總RNA進行質量和完整性檢測。按照SMARTTMRACE Amplification Kit (Clontech)說明書的方法, 選取質量及完整性均較好的肝胰腺組織總RNA用來合成3′和5′ RACE第一鏈, 用于后續實驗。
1.3 三疣梭子蟹HMGBa基因cDNA序列全長的克隆
根據本實驗室轉錄組庫中所得到的三疣梭子蟹HMGBa基因EST序列, 利用Premier 5.0軟件分別設計3′和5′末端特異性引物(表1), 由擎科梓熙生物技術有限公司進行合成。參照SMART RACE說明書, 利用Advantange 2 PCR Kit (Clontech)使UPM與相應的特異性引物分別與模板結合, 進行三疣梭子蟹HMGBa基因cDNA 3′和5′末端擴增。PCR程序設為: 94℃ 30s, 60℃ 30s, 72℃ 90s, 30個循環。擴增產物用Nucleo Spin Gel and PCR Clean-Up試劑盒(TaKaRa)切膠回收得到目的片段。將目的片段和pMD 19-T進行載體連接, 16℃反應3h, 將連接產物轉入到大腸桿菌DH5α感受態細胞中, 涂平板后37℃培養12h。挑取陽性菌落在加入AMP的LB液體培養基中培養5h, 隨后進行菌液PCR檢測, 測序由擎科梓熙生物技術有限公司完成。
1.4 三疣梭子蟹HMGBa基因的生物學分析
利用ContigExpress Project軟件去掉載體序列保留目的片段序列, 將所得到的目的片段序列與三疣梭子蟹HMGBa基因EST序列拼接后得到三疣梭子蟹HMGBa基因cDNA序列全長。通過BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)將得到的三疣梭子蟹HMGBa基因的cDNA序列進行同源性比對。利用EditSeq和Gene Tool預測開放閱讀框(ORF)并翻譯得到其氨基酸序列。氨基酸序列分子量及等電點用在線ExPASy進行預測, 利用SMART(http://smart.embl-heidelberg.de)進行蛋白質功能結構域預測與分析。利用DNAMAN將三疣梭子蟹HMGBa氨基酸序列和其他物種相應氨基酸序列進行多重序列比對, 使用MEGA 5.0軟件構建Neighbor-Joining系統進化樹, 對三疣梭子蟹HMGBa基因的親緣關系分析。
1.5 病原感染實驗
將實驗所用三疣梭子蟹暫養7d后分為2個實驗組和1個對照組, 即副溶血弧菌感染組、WSSV感染組、PBS對照組, 每組80只三疣梭子蟹。3組三疣梭子蟹分別注射100 μL副溶血弧菌(2.6×107CFU/mL)、WSSV (3.2×107拷貝/mL)和PBS, 實驗期間的飼養和管理與暫養期保持一致。分別于0、3h、6h、12h、24h、48h和72h進行取樣, 3只設為1個平行, 取其肝胰腺、血淋巴等組織。將所取血淋巴4000 r/min離心15min, 去血清保留血細胞后立即加入300 μL Trizol, 和所取其他組織整理分類后置于液氮中保存, 以便后續分析。
1.6 三疣梭子蟹HMGBa基因的定量表達分析
將三疣梭子蟹血細胞、肝胰腺、鰓、肌肉、心臟、眼柄、表皮、胃、腸等組織以及不同感染時間點所取組織分別提取RNA, 用核酸定量儀和瓊脂糖凝膠電泳檢測RNA的質量和完整性, 確保RNA質量與完整性均好, 隨后用Prime Script RT reagent Kit進行反轉錄合成cDNA, 具體方法按照說明書進行。
根據本實驗中已經得到的三疣梭子蟹HMGBa基因的開放閱讀框cDNA序列, 設計合成一對正反向特異熒光定量引物, 并且以內參基因β-actin作為對照(β-actin-F和β-actin-R、HMGBa-F和HMGBa-R)(表1)。參照SYBR Premix ExTaqTMⅡ說明書,利用Applied Biosystems 7500 Real Time PCR儀分析三疣梭子蟹血細胞、肝胰腺、鰓、肌肉、心臟、眼柄、表皮、胃、腸等組織以及不同感染時間點所取血細胞、肝胰腺等組織中HMGBa基因的相對表達量。設置反應體系為10 μL, 包括5 μL SYBR Premix ExTaqTMⅡ、0.4 μL 10 μmol/L的正反向引物、0.2 μL ROX Reference DyeⅡ、1.0 μL cDNA和3.0 μL滅菌雙蒸水。設置反應程序為: 95℃ 30s;95℃ 5s, 60℃ 34s, 40個循環; 95℃ 15s, 60℃ 1min,95℃ 15s。各樣本均設置3個重復, 實驗結果采用相對標準曲線法2–ΔΔCt[15]進行相對定量計算, 并利用SPSS 19.0軟件對結果進行單因素方差分析(Oneway, ANOVA), 并對其顯著性進行檢驗(P<0.05表示具有差異顯著,P<0.01表示具有極顯著差異)。
2 結果
2.1 三疣梭子蟹HMGBa基因cDNA的克隆及其序列分析
將提取得到的三疣梭子蟹各組織總RNA, 用核酸定量儀和瓊脂糖凝膠電泳對其質量和完整性進行檢測, 結果顯示其A260/A280都在1.9—2.0, 28S、18S和5S rRNA條帶均清晰完整, 根據檢驗結果可知實驗所提總RNA質量較好, 可用于合成RACE模板。利用合成的cDNA第一鏈作為模板, 進行5′和3′末端RACE擴增。PCR產物交由公司測序, 根據已知的EST序列分析比較測序結果, 拼接得到三疣梭子蟹HMGBa基因cDNA全長序列, 利用EditSeq軟件以及BLAST分析序列后, 發現已知序列包含完整的開放閱讀框(ORF), 表明所得到的基因序列完整可靠。三疣梭子蟹HMGBa基因cDNA序列(Gen-Bank登錄號KY242487)全長1030 bp, 包含681 bp的開放閱讀框(ORF)、94 bp的5′端非編碼區(UTR)和255 bp的3′端非編碼區(UTR), 3′末端具有一個由22個腺嘌呤核苷酸組成的poly (A)尾以及一個多聚腺苷酸信號序列(Polyadenylation signal) AATAAA。
2.2 氨基酸序列分析
使用EditSeq軟件以及ExPASy預測得到三疣梭子蟹HMGBa基因cDNA序列開放閱讀框(ORF)長為681 bp, 編碼一個由227個氨基酸組成的分子量為25.82 kD, 理論等電點為5.94的蛋白。利用SMART和InterproScan對三疣梭子蟹HMGBa基因進行在線蛋白質功能結構域分析, 結果表明, 其分子內具有2個70個氨基酸左右的HMG盒子結構域, 分別為位于15—87位的A盒和位于110—180位的B盒。另外,在分子的C端還具有一個富含天冬氨酸和谷氨酸的酸性尾部結構(Acidic tail)。
2.3 同源性及系統進化分析
通過BLAST同源性比對分析, 發現三疣梭子蟹HMGBa氨基酸序列與凡納濱對蝦HMGBa基因的同源性最高為76%, 其次與凡納濱對蝦HMGBb、黑腹果蠅(Drosophila melanogaster)等昆蟲類同源性較高。
通過利用MEGA5.0軟件對三疣梭子蟹HMGBa基因進行系統進化分析, 三疣梭子蟹HMGBa基因與凡納濱對蝦HMGBa基因親緣關系最近, 其次與凡納濱對蝦HMGBb、臍橙螟(Amyelois transitella)、黑腹果蠅等無脊椎動物的親緣關系較近, 與斑馬魚(Danio rerio)、 智人(Homo sapiens)、 小家鼠(Mus musculus)等脊椎動物親緣關系較遠。由系統進化樹可以看出, 10個不同物種的HMGB家族基因明顯聚為兩個類群(圖1)。
2.4 三疣梭子蟹HMGBa基因的組織定量表達分析
利用實時熒光定量PCR技術, 以三疣梭子蟹βactin基因作為內參, 對三疣梭子蟹HMGBa基因在不同組織的表達差異情況進行分析, 結果顯示, 三疣梭子蟹HMGBa基因在各組織中均有一定表達,其中在血細胞、肝胰腺中的表達量最高, 分別為眼柄表達量的25.7和24.0倍(P<0.01), 在腸和心臟中也有相對高的表達量, 而在眼柄中的表達量最低(圖2)。
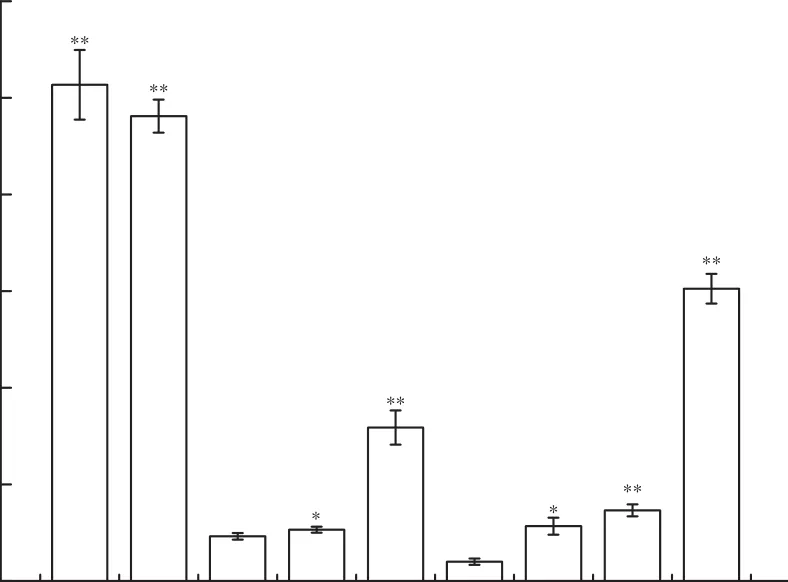
圖2 三疣梭子蟹HMGBa基因在不同組織中的表達分布狀況Fig. 2 Expression of HMGBa gene in different tissues of P.trituberculatus
2.5 病原感染對三疣梭子蟹肝胰腺、血細胞HMGBa基因mRNA表達的影響
經分析發現: 與對照組相比, 經副溶血弧菌感染12h后,PtHMGBa基因在肝胰腺中出現顯著上調(P<0.05), 且在48h表達量最高, 為對照組的4.2倍。然而在血細胞中PtHMGBa基因在6h出現表達量的峰值, 為對照組的3.5倍; 并在達到峰值后, 維持在相對高表達的水平(圖3)。經WSSV感染后,PtHMGBa基因在肝胰腺和血細胞中均在12h顯著上調(P<0.05)并且達到了表達量的峰值, 但在血細胞中的表達差異更為明顯(圖4)。
另外, 根據本實驗的結果, 與WSSV感染組相比經副溶血弧菌感染后, 三疣梭子蟹HMGBa基因的表達變化更加明顯。
3 討論
先天性免疫包括體液免疫和細胞免疫, 作為一種古老且有效的免疫防御機制, 能夠有效抵御外來病原的入侵, 誘導快速有效的免疫應答反應[16,17]。HMGB家族蛋白作為一種具有多功能的染色體結合蛋白, 在多種細胞和組織中都有較高的表達, 作為一種DNA伴侶蛋白與染色體相互作用[18], 但HMGB蛋白也可以轉運到細胞質中[19], 激活免疫系統, 誘導免疫級聯反應, 參與多種免疫炎癥反應, 清除外源病原菌等異物[20]。已有研究表明, 哺乳動物HMGB1還可以通過與Toll樣受體相互作用從而激活免疫炎癥反應[21,22]。HMGB家族基因在脊椎動物特別是哺乳動物中已經有了較為深入的研究, 但在無脊椎動物特別是甲殼動物中涉及較少, 目前僅Chen等[14]克隆得到凡納濱對蝦HMGBa、HMGBb基因, 并對其功能進行了研究。
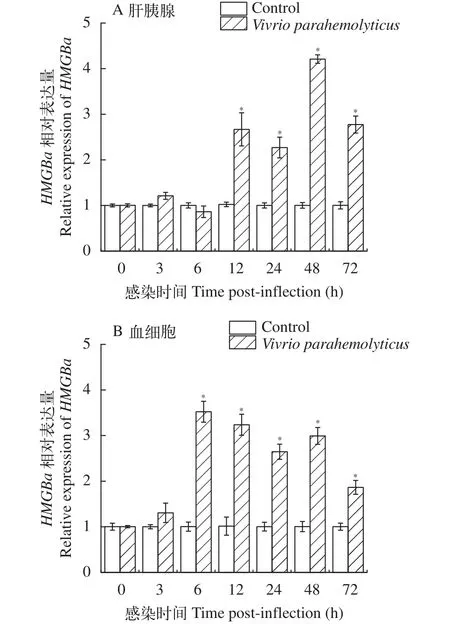
圖3 副溶血弧菌感染后三疣梭子肝胰腺和血細胞中HMGBa基因的表達差異Fig. 3 The expression of HMGBa gene in P. trituberculatus hepatopancreas and haemocytes after V. parahaemolyticus infection
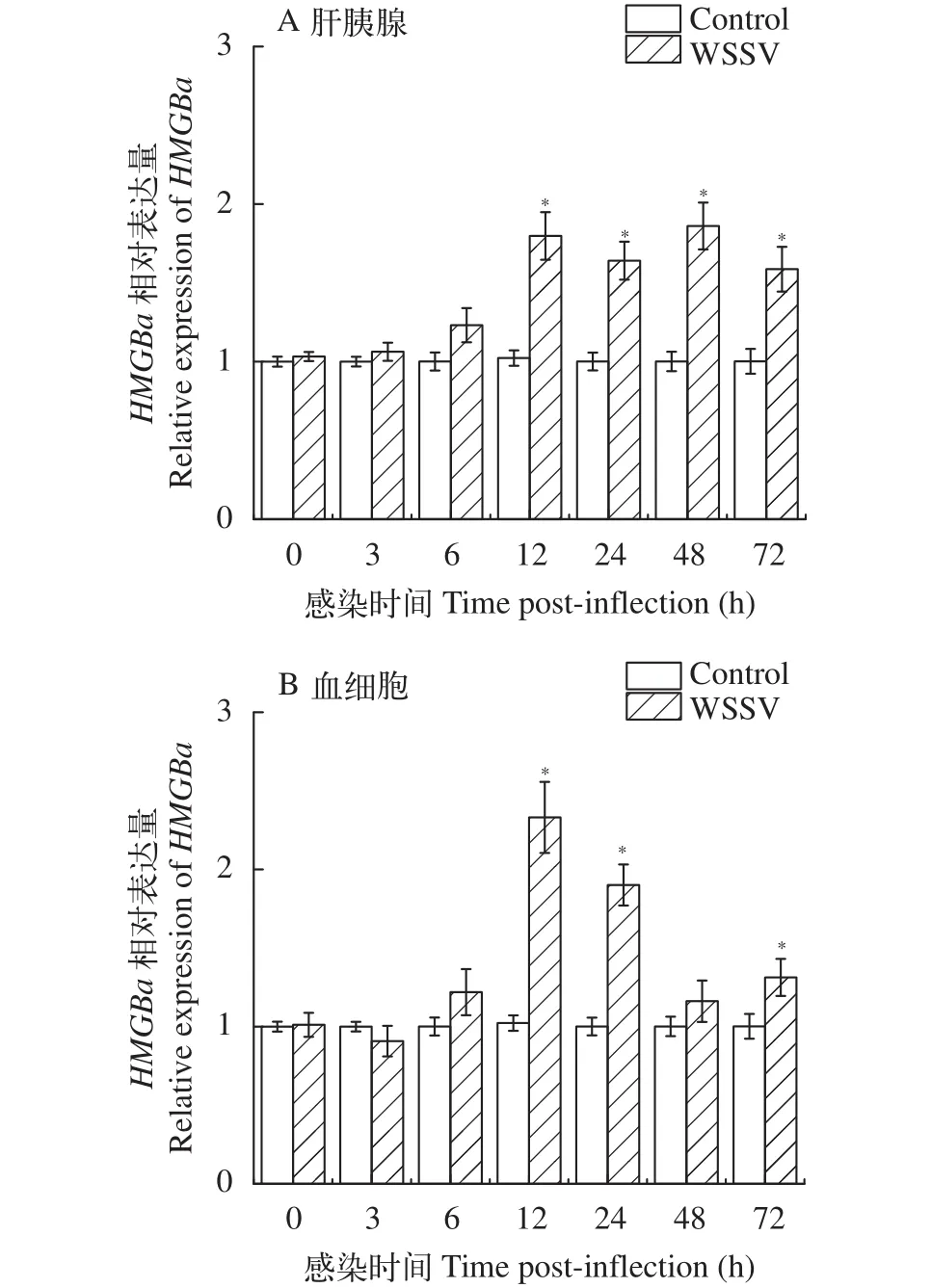
圖4 WSSV感染后三疣梭子肝胰腺和血細胞中HMGBa基因的表達差異Fig. 4 The expression levels of HMGBa gene in P. trituberculatus hepatopancreas and haemocytes after WSSV infection
本研究通過RACE技術獲得三疣梭子蟹HMGBa基因cDNA序列的全長(GenBank登錄號:KY242487)。通過與其他物種進行同源性比對發現, 三疣梭子蟹HMGBa的蛋白序列與凡納濱對蝦HMGBa序列相似度最高, 為76%。三疣梭子蟹HMGBa基因包含2個HMG盒結構, 分別為靠近蛋白N端的A盒和位于分子中部的B盒, 其中A盒由73個氨基酸組成, B盒由71個氨基酸組成, 2個盒結構具有相似的分子構象且十分保守。另外具有一個位于C端的由24個氨基酸組成的酸性尾部結構, 這與已知的HMGB家族基因結構特征一致, 已有文獻報道, C端的酸性尾部結構在HMGB家族蛋白的轉錄過程及轉運到細胞質的過程均起了重要作用[23,24]。基于以上分析, 我們認為可以確定本實驗新克隆得到的HMGBa基因是HMGB家族在三疣梭子蟹中的同源基因。
已有研究表明, 胞外的HMGB1蛋白可以調控多種免疫炎癥反應, 是一種重要的晚期炎癥介質,參與多種疾病的進程[25]。Yang等[26]克隆得到了草魚HMGB1基因, 發現草魚HMGB1蛋白可以使I型干擾素上調, 表明其在先天免疫防御中起到了重要的作用。Chen等[14]通過WSSV感染凡納濱對蝦, 利用實時熒光定量檢測LvHMGBa和LvHMGBb基因在肝胰腺中表達量的變化, 發現均出現了表達量上調的現象, 并于24h出現峰值, 分別達到了對照組的7倍和4倍。另外, 這2個基因還可與LvDorsal和LvSTAT相互作用, 從而影響凡納濱對蝦的先天免疫[14]。在本實驗中, 我們選取了副溶血弧菌和WSSV2種病原分別對三疣梭子蟹進行感染, 在感染的過程中我們發現, 隨著感染時間的延長, 梭子蟹出現了行動遲緩、不進食等現象。副溶血弧菌感染后,PtHMGBa基因在肝胰腺和血細胞中均顯著上調,分別于48h和6h達到其峰值, 達到了對照組的4.2和3.5倍; 經WSSV感染后,PtHMGBa基因在肝胰腺和血細胞中同樣的出現了表達上調的現象, 均在12h表達量最高, 分別達到了對照組的1.8和2.3倍, 這一實驗結果與Chen等[14]利用WSSV感染凡納濱對蝦得出的結果相類似。據此我們推測, 三疣梭子蟹HMGBa基因可能在機體抵御病原入侵時被誘導表達, 參與免疫炎癥反應。比較這2種病原感染后對三疣梭子蟹HMGBa基因表達量的變化, 我們發現,經副溶血弧菌感染后,PtHMGBa基因表達上調更為顯著, 特別是經WSSV感染后PtHMGBa基因在三疣梭子蟹肝胰腺中的變化相對較小。經副溶血弧菌感染后, 三疣梭子蟹的死亡時間多在6—48h, 但同期受到WSSV感染的三疣梭子蟹的死亡數量較少, 由此我們推測, WSSV在三疣梭子蟹體內的潛伏期較長, 因此PtHMGBa的表達量也相對上調幅度不大。相對于WSSV, 三疣梭子蟹對副溶血弧菌的入侵更為敏感, 能在短期內刺激PtHMGBa基因的較大量表達。
綜合以上結果得出: 三疣梭子蟹HMGBa基因的表達可被不同病原的刺激所誘導, 從而在宿主抵抗病原入侵感染的過程中發揮作用。作為先天免疫中的一種重要的調控因子, 三疣梭子蟹HMGBa基因在抵御不同病原時入侵時出現的表達量的差異原因還需要進一步探究。
[1]Shi H L, Jin C L, Lin G Z,et al. The current status ofPortunus trituberculatusculture in Zhejiang [J].Hebei Yuye, 2010, 199(7): 39—41 [史會來, 金翀略, 林桂裝,等. 浙江三疣梭子蟹養殖現狀. 河北漁業, 2010, 199(7):39—41]
[2]Gao B Q, Liu P, Li J. Analysis of the growth and breeding value ofPortunus trituberculatus‘Huangxuan No.1’[J].Journal of Fishery Sciences of China, 2015, 22(1):44—50 [高保全, 劉萍, 李健. 三疣梭子蟹‘黃選1號’生長和育種性能分析. 中國水產科學, 2015, 22(1): 44—50]
[3]Wang Z F, Wang Z Z, Xu W J,et al. Quantitaive study of lethal effect of WSSV onPortunus trituberculatusfrom mix-culture ponds of prawns and crabs [J].Chinese Journal of Oceanology and Limnology, 2008, 39(2):184—189 [王忠發, 王志錚, 許文軍, 等. 蝦蟹混養塘中WSSV對三疣梭子蟹(Portunus trituberculatus)致死效應的定量研究. 海洋與湖沼, 2008, 39(2): 184—189]
[4]Yan B L, Qin G M, Bao Z H,et al. Isolation and identification ofVibrio parahaemolyticusfrom diseasedPortunus trituberculatusL [J].Marine Science Bulletin, 2010,29(5): 560—566 [閻斌倫, 秦國民, 暴增海, 等. 三疣梭子蟹病原副溶血弧菌的分離與鑒定. 海洋通報, 2010,29(5): 560—566]
[5]Uematsu S, Akira S. Toll-Like Receptors (TLRs) and Their Ligands [J].Handbook of Experimental Pharmacology, 2008, 183(183): 1—20
[6]Bianchi M E, Agresti A. HMG proteins: dynamic players in gene regulation and differentiation [J].Current Opinion in Genetics amp; Development, 2005, 15(5): 496—506
[7]Lotze M T, Tracey K J. High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal[J].Nature Reviews Immunology, 2005, 5(4): 331—342
[8]W?h?maa H, Schierbeck H, Hreggvidsdottir H S,et al.High mobility group box protein 1 in complex with lipopolysaccharide or IL-1 promotes an increased inflammatory phenotype in synovial fibroblasts [J].Arthritis Research amp; Therapy, 2011, 13(4): 1—12
[9]Venereau E, Schiraldi M, Uguccioni M,et al. HMGB1 and leukocyte migration during trauma and sterile inflammation [J].Molecular Immunology, 2013, 55(1): 76—82
[10]Ivanov S, Dragoi A M, Wang X,et al. A novel role for HMGB1 in TLR9-mediated inflammatory responses to CpG-DNA [J].Blood, 2007, 110(6): 1970—1981
[11]Nogueira-Machado J A, Volpe C M, Veloso C A,et al.HMGB1, TLR and RAGE: a functional tripod that leads to diabetic inflammation [J].Expert Opinion on Therapeutic Targets, 2011, 15(8): 1023—1035
[12]Magna M, Pisetsky D S. The role of HMGB1 in the pathogenesis of inflammatory and autoimmune diseases[J].Molecular Medicine, 2014, 20(1): 138—146
[13]Thomas J O, Travers A A. HMG1 and 2, and related ‘architectural’ DNA-binding proteins [J].Trends in Biochemical Sciences, 2001, 26(3): 167—174
[14]Chen Y H, Jia X T, Huang X D,et al. TwoLitopenaeus vannameiHMGB proteins interact with transcription factorsLvSTATandLvDorsalto activate the promoter of white spot syndrome virus immediate-early gene ie1 [J].Molecular Immunology, 2011, 48(5): 793—799
[15]Livak K J, Schmittgen T D. Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2–ΔΔCTMethod [J].Methods, 2001, 25(4): 402—408
[16]Jiravanichpaisal P, Lee B L, S?derh?ll K. Cell-mediated immunity in arthropods: hematopoiesis, coagulation,melanization and opsonization [J].Immunobiology, 2006,211(4): 213—236
[17]Liu Y, Shi G, Cui Z,et al. PtSerpin from the swimming crabPortunus trituberculatus, a putative regulator of prophenoloxidase activation with antibacterial activity [J].Fish amp; Shellfish Immunology, 2014, 39(2): 365—371
[18]Lange S S, Vasquez K M. HMGB1: The Jack-of-all-Trades Protein is a Master DNA Repair Mechanic [J].Molecular Carcinogenesis, 2009, 48(7): 571—580
[19]Stros M. HMGB proteins: interactions with DNA and chromatin [J].Biochimica Et Biophysica Acta, 2010,1799(1—2): 101—113
[20]Yang H, Wang H C, Christopher J,et al. The cytokine activity of HMGB1 [J].Journal of Leukocyte Biology,2005, 78(1): 1—8
[21]Andersson U, Wang H, Palmblad K,et al. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes [J].Journal of Experimental Medicine, 2000, 192(4): 565—570
[22]Tadie J M, Bae H B, Jiang S,et al. HMGB1 promotes neutrophil extracellular trap formation through interactions with Toll-like receptor 4 [J].American Journal of Physiology Lung Cellular amp; Molecular Physiology, 2013,304(5): 342—349
[23]Pedersen D S, Merkle T, Marktl B,et al. Nucleocytoplasmic distribution of theArabidopsischromatin-associated HMGB2/3 and HMGB4 proteins [J].Plant Physiology,2010, 154(4): 1831—1841
[24]Zhang S, Zhong J, Yang P,et al. HMGB1, an innate alarmin, in the pathogenesis of type 1 diabetes [J].International Journal of Clinical amp; Experimental Pathology,2010, 3(3): 24—38
[25]Chen Q, Guan X, Zuo X,et al. The role of high mobility group box 1 (HMGB1) in the pathogenesis of kidney diseases [J].Acta Pharmaceutica Sinica B, 2016, 6(3):183—188
[26]Yang C, Peng L, Su J. Two HMGB1 genes from grass carpCtenopharyngodon idellamediate immune responses to viral/bacterial PAMPs and GCRV challenge[J].Developmental amp; Comparative Immunology, 2012,39(3): 133—146
CLONING OF HMGBA IN PORTUNUS TRITUBERCULATUS AND ITS EXPRESSION IN RESPONDING TO BACTERIAL AND VIRAL INFECTIONS
ZHANG Jie1,2, Lü Jian-Jian1,3, LIU Ping1,3, LI Jian1,3, WANG Zhu-Qing1,2and ZHANG Xiao-Hui1,2
(1. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China; 3. Laboratory for Marine Fisheries and Aquaculture,Qingdao National Laboratory for Marine Science and Technology,Qingdao 266071, China)
Portunus trituberculatusis an economically important aquaculture species in China. As crustacean, it is lack of adaptive immunity and can induce effective immune responses to resist pathogen relying on innate immunity.Vibrio parahemolyticusand white spot syndrome virus (WSSV) have caused significant economic damage toP. trituberculatusaquaculture. High mobility group box (HMGB) proteins are known to be involved in diverse functions in mammalian cells. In crustacean, very limited studies on HMGB proteins have been documented. To investigate the role of high mobility group box (HMGB) proteins in innate immune system ofP. trituberculatus, the HMGB homologue cDNA fromP. trituberculatus(namedPtHMGBa) was first cloned by using the technology of rapid amplification of cDNA ends (RACE) in our study. The full-length cDNA ofPtHMGBawas 1030 bp in length, which includes an open reading frame (ORF) of 681 bp, a 255 bp 3′ untranslated region and a 94 bp 5′ untranslated region. The ORF encoded a polypeptide of 227 amino acids with a predicted molecular weight of 25.82 kD. The polypeptide contained two HMG boxes domain and a C-terminal acidic tail composed of 24 rich Asp/Glu residues. The BLAST analysis showed that HMGB shared the highest homology withLitopenaeus vannameiHMCBa. The expression ofPtHMGBawas mainly distributed in the haemocytes and hepatopancreas. A weak expression was detected in the eyestalk. Quantitative Real-time PCR analysis showed thatPtHMGBatranscripts up-regulated significantly in haemocytes at 6h postV. Parahemolyticusinflection and up-regulated significantly in hepatopancreas at 48h post infection. Meanwhile,PtHMGBatranscripts significantly up-regulated in haemocytes at 12h post WSSV inflection, and the same result was observed in hepatopancreas. Our results suggested thatPtHMGBamay play important roles in innate immunity of the crab, and would provide useful information for the research of immune regulation inP. trituberculatusand other crustaceans.
Portunus trituberculatus; HMGBa; Gene cloning; Innate immune; Expression analysis
S917
A
1000-3207(2017)06-1193-07
2016-12-12;
2017-04-12
泰山領軍人才工程高效生態農業創新類計劃(LJNY2015002); 國家自然科學基金面上項目(41506186); 海洋漁業科學與食物產出過程功能實驗室開放課題(2016LMFS-A12)資助 [Supported by the Project of Taishan Scholars Leading Talent(LJNY2015002); the National Natural Science Foundation of China (41506186); Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, China (2016LMFS-A12)]
張杰(1991—), 男, 山東菏澤人; 碩士研究生; 主要從事三疣梭子蟹遺傳育種研究。E-mail: Wfire1991@163.com
劉萍, 研究員, 碩士研究生導師; E-mail: liuping@ysfri.ac.cn

