新壯態植物生長促進液對棉花枯萎病的防治作用
李云卿, 馮自力, 魏 鋒, 周京龍, 馮鴻杰, 袁 媛, 李志芳, 師勇強, 趙麗紅, 郭慶元, 朱荷琴*
(1. 新疆農業大學農學院, 烏魯木齊 830052; 2. 棉花生物學國家重點實驗室,中國農業科學院棉花研究所, 安陽 455000)
技術與應用 Technology & Application
新壯態植物生長促進液對棉花枯萎病的防治作用
李云卿1,2, 馮自力2, 魏 鋒2, 周京龍2, 馮鴻杰2, 袁 媛2, 李志芳2, 師勇強2, 趙麗紅2, 郭慶元1*, 朱荷琴2*
(1. 新疆農業大學農學院, 烏魯木齊 830052; 2. 棉花生物學國家重點實驗室,中國農業科學院棉花研究所, 安陽 455000)
2015-2016年于室內采用菌絲生長速率法、凹玻片法等方法測定新壯態對棉花枯萎病菌的抑制作用;并于河南安陽枯萎病人工病圃和溫室研究了新壯態對棉花枯萎病的防治效果。結果表明:新壯態能顯著抑制棉花枯萎病菌菌絲生長和分生孢子萌發,當新壯態濃度為10.0%時,抑制率分別為100.0%和93.1%;4.0%~8.0%的新壯態能顯著抑制枯萎病菌產孢量。0.25%和0.5%的新壯態浸種能顯著增加棉花的株高和芽長。在棉花枯萎病人工病圃,葉面噴施10.0%的新壯態稀釋液5次對棉花枯萎病的防治效果最好,達68.8%;在溫室內,用1.75%的新壯態灌根5次,防治效果達64.5%。本研究表明,在棉花枯萎病發生前用新壯態噴施或灌根對棉花枯萎病具有較好的防治效果。
新壯態; 棉花枯萎病; 防治效果; 抑菌效果
棉花枯萎病是由尖孢鐮刀菌萎蔫專化型Fusariumoxysporumf.sp.vasinfectum引起的土傳維管束病害,嚴重影響棉花的產量和纖維品質,甚至可以造成絕產[1]。棉花枯萎病菌可以在棉花整個生育期造成危害,引起的主要癥狀有黃化、黃色網紋、青枯和皺縮等[2]。除了選育抗、耐病棉花品種[3],棉花枯萎病的防治目前主要以藥劑防治為主,但藥劑的長期大量使用會導致土壤微生物群落結構單一[4]、病菌產生抗藥性、環境污染等[5-7],同時,對人類的健康構成極大的威脅[8]。利用生物有機肥不僅可以提高作物產量[9],防治病蟲害,增加土壤肥力,改善土壤酶活[10],增加土壤微生物數量及種類[9-11],補充多種微量元素[12-13]等,同時具有綠色、環保等優勢,在植物病害防治領域具有廣闊的發展前景。
沼液含有氮、磷、鉀、氨基酸、蛋白質、鈣、硼、硒、鋅、維生素、生長素、赤霉素、糖類、核酸、丁酸、乙酸、維生素B12[12-13]等多種利于植物生長的營養成分,具有促進作物生長及改善果蔬品質的功效[11,14]。目前,雞糞沼液在農業生產中主要作為葉面肥、沖施肥和滴灌肥,用于提高作物產量、改善作物品質,增強作物抗逆性等。新壯態是山東民和牧業股份有限公司生產的一種以雞糞沼液為主的有機肥。該產品能明顯提高作物產量和改善品質,在蔬菜、棉花等作物上已大面積推廣應用,但對棉花枯萎病的防治還未見相關研究。本研究以新壯態為研究對象,于枯萎病人工病圃和溫室,通過葉面噴施和灌根兩種處理方式,明確其對枯萎病的防治效果及其使用方法,并進一步研究其作用機理,為新壯態應用于棉花枯萎病防治提供技術支撐和理論依據。
1 材料與方法
1.1 材料
1.1.1 供試棉花品種及菌株
供試棉花品種為‘冀棉11’,屬于感枯萎病品種;棉花枯萎病菌Fusariumoxysporumf.sp.vasinfectum菌株由中國農業科學院棉花研究所提供。
1.1.2 供試試劑
新壯態植物生長促進液,市售,由山東民和牧業股份有限公司生產,其主要成分為雞糞沼液。
1.2 試驗方法
1.2.1 新壯態對尖孢鐮刀菌菌絲生長的影響
將新壯態按照一定比例加入到PDA培養基中,充分混勻。新壯態的終濃度分別為0.25%、0.50%、1.00%、2.00%、3.00%、4.00%、5.00%、6.00%、7.00%和10.00%。用5 mm打孔器在活化3 d的棉花枯萎病菌菌落邊緣打取菌餅,接種于含不同濃度新壯態的PDA平板中央,每個處理4個重復。接種后,將平板置于25℃培養箱中恒溫培養,3 d后采用十字交叉法測量菌落直徑,計算各處理的抑制率。
抑制率(%)=(1-處理菌落半徑/對照菌落半徑)×100。
1.2.2 新壯態對尖孢鐮刀菌產孢量的影響
將棉花枯萎病菌新鮮菌餅接種于Czapek液體培養基中,150 r/min振蕩培養7 d。將培養液用兩層滅菌的紗布在超凈工作臺中過濾獲得棉花枯萎病菌分生孢子懸浮液,備用。
將新壯態按照一定比例加入到Czapek液體培養基中,定容至25 mL,充分混勻,使新壯態的終濃度為1.00%、2.00%、4.00%、8.00%,然后分別加入100 μL的棉花枯萎病菌分生孢子懸浮液,25℃振蕩培養,4 d后用血球計數板計數,計算孢子濃度,每個處理重復3次。
1.2.3 新壯態對尖孢鐮刀菌分生孢子萌發的影響
將棉花枯萎病菌分生孢子懸浮液用滅菌的紗布三重過濾,稀釋為1×106cfu/mL。將新壯態按照一定比例加入到Czapek液體培養基中定容至1.3 mL,混勻,再加入200 μL濃度為1×106cfu/mL的孢子懸浮液充分混勻,配制成新壯態濃度為0.25%、0.50%、1.00%、2.00%、4.00%、6.00%、8.00%和10.00%的Czapek液體培養基,每個濃度重復3次。吸取20 μL的不同濃度的Czapek液體培養基于凹玻片凹槽中,將凹玻片25℃恒溫保濕培養,3 h后鏡檢孢子萌發情況,每個重復5個視野,計算孢子萌發率,以Czapek液體培養基處理作為對照,計算萌發抑制率。
1.2.4 新壯態對種子萌發及生長指標的影響
脫絨的‘冀棉11’種子消毒處理后,分別用濃度為0.25%、0.50%、1.00%的新壯態浸種8 h,再將種子均勻排列在墊有兩層濾紙的培養皿內,每個重復30粒,每個處理重復4次,置25℃恒溫培養箱中,保濕培養,3 d后統計發芽率、芽長,并種于滅菌的蛭石中,生長15 d后,分別測定其株高、根長和鮮重[18]。
1.2.5 葉面噴施新壯態對棉花枯萎病的影響
4月中旬,將‘冀棉11’播種在棉花枯萎病人工病圃內。人工病圃行長3 m,行寬0.5 m,每行留苗25~30株。棉苗子葉展開后,分別用濃度為0.25%、0.50%、1.00%、2.00%、4.00%、10.00%的新壯態稀釋液進行葉面噴施,30 mL/行,每3天1次,共5次。每處理3行,重復3次,清水噴施為對照處理。
1.2.6 新壯態灌根對棉花枯萎病的影響
采用基質接種法。將棉花枯萎病菌的玉米沙粒培養物以0.6%的質量比拌入無菌的生沙壤土中充分混合均勻,分裝到直徑6 cm、高10 cm的無底紙缽中;用50~60℃熱水浸泡‘冀棉11’種子12 h,每缽10粒均勻播種,覆蓋滅菌沙土約2~3 cm厚[15]。分別于播種后0、3、6、9、12 d,用濃度為0.25%、0.75%、1.25%、1.50%、1.75%的新壯態對棉花進行灌根處理,16 mL/缽,每6個缽為1個處理,每處理重復4次,每缽留苗5~6株,清水灌溉為對照。
將接種后的棉苗置于同一日光溫室中,隨機擺放,環境溫度控制在22~28℃,土壤相對濕度控制在60%以上,光照良好。根據實際發病情況,播種21 d左右進行病情分級調查。按5級分級標準[16-17]進行病情分級,計算病情指數和防治效果。
病情指數=[Σ(各級病株數×相應病級)/(調查總株數×4)]×100;
防治效果(%)=(對照病情指數-處理病情指數)/對照病情指數×100。
2 結果與分析
2.1 新壯態對尖孢鐮刀菌菌絲生長的抑制作用
通過菌絲生長速率法[19],對新壯態的抑菌效果進行測定。結果表明,當新壯態濃度高于0.25%時,對枯萎病菌菌絲生長具有顯著的抑制效果,抑制率為11.4%~100.0%(表1,圖1)。抑制率與濃度呈正相關,最高抑制率為100.0%。
表1新壯態對棉花枯萎病菌菌絲生長的抑制作用1)
Table1InhibitioneffectofXinzhuangtaioncolonydiametersofFusariumoxysporum

濃度/%Concentration菌落直徑/cmColonydiameter抑制率/%Inhibitionrate0.25(3.6±0.0)ab(5.5±0.7)h0.50(3.4±0.0)bc(11.4±1.1)gh1.00(3.3±0.1)cd(15.2±2.6)fg2.00(3.2±0.1)cd(16.3±2.9)fg3.00(3.0±0.1)de(20.9±1.7)ef4.00(2.9±0.0)e(25.4±0.8)e5.00(2.5±0.1)f(35.5±1.2)d6.00(1.3±0.0)g(66.8±1.0)c7.00(0.7±0.0)h(83.0±0.0)b10.00(0.0±0.0)i(100.0±0.0)aCK(3.8±0.0)a—
1) 表中數據為三次重復平均值±標準誤。同列不同的小寫字母表示在P<0.05水平上差異顯著。下表同。
Data in the table are mean±SE.Different lowercase letters in the same column indicate significant difference at 0.05 level. The same below.

圖1 不同濃度的新壯態對枯萎病菌菌絲生長的影響Fig.1 Effect of Xinzhuangtai at different doses on mycelia growth of Fusarium oxysporum
2.2 新壯態對尖孢鐮刀菌產孢的抑制作用
將棉花枯萎病菌分生孢子液在25℃恒溫搖床上暗培養96 h。結果表明:當新壯態濃度為1.00%、2.00%時,產孢量分別為15.4×107cfu/mL和12.7×107cfu/mL,與對照相比對產孢具有促進作用;當濃度為4.00%、8.00%時,產孢量分別為0.1×107cfu/mL和0 cfu/mL,對產孢具有抑制作用(表2)。說明低濃度的新壯態對棉花枯萎病菌產孢具有顯著的促進作用,高濃度新壯態對產孢具有顯著的抑制作用。
表2新壯態對棉花枯萎病菌產孢量的影響
Table2EffectofXinzhuangtaionsporeyieldofFusariumoxysporum
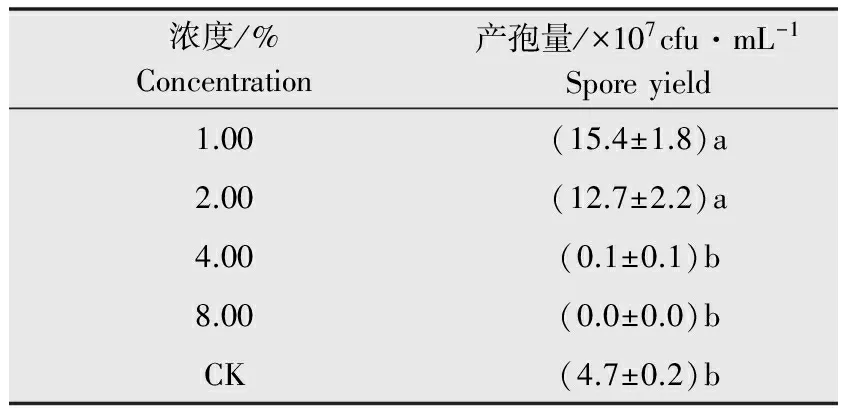
濃度/%Concentration產孢量/×107cfu·mL-1Sporeyield1.00(15.4±1.8)a2.00(12.7±2.2)a4.00(0.1±0.1)b8.00(0.0±0.0)bCK(4.7±0.2)b
2.3 新壯態對尖孢鐮刀菌分生孢子萌發的抑制作用
凹玻片法測定分生孢子萌發率,結果表明:用濃度為0.25%~10.00%的新壯態處理尖孢鐮刀菌分生孢子3 h后,孢子萌發率為6.7%~68.0%,均顯著低于對照。孢子萌發率隨著新壯態濃度升高呈下降趨勢(表3),當新壯態濃度為10.00%時,抑制率為93.1%。
2.4 新壯態浸種對棉花種子萌發及生物量的促進作用
用3個濃度梯度的新壯態浸種后,種子發芽率和根長與對照差異不顯著;0.25%和0.50%新壯態處理與對照相比株高和芽長顯著增加;0.50%和1.00%新壯態處理與對照相比鮮重顯著增加(表4)。結果表明,一定濃度的新壯態浸種對發芽率無顯著影響,對棉花部分生長指標的增加具有顯著的促進作用。
表3新壯態對棉花枯萎病菌分生孢子萌發的抑制作用
Table3InhibitoryeffectofXinzhuangtaionsporegerminationofFusariumoxysporum

濃度/%Concentration孢子萌發率/%Sporegermination抑制率/%Inhibitionrate0.25(68.0±2.0)b(29.2±2.1)c0.50(62.7±1.8)b(34.7±1.8)c1.00(62.7±0.7)b(34.7±0.7)c2.00(38.7±4.8)c(59.7±5.1)b4.00(33.3±1.8)c(65.3±1.8)b6.00(16.0±0.0)d(83.3±0.0)a8.00(7.3±3.5)d(92.4±3.7)a10.00(6.7±1.3)d(93.1±1.4)aCK(96.0±1.2)a-
表4新壯態對棉花種子發芽率和生長指標的影響
Table4EffectofXinzhuangtaionseedinggerminationrateandgrowthparametersofcotton

濃度/%Concentration發芽率/%Germinationrate株高/cmPlantheight根長/cmRootlength鮮重/gFreshweight芽長/cmShootlength0.25(97.8±2.2)a(118.6±1.6)a(13.2±0.7)a(0.8±0.1)bc(2.8±0.1)a0.50(95.6±1.1)a(125.1±1.9)a(14.5±1.3)a(1.0±0.1)a(2.6±0.1)a1.00(94.4±2.2)a(107.6±3.6)b(14.0±1.1)a(0.9±0.1)ab(2.2±0.1)bCK(96.7±1.4)a(102.9±1.9)b(13.0±0.2)a(0.7±0.1)c(2.3±0.1)b
2.5 新壯態葉面噴施對棉花枯萎病的防治效果
用0.25%~10.00%新壯態稀釋液對棉花葉片進行5次噴施處理,棉花枯萎病病情指數均顯著低于對照,且防效與濃度呈正相關(表5)。
表5新壯態葉面噴施對棉花枯萎病的防治效果
Table5ControlefficacyofXinzhuangtaioncottonFusariumwiltbyfoliagespray

濃度/%Concentration病情指數Diseaseindex防效/%Controlefficacy0.25(30.6±0.3)b(38.5±0.5)d0.50(27.0±1.2)bc(45.8±2.4)cd1.00(27.7±1.4)bc(44.3±2.7)cd2.00(24.3±1.7)cd(51.1±3.3)bc4.00(20.6±0.8)d(58.7±1.7)b10.00(15.5±1.4)e(68.8±2.8)a對照CK(49.7±0.8)a-
2.6 新壯態灌根對棉花枯萎病的防治效果
用不同濃度的新壯態對棉花進行5次灌根處理,棉花枯萎病的病情指數均顯著低于對照(表6,圖2),且防效與濃度呈正相關。
表6新壯態灌根對棉花枯萎病的防治效果
Table6ControlefficacyofXinzhuangtaioncottonFusariumwiltbyrootdrenching
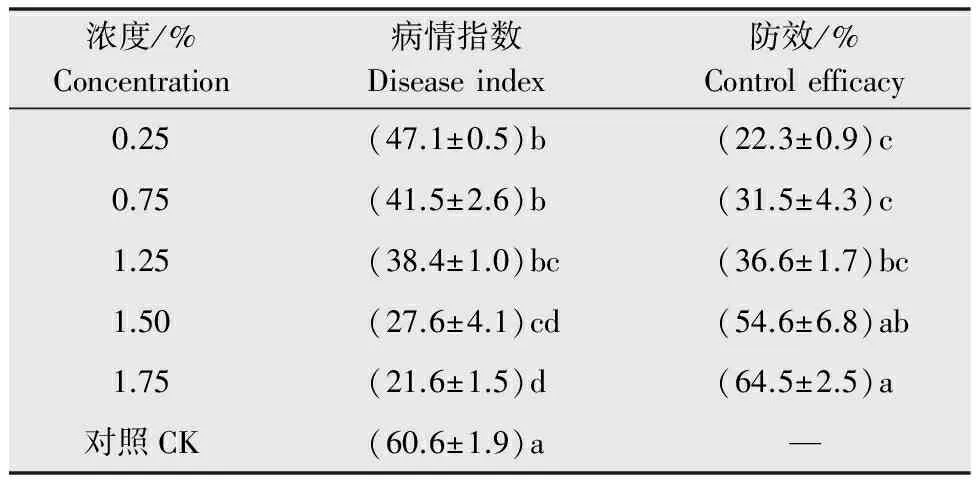
濃度/%Concentration病情指數Diseaseindex防效/%Controlefficacy0.25(47.1±0.5)b(22.3±0.9)c0.75(41.5±2.6)b(31.5±4.3)c1.25(38.4±1.0)bc(36.6±1.7)bc1.50(27.6±4.1)cd(54.6±6.8)ab1.75(21.6±1.5)d(64.5±2.5)a對照CK(60.6±1.9)a—

圖2 新壯態灌根對棉花枯萎病的影響Fig.2 Effect of Xinzhuangtai against cotton Fusarium wilt by root drenching
3 結論與討論
隨著對畜禽類需求的增加,我國已經進入了規模化、集約化養殖階段,畜禽糞便數量的大量增加導致部分地區出現不同程度的污染問題。新壯態是雞糞經過中溫厭氧發酵而成,不僅實現了廢物再利用,同時價格低廉、綠色環保,符合可持續農業發展需求。本研究在病原基數較大的病圃和溫室內進行,結果表明施用新壯態5次即可對棉花枯萎病具有顯著的防治效果。在病原基數較低的普通棉田中,可根據實際發病情況適量施用,建議噴施(1.00%~2.00%的稀釋液)或滴灌(1.25%~1.50%的稀釋液)3~4次。
枯萎病為典型的土傳病害,以孢子為主要初侵染源,因此其治理策略主要以抑制孢子萌發為主,同時提高菌絲生長抑制率及增強作物抗性。本研究表明,一定濃度的新壯態可以顯著抑制菌絲生長和孢子萌發、減少產孢量;用一定濃度的新壯態浸種對種子發芽率無顯著影響,對棉花的株高、芽長和鮮重有一定的促進作用。在新疆棉田連續使用新壯態滴灌,可能會減少土壤中孢子及菌絲含量,降低病原基數,達到可持續控制棉花枯萎病的目的。
新壯態葉面噴施或灌根對棉花枯萎病均有顯著的防治效果。該結果與Markakis等關于堆肥可以抑制黃瓜枯萎病和茄子黃萎病[20]及Pane等關于廢棄物堆肥可以抑制土傳病害絲核菌[21]的研究結果相似。
礦質元素在植物生長、光合作用等方面扮演著重要角色[22]。研究表明,礦質元素在病害發展過程中通過調節植物生理生化、形態學、解剖學等方面來增強植物對病原菌的忍耐能力和抗性,或通過影響病原菌的新陳代謝抑制病原菌侵染。例如:硝酸鹽可以通過調節檸檬酸途徑增強黃瓜對枯萎病的抗性[23];通過調節水楊酸或一氧化氮含量增強煙草對丁香假單胞桿菌的抗性[24]。新壯態是雞糞通過中溫厭氧發酵而獲得的發酵液,其主要成分為:N 1~2 g/L,P2O55~10 g/L, K2O 20~40 g/L,有機質20~50 g/L,腐殖酸5~10 g/L,微量元素Fe 3~6 g/L, pH 8.0,另外還有少量的揮發性物質如NH3、H2S、酚類等。進一步研究表明,新壯態的抑菌效果與其密封程度有關,因此,推測揮發性氣體是新壯態防治棉花枯萎病的關鍵因素之一,對其主要抑菌成分、是否具有抑菌效果之外的其他防病機制等還有待進一步研究。
[1] Mcfadden H G, Wilson I W, Chapple R M, et al. Fusarium wilt (Fusariumoxysporumf.sp.vasinfectum) genes expressed during infection of cotton (Gossypiumhirsutum) [J]. Molecular Plant Pathology, 2006, 7(2): 87-101.
[2] 李志芳, 馮自力, 趙麗紅, 等.一種棉花枯萎病抗性鑒定的新方法[J]. 中國棉花, 2013, 40(10): 15-18.
[3] 王紅梅. 中國棉花枯、黃萎病發生危害及抗病育種成效[J]. 中國農學通報, 2015, 31(15): 124-130.
[4] 孫淑清, 劉限, 姚遠, 等. 莠去津和煙嘧磺隆對玉米田土壤微生物的影響[J]. 農藥, 2014(4): 276-279.
[5] 段永蘭, 侯金麗, 邢文會. 我國微生物農藥的研究與展望[J]. 安徽農業科學, 2010, 38(8): 4135-4138.
[6] Lu Yonglong, Song Shuai, Wang Ruoshi, et al. Impacts of soil and water pollution on food safety and health risks in China[J]. Environment International, 2015, 77(1): 5-15.
[7] Lu Yonglong, Jenkins A, Ferrier R C, et al. Addressing China’s grand challenge of achieving food security while ensuring environmental sustainability[J]. Science Advances, 2015, 1(1): e1400039.
[8] 俞發榮, 李登樓. 有機磷農藥對人類健康的影響及農藥殘留檢測方法研究進展[J]. 生態科學, 2015, 34(3): 197-203.
[9] 李丙智, 王桂芳, 秦曉飛, 等. 沼液配施鉀肥對果園土壤理化特性和微生物及果實品質影響[J]. 中國農業科學, 2010, 43(22): 4671-4677.
[10] 馮偉, 管濤, 王曉宇, 等. 沼液與化肥配施對冬小麥根際土壤微生物數量和酶活性的影響[J]. 應用生態學報, 2011, 22(4): 1007-1012.
[11] 于曉東. 發酵原料對沼渣、沼液成分的影響及沼液在番茄栽培中的作用[D]. 泰安:山東農業大學,2016.
[12] 吳慧斌, 劉丁才, 許劍鋒. 沼液中化學成分的研究[J]. 天然產物研究與開發, 2015,27(1): 18-21.
[13] 宋成芳, 單勝道, 張妙仙, 等. 畜禽養殖廢棄物沼液的濃縮及其成分[J]. 農業工程學報, 2011, 27(12): 256-259.
[14] 劉紅梅, 陳娟, 魏杰, 等. 沼液對有機茶樹生長發育及其生化成分的影響[J]. 茶葉科學技術, 2014(1): 18-20.
[15] 朱荷琴,馮自力,李志芳,等.蛭石沙土無底紙缽定量蘸菌液法鑒定棉花品種(系)的抗黃萎病性[J].中國棉花,2010(12):15-17.
[16] 鄭鈜爽, 馮自力, 朱荷琴, 等. 土壤接種棉花枯萎病菌的兩種方法及適宜接種量[J]. 植物保護, 2015, 41(4): 136-138.
[17] 張蕓, 馮自力, 馮鴻杰, 等. 內生球毛殼屬真菌CEF-082對棉花黃萎病的控制作用[J]. 植物病理學報, 2016, 46(5): 697-706.
[18] 韓琴. 棉花抗黃萎病生防菌的篩選和鑒定及抗病機理研究[D]. 南京:南京農業大學,2014.
[19] 陳臻, 侯寶宏, 王衛雄, 等. 黃腐酸處理對蘋果樹腐爛病菌的抑制作用及對蘋果樹防御酶活性的影響[J]. 植物保護, 2016, 42(3): 81-86.
[20] Markakis E A, Fountoulakis M S, Daskalakis G C, et al. The suppressive effect of compost amendments onFusariumoxysporumf.sp.radicis-cucumerinumin cucumber andVerticilliumdahliaein eggplant [J].Crop Protection,2016,79:70-79.
[21] Pane C, Piccolo A, Spaccini R, et al. Agricultural waste-based composts exhibiting suppressivity to diseasescaused by the phytopathogenic soil-borne fungiRhizoctoniasolaniandSclerotiniaminor[J]. Applied Soil Ecology, 2013, 65:43-51.
[22] Datnoff L E, Elmer W H, Huber D M, et al. Mineral nutrition and plant disease [M]. St. Paul: American Phytopathological Society (APS Press), 2007.
[23] Wang Min,Sun Yuming, Gu Zechen, et al. Nitrate protects cucumber plants againstFusariumoxysporumby regulating citrate exudation [J].Plant & Cell Physiology, 2016,57(9):2001-2012.
[24] Gupta K J, Brotman Y, Segu S, et al. The form of nitrogen nutrition affects resistance againstPseudomonassyringaepv. phaseolicola in tobacco[J].Journal of Experimental Botany, 2012, 64(2): 553-568.
(責任編輯: 楊明麗)
XinzhuangtaiasaplantgrowthpromotingfluidagainstcottonFusariumwiltinGossypiumhirsutum
Li Yunqing1,2, Feng Zili2, Wei Feng2, Zhou Jinglong2, Feng Hongjie2, Yuan Yuan2, Li Zhifang2, Shi Yongqiang2, Zhao Lihong2, Guo Qingyuan1, Zhu Heqin2
(1.CollegeofAgronomy,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.StateKeyLaboratoryofCottonBiology,InstituteofCottonResearchofChineseAcademyofAgriculturalSciences,Anyang455000,China)
During 2015-2016, inhibition activities of a commercial product Xinzhuangtai toFusariumoxysporumf.sp.vasinfectumwere tested using mycelium growth rate and concave slide methods. Control efficacy of Xinzhuangtai on cotton Fusarium wilt were also investigated in the greenhouse and the artificial disease nursery, located in Anyang, Henan Province. The results showed that 10.0% Xinzhuangtai dilution could significantly inhibit the spore germination and mycelia growth, with the inhibition rates of 100.0% and 93.1%, respectively. Compared with untreated control, Xinzhuangtai dilution at the concentration ranged from 4.00% to 8.00% had significant effect on spore production. Seed-soaking with 0.25% or 0.5% Xinzhuangtai dilution could significantly promote plant height and shoot length of cotton seedling. Foliage spraying with 10.0% Xinzhuangtai dilution for 5 times in the artificial disease nursery could significantly reduce the disease index, with the control efficacy of 68.8%. Root drenching with 1.75% Xinzhuangtai dilution for 5 times in the greenhouse could significantly reduce the disease index, with the control efficacy of 64.5%. These results suggest that foliage spraying or root drenching with Xinzhuangtai can control Fusarium wilt.
Xinzhuangtai; Fusarium wilt; control efficacy; inhibitive activity
2017-02-08
2017-05-17
國家公益性行業(農業)科研專項(201503109);中央級公益性科研院所基本科研業務費專項(1610162016012)
* 通信作者 E-mail:heqinanyang@sohu.com; guoqingyuan3009@sina.com
S 435.621
B
10.3969/j.issn.0529-1542.2017.06.033

