白術兩種主要土傳病害的分離、鑒定及殺菌劑的室內活性篩選
張佳星, 徐穎菲, 徐艷芳, 戴德江, 劉亞慧, 張傳清*
(1. 浙江農林大學, 臨安 311300; 2. 浙江省農藥檢定管理所, 杭州 310020)
白術兩種主要土傳病害的分離、鑒定及殺菌劑的室內活性篩選
張佳星1, 徐穎菲1, 徐艷芳1, 戴德江2, 劉亞慧1, 張傳清1*
(1. 浙江農林大學, 臨安 311300; 2. 浙江省農藥檢定管理所, 杭州 310020)
立枯病和白絹病是白術生產種植中的兩種主要土傳病害,在苗期和生長期都有發生,危害嚴重。本研究從浙江省磐安縣采集具有典型病癥的白術植株,對病原進行了分離、純化和致病性測定。綜合形態學特征及rDNA-ITS序列分析表明,白術上的病害是由立枯絲核菌RhizoctoniasolaniKühn引起的立枯病和由齊整小核菌SclerotiumrolfsiiSacc.引起的白絹病。室內毒力測定結果表明,10種供試殺菌劑對立枯病菌的毒力從大到小為:噻呋酰胺>咯菌腈>戊唑醇>四氟醚唑>吡唑醚菌酯>丙硫菌唑>嘧菌酯>啶酰菌胺>苯醚甲環唑>咪鮮胺;對白絹病菌的室內毒力從大到小為:吡唑醚菌酯>噻呋酰胺>嘧菌酯>戊唑醇>咯菌腈>苯醚甲環唑>丙硫菌唑>啶酰菌胺>四氟醚唑>咪鮮胺,其中噻呋酰胺對兩種病菌都具有很高的活性,EC50分別為0.06和0.03 mg/L,可用于兩種病害的防治。
白術; 立枯病; 白絹病; 立枯絲核菌; 齊整小核菌
白術AtractylodesmacrocephalaKoidz.,別名浙術、蒼術等,屬于菊科蒼術屬多年生草本植物,是“參、術、苓、甘”四大名貴藥材之一,也是浙江省主產的道地藥材[1]。
近年來,由于白術出口和國內需求量越來越大,其種植面積不斷擴大,輪作周期逐漸縮短,導致白術病蟲害逐年加重[2]。立枯病(sheath blight)多于植株幼苗期危害其根莖部,導致根莖部產生暗褐色凹陷病斑。發病初期常可見植株在陽光下全株萎蔫,入夜后恢復正常。當病斑環繞莖部一周后,莖部縊縮死亡。病原也可侵染近地面葉片,感病葉片上產生深褐色水漬狀大病斑,并快速腐爛死亡。在高溫高濕環境中,病部生長出大量的褐色蛛絲狀菌絲,并產生大量土粒狀褐色菌核。白絹病(southern blight)[3-4]又名白霉病,可侵染100多科210多種植物。該病通常危害成株期植株根部和莖基部,莖部發病后,產生深褐色、不規則的水漬狀病斑,向上蔓延導致葉片變黃枯死,向下蔓延導致根部表皮褐變腐爛,最終全株萎蔫枯死,根莖僅剩下纖維組織,很容易從土中被拔出。如環境高溫潮濕[5],病情發展更加迅速,病斑處可長出大量絹絲狀白色菌絲體,纏繞近地面葉片并向周圍土壤蔓延,產生大量油菜籽狀的茶褐色菌核。
目前國內外對白術病害的研究主要側重田間病害調查和藥劑防治方面,對病原的研究較少或是為較早期的研究。如,對白術鐵葉病病原的研究還停留在20世紀70年代[6];白術根腐病病原是由多種鐮刀菌屬真菌引起的,對其癥狀描述也大相徑庭[2,7-9];對白術病害命名未有統一的規范,常出現“一病多名,一名多病”現象,這給病害的防治造成了嚴重的阻礙。因此,本文對白術生產中的兩種重要土傳病害病原進行分離、鑒定,并進行多種殺菌劑的室內毒力測定,目的在于為病害防治提供科學指導。
1 材料與方法
1.1 病樣的采集及病原菌的分離
于浙江省金華市磐安縣采集具明顯病癥的白術樣本,用干凈的牛皮紙袋密封保存,帶回實驗室進行病原菌的分離。白術立枯病取病健交界處組織,用75%乙醇浸泡1 min,再用1.5%的次氯酸鈉溶液消毒1 min,75%乙醇漂洗1 min,最后用無菌水漂洗4次,用無菌濾紙將水分吸干后切成0.5 cm2小塊,置于PDA表面,在25℃恒溫培養箱中黑暗培養。待有菌絲長出后,挑取菌落邊緣瓊脂塊到新的平板上進行純化培養,并于4℃保存備用。白術白絹病直接挑取病株表面油菜籽狀的菌核進行滅菌,分離,純化,保存。
1.2 病原菌致病性測定
白術塊根經表面滅菌后埋于濕潤的無菌基質中,置于溫室中培養,定期澆水,待植株高度達到20 cm,進行致病性試驗。從分離獲得的病原真菌中選取兩株代表菌株進行活化,接于PDA培養基上培養,同時在培養基上放置一根無菌牙簽。培養5 d后,將牙簽長有菌絲的一端插至白術離地2 cm處的莖基部,以未做處理的無菌牙簽作為對照,每個處理重復4次,放于人工氣候箱中(28℃,L∥D=12 h∥12 h,相對濕度85%),兩種病害進行相同處理。定期觀察植株發病情況,并做好記錄,對發病植株進行再分離、純化、保存,與首次分離的病原菌進行比對。
1.3 病原菌的形態學特征觀察
將兩種病原菌的純化菌株于25℃恒溫培養箱中的PDA培養基上培養,觀察菌落形態特征。在顯微鏡下測量菌絲和菌核大小,并使用Giemsa染料對菌絲細胞進行染色,觀察并記錄細胞核數量,總結兩種病原菌形態特征進行形態學鑒定。
1.4 病原菌的rDNA-ITS 序列擴增及分析
取生長在PDA培養基表面的病原菌菌絲,用真菌基因組DNA快速抽提試劑盒提取基因組DNA。用核糖體內轉錄間隔區(rDNA-ITS)序列通用引物ITS-1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS-4(5′-TCCTCCGCTTATTGATATGC-3′)進行PCR擴增。采用50 μL擴增體系,包括酶2 U、引物0.8 μmol/L、病原菌DNA 1 μL。反應條件為95℃預變性2 min;95℃變性30 s,55℃退火30 s,72℃延伸40 s,35個循環;然后72℃延伸10 min。產物于4℃保存。擴增產物經瓊脂糖凝膠電泳后用SanPrep柱式DNA膠回收試劑盒回收目標DNA片段,送往生工生物工程股份有限公司進行測序。利用BLAST軟件在GenBank數據庫中對測序結果進行比對分析。
1.5 供試殺菌劑
使用的殺菌劑均為原藥,包括97.6%戊唑醇(tebuconazole)、96%噻呋酰胺(thifluzamide)、95%咯菌腈(fludioxonil)、95%咪鮮胺(prochloraz)、96%苯醚甲環唑(difenoconazole)、95%啶酰菌胺(boscalid)、96%嘧菌酯(azoxystrobin)、96%丙硫菌唑(prothioconazole)、99%四氟醚唑(tetraconazole)和97%吡唑醚菌酯(pyraclostrobin)。
1.6 殺菌劑對兩種病原菌菌絲的室內毒力測定
將上述殺菌劑母液與PDA按照一定的比例混合,其中嘧菌酯和吡唑嘧菌酯兩種殺菌劑需要加50 mg/L SHAM,終濃度設置見表1。將4℃保存的菌株活化后,再次轉接,至菌落長至9 cm培養皿的三分之二后用5 mm直徑打孔器在同一圓周上打取生長狀態一致的菌餅,接于不同濃度梯度的PDA培養皿中心,以空白PDA培養皿作為對照,每處理3次重復。將培養皿放于25℃培養箱中進行培養,待空白處理菌落直徑大于6 cm后使用十字交叉法測量,記錄數據,計算抑制率。公式為:生長抑制率(%)=(對照菌落直徑-藥劑處理菌落直徑)/(對照菌落直徑-0.5)×100。數據結果使用SPSS統計軟件分析,求得各藥劑的毒力回歸方程、EC50以及相關系數。
表1殺菌劑的室內毒力測定濃度
Table1Concentrationoffungicidesfortoxicitymeasurement
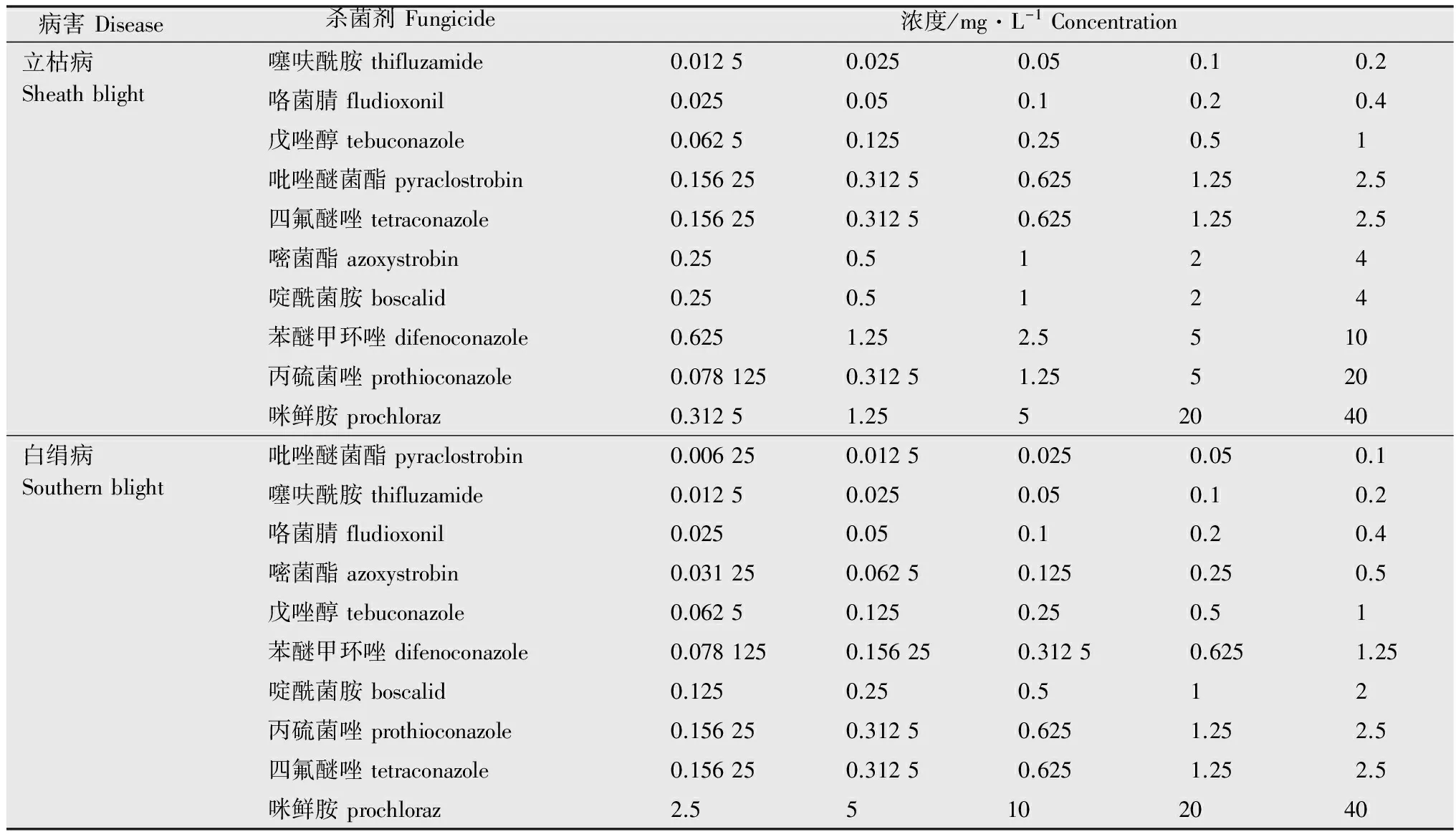
病害Disease殺菌劑Fungicide濃度/mg·L-1Concentration立枯病Sheathblight噻呋酰胺thifluzamide0.01250.0250.050.10.2咯菌腈fludioxonil0.0250.050.10.20.4戊唑醇tebuconazole0.06250.1250.250.51吡唑醚菌酯pyraclostrobin0.156250.31250.6251.252.5四氟醚唑tetraconazole0.156250.31250.6251.252.5嘧菌酯azoxystrobin0.250.5124啶酰菌胺boscalid0.250.5124苯醚甲環唑difenoconazole0.6251.252.5510丙硫菌唑prothioconazole0.0781250.31251.25520咪鮮胺prochloraz0.31251.2552040白絹病Southernblight吡唑醚菌酯pyraclostrobin0.006250.01250.0250.050.1噻呋酰胺thifluzamide0.01250.0250.050.10.2咯菌腈fludioxonil0.0250.050.10.20.4嘧菌酯azoxystrobin0.031250.06250.1250.250.5戊唑醇tebuconazole0.06250.1250.250.51苯醚甲環唑difenoconazole0.0781250.156250.31250.6251.25啶酰菌胺boscalid0.1250.250.512丙硫菌唑prothioconazole0.156250.31250.6251.252.5四氟醚唑tetraconazole0.156250.31250.6251.252.5咪鮮胺prochloraz2.55102040
2 結果與分析
2.1 病原菌分離及致病性測定
從磐安采集的植株病樣中分離得到兩種病害病原真菌,以BZLK1、BZLK2和BZBJ1、BZBJ2作為兩種病害的代表菌株,進行致病性試驗。結果顯示:健康白術在接種BZLK1和BZLK2 5 d后,莖基部出現水漬狀暗褐色病斑,病斑環莖蔓延。20 d后植株整體表現萎蔫,頂部葉片下垂干枯,近地面葉片出現大面積黑褐色病斑,莖基部縊縮,表皮都為黑褐色病斑,黏附有土粒狀深褐色菌核。
白術在接BZBJ1和BZBJ2 5 d后,莖基部傷口開始發病,隨著病情發展,莖基部出現水漬狀、暗褐色、不規則病斑,近地面葉片黃化萎蔫。20 d后,莖基部和近地面葉片被白色絹絲狀菌絲纏繞,植株可從基質中輕易拔起,葉片、莖部和土層中可見大量油菜籽狀茶褐色菌核。插有無菌牙簽的對照未有病變癥狀。將病變組織再次進行分離、純化,得到與BZLK1、BZLK2和BZBJ1、BZBJ2相同的病原真菌。
2.2 病原菌的菌落和形態學特征
立枯病病原菌BZLK1菌絲在PDA上以匍匐狀向四周生長,有環狀輪紋,生長快,3 d左右可長滿9 cm培養基,6 d后菌絲由淡黃色向褐色轉變,9 d后轉變為深褐色,產生菌核(圖1a~b)。在顯微鏡下觀察發現菌絲分支角度較大,且有縊縮,菌絲直徑(5.77~ 6.99)μm,用Giemsa染料對菌絲細胞染色后發現胞內有多個細胞核(圖1c)。病原菌 BZLK2具有相似的形態特征。
白絹病病原菌BZBJ1 菌絲為白色,向四周以輻射狀生長,氣生菌絲較多,生長快,3 d左右可長滿9 cm PDA培養皿,菌絲直徑為(6.40~7.36)μm。5 d后菌絲纏繞,在菌落表面出現大量乳白色細小菌核,9 d后菌核顏色變為茶褐色,表面光滑,不與菌絲相連,呈近球形或橢球形(圖1d~f),大小為(1.45~1.76)mm×(1.29~1.61)mm。病原菌 BZBJ2具有相似的形態特征。
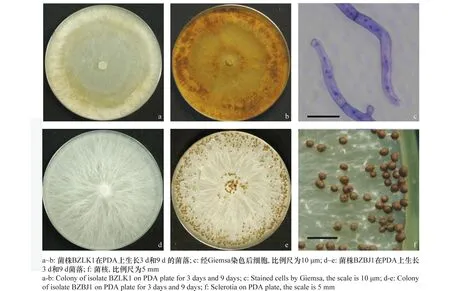
圖1 病原菌BZLK1和BZBJ1在PDA上的菌落形態Fig.1 Morphological characters of pathogens BZLK1 and BZBJ1 on PDA plate
2.3 病原菌rDNA-ITS序列擴增及分析
以白術立枯病和白絹病兩種病害的基因組DNA作為模板,以ITS序列通用引物進行PCR擴增,分別得到700 bp和650 bp長度的DNA片段。測序結果經BLAST軟件在GenBank數據庫中進行同源性比較,結果顯示與立枯絲核菌R.solani和齊整小核菌S.rolfsii的相似率最高,選取相關菌株的ITS序列,使用MEGA 6.06軟件鄰接法構建系統進化樹(圖2)。
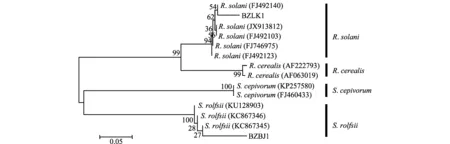
圖2 基于兩種病原菌及相關真菌ITS序列構建的系統進化樹Fig.2 Phylogenetic trees between two pathogens and other fungi based on ITS nucleotide sequences
2.4 殺菌劑的室內毒力
10種殺菌劑對立枯絲核菌的毒力測定結果表明:咪鮮胺對絲核菌的毒力最低,噻呋酰胺和咯菌腈的毒力最高,其毒力為咪鮮胺的222倍;戊唑醇、四氟醚唑、吡唑醚菌酯和丙硫菌唑的毒力為咪鮮胺的13~40倍;其他3種殺菌劑嘧菌酯、啶酰菌胺、苯醚甲環唑相對于咪鮮胺的相對毒力倍數均小于等于10(表2)。
10種殺菌劑對齊整小核菌的毒力測定結果表明:咪鮮胺的毒力最低,吡唑醚菌酯、噻呋酰胺和嘧菌酯毒力較高,其毒力分別為咪鮮胺的582、388和106倍(表3)。戊唑醇、咯菌腈、苯醚甲環唑、丙硫菌唑、啶酰菌胺和四氟醚唑的毒力為咪鮮胺的24~89倍。
表210種殺菌劑對立枯絲核菌的室內毒力
Table2Toxicityof10fungicidesagainstRhizoctoniasolani

殺菌劑FungicideEC50/mg·L-1毒力回歸方程Toxicityequation相關系數(r)Correlationcoefficient相對毒力Relativetoxicity噻呋酰胺thifluzamide0.06y=0.9865x+0.44540.9988222咯菌腈fludioxonil0.06y=5.3676x+0.20290.9991222戊唑醇tebuconazole0.33y=0.4611x+0.34800.999140四氟醚唑tetraconazole0.65y=0.1865x+0.37870.995220吡唑醚菌酯pyraclostrobin0.90y=0.2623x+0.26360.994315丙硫菌唑prothioconazole1.02y=0.0756x+0.42300.990813嘧菌酯azoxystrobin1.38y=0.2522x+0.15270.979610啶酰菌胺boscalid1.41y=0.0371x+0.44770.99659苯醚甲環唑difenoconazole2.69y=0.0220x+0.44090.99485咪鮮胺prochloraz13.29y=0.0184x+0.25550.98741
表310種殺菌劑對齊整小核菌的室內毒力測定
Table3Toxicitytestof10fungicidesagainstSclerotiumrolfsii
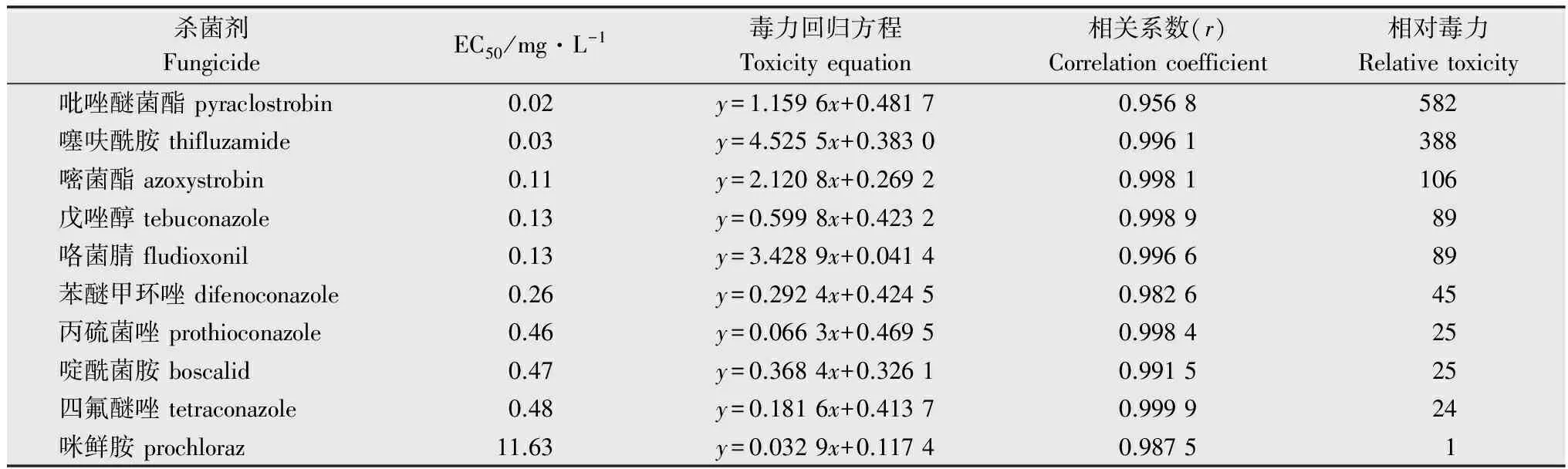
殺菌劑FungicideEC50/mg·L-1毒力回歸方程Toxicityequation相關系數(r)Correlationcoefficient相對毒力Relativetoxicity吡唑醚菌酯pyraclostrobin0.02y=1.1596x+0.48170.9568582噻呋酰胺thifluzamide0.03y=4.5255x+0.38300.9961388嘧菌酯azoxystrobin0.11y=2.1208x+0.26920.9981106戊唑醇tebuconazole0.13y=0.5998x+0.42320.998989咯菌腈fludioxonil0.13y=3.4289x+0.04140.996689苯醚甲環唑difenoconazole0.26y=0.2924x+0.42450.982645丙硫菌唑prothioconazole0.46y=0.0663x+0.46950.998425啶酰菌胺boscalid0.47y=0.3684x+0.32610.991525四氟醚唑tetraconazole0.48y=0.1816x+0.41370.999924咪鮮胺prochloraz11.63y=0.0329x+0.11740.98751
3 結論與討論
本研究對從磐安縣采集的具有白術立枯病和白絹病典型病癥的植株進行病原菌的分離、純化和致病性研究,并利用病菌形態學特征觀察、rDNA-ITS序列分析明確了磐安縣白術的兩種土傳病害是由立枯絲核菌R.solani引起的立枯病和由齊整小核菌S.rolfsii引起的白絹病。兩種病害都為典型的土傳病害,高溫高濕環境更易發生,可造成大面積植株干枯萎蔫和死亡[5,10]。
潘蘭蘭等[5]及黃力剛[11]報道白術立枯病病原菌為立枯絲核菌R.solani,但未做分離、鑒定和致病性試驗。沈立榮等[13]將湖南產區白術紋枯病病原鑒定為齊整小核菌S.rolfsii,病原與本文一致,但病狀與本文研究的白術立枯病不同,湖南產區的白術紋枯病發病較晚,常于開花結實期發病,常見云紋狀病斑,病斑后期為灰白色,表皮易脫落只留下葉脈,這可能與不同產地氣候條件和白術品種的差異有關。李小霞等[3]和胡瓊波[14]分別研究了貴州、湖南兩地白術白絹病,并將其病原鑒定為齊整小核菌S.rolfsii,其病害病癥相似,與本研究結果一致。
隨著白術市場的擴大,野生資源的枯竭,大面積密植的人工栽培模式被廣泛推廣。從野生到人工栽培環境的變化,溫濕度提高,空氣不流通,連年種植,導致立枯病和白絹病嚴重發生。張璨[15]報道噻呋酰胺對立枯病病菌的室內毒力較高,高于苯醚甲環唑和咪鮮胺,與本文一致。Grichar[16-17]等的試驗表明戊唑醇對白絹病菌防治效果顯著,與本文的室內毒力測定結果一致。本研究結果表明吡唑醚菌酯與噻呋酰胺對白絹病的毒力優于戊唑醇,可進行田間試驗。此外,噻呋酰胺和吡唑醚菌酯對立枯絲核菌及齊整小核菌的室內毒力都較高,可用于同時防治兩種病害,減少藥劑的噴灑次數和用量。對噻呋酰胺和吡唑嘧菌酯的田間防治效果將進一步研究。
[1] 施時貴. 磐安白術[J]. 中國地名, 2005(2): 64.
[2] 檀國印, 楊志玲, 袁志林, 等. 白術真菌病害的分離鑒定[J]. 浙江農業學報, 2013(5): 1050-1055.
[3] 李小霞, 肖仲久, 李黛, 等. 白術白絹病病原菌的分子鑒定[J]. 貴州農業科學, 2011(12): 126-128.
[4] 魯鵬, 肖仲久, 李小霞, 等. 白術白絹病菌的生物學特性及殺菌劑對其室內毒力測定[J]. 貴州農業科學, 2010(8): 90-93.
[5] 潘蘭蘭, 鄭永利, 呂先真. 白術主要病害的發生及綜合治理[J]. 浙江農業科學, 2006(3): 315-318.
[6] 俞永信. 白術鐵葉病初步研究[J]. 浙江農業科學, 1974(1): 39-42.
[7] 臧少先, 安信伯, 石麗軍, 等. 白術根腐病癥狀類型及病原鑒定[J]. 河北農業大學學報, 2005(3): 73-76.
[8] 張禮維. 貴州白術根腐病病原鑒定及防治研究[D]. 貴陽: 貴州大學, 2015.
[9] 劉凡. 白術根腐病病原鑒定、生物學特性和防治研究[D]. 雅安: 四川農業大學, 2012.
[10] 桑維鈞, 練啟仙, 宋寶安, 等. 貴州省白術真菌病害種類調查及防治[J]. 貴州農業科學, 2006(3): 40-41.
[11] 黃力剛. 白術主要病害的發生與防治[J]. 現代農業科技, 2005(2): 19-20.
[12] 宋濤. 藥用植物白術主要病害的綜合防治[J]. 吉林農業, 2015(9): 96.
[13] 沈立榮, 龐阿土, 陳集雙. 白術紋枯病研究初報[J]. 植物保護, 1993,19(3): 28-29.
[14] 胡瓊波. 白術白絹病發生規律與防治研究[D]. 長沙: 湖南農業大學, 2002.
[15] 張璨. 幾種殺菌劑對西藏設施蔬菜立枯病菌的室內毒力測定[C]∥中國植物病理學會. 中國植物病理學會2012年學術年會論文集, 2012: 492.
[16] Grichar W J. Management of stem rot of peanuts (Arachishypogaea) caused bySclerotiumrolfsiiwith fungicides [J]. Crop Protection, 1995, 14(2): 111-115.
[17] 張獻強, 黎起秦, 甘啟范, 等. 防治茉莉白絹病的藥劑篩選研究[J]. 安徽農業科學, 2010(10): 5152-5154.
(責任編輯: 楊明麗)
Isolationandidentificationoftwomainsoil-bornepathogensonAtractylodesmacrocephalaandscreeningoffungicidesinvitro
Zhang Jiaxing1, Xu Yingfei1, Xu Yanfang1, Dai Dejiang2, Liu Yahui1, Zhang Chuanqing1
(1.ZhejiangAgricultureandForestryUniversity,Lin’an311300,China; 2.InstitutefortheControlofAgrochemicalsinZhejiangProvince,Hangzhou310020,China)
The sheath blight and southern blight are two major soil-borne diseases in the cultivation ofAtractylodesmacrocephala, which occur severely during seedling and growing periods. In this study, we collectedAtractylodesplants with typical symptoms from Pan’an County, Zhejiang Province, and determined the pathogens through isolation, purification and pathogenicity tests. Morphology characteristics and rDNA-ITS sequence analysis indicated that the pathogens wereRhizoctoniasolanifor sheath blight disease andSclerotiumrolfsiifor southern blight disease, respectively. Indoor toxicity tests demonstrated that the bioactivity againstR.solaniwere: thifluzamide > fludioxonil > tebuconazole > tetraconazole > pyraclostrobin > prothioconazole > azoxystrobin > boscalid > difenoconazole > prochloraz, and the bioactivity againstS.rolfsiiwere: pyraclostrobin > thifluzamide > azoxystrobin > tebuconazole > fludioxonil > difenoconazole > prothioconazole > boscalid > tetraconazole > prochloraz. Among them, thifluzamide was most effective to both pathogens, with EC50values of 0.06 and 0.03 mg/L, respectively.
Atractylodesmacrocephala; sheath blight; southern blight;Rhizoctoniasolani;Sclerotiumrolfsii
2017-03-22
2017-04-21
浙江省“三農六方”項目;浙江公益技術應用研究計劃(2016C32002)
* 通信作者 E-mail: cqzhang@zafu.edu.cn
S 482.2
A
10.3969/j.issn.0529-1542.2017.06.031

