MHC-Ⅰ類分子抗原遞呈與病毒免疫逃逸
劉 瑩 ,王團結,吳思捷,趙俊杰,康 凱,萬建青,姚文生
(中國獸醫藥品監察所,北京 100081)
MHC-Ⅰ類分子抗原遞呈與病毒免疫逃逸
劉 瑩 ,王團結,吳思捷,趙俊杰,康 凱,萬建青,姚文生*
(中國獸醫藥品監察所,北京 100081)
闡述主要組織相容性復合體(MHC)Ⅰ類分子遞呈抗原過程,分析病毒干擾MHC-Ⅰ類分子抗原遞呈所采取的策略,以期揭示病毒的免疫逃逸機制,為病毒疫苗的研制提供一定的思路。
主要組織相容性復合體Ⅰ類分子;抗原遞呈;病毒;免疫逃逸
主要組織相容性復合體(major histocompatibility complex,MHC)是一個與機體免疫反應密切相關的基因群,最早發現于不同動物間對移植物的排斥反應。MHC-Ⅰ類分子是一條由MHC-Ⅰ基因編碼的重鏈(Heavy chain,HC)和一條由非MHC基因編碼的β2微球蛋白(β-2-microglobulin,β2m)通過二硫鍵構成的異源二聚體,在機體內所有有核細胞及血小板的表面均有表達,是機體細胞免疫應答過程中最重要的“橋梁”分子,其免疫功能是將內源性抗原遞呈給CD8+T細胞,從而激活細胞毒性T淋巴細胞(cytotoxic lymphocyte,CTL)。CTL是機體細胞免疫中重要的效應細胞,病毒特異性CTL可以殺傷病毒感染的靶細胞,但其殺傷效應受MHC分子限制。病毒是嚴格的細胞內寄生微生物,機體在清除細胞內寄生的病毒過程中,細胞免疫發揮著極其重要的作用。而病毒在長期進化中,也獲得了很多對抗宿主免疫的手段和機制,以確保其能夠持續存活,這種現象通常稱為免疫逃逸。抑制感染細胞MHC-Ⅰ類分子對其抗原的遞呈,逃避CTL的識別和殺傷,是其實現免疫逃逸的一個重要策略。分析MHC-Ⅰ類分子抗原遞呈與病毒免疫逃逸的關系,有助于揭示病毒的免疫逃逸機制,從而為病毒疫苗的研制提供一定的思路。
1 MHC-Ⅰ類分子抗原遞呈過程
MHC-Ⅰ類分子遞呈內源性抗原的過程主要包括三個階段:抗原肽段的產生、抗原肽段由胞質向內質網的轉運、肽段與MHC-Ⅰ類分子的組裝(圖1)。
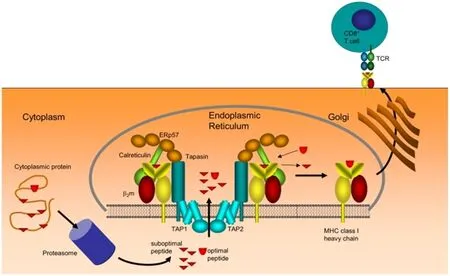
圖1 MHC-Ⅰ類分子抗原遞呈過程[1]Fig 1 The process of MHC class I antigen presentation
1.1 由蛋白酶體水解產生肽段 細胞內一切異常的蛋白,如一些變性的、錯誤折疊的蛋白質以及腫瘤抗原、病毒感染細胞表達的病毒抗原、胞內寄生菌(蟲)表達的抗原、基因工程細胞內表達的抗原都會受到降解。通常有一小分子的泛素(ubiquitin)附著在這些被蛋白水解酶靶定的蛋白質上,通過蛋白酶體降解[2]。蛋白質靶肽鏈在蛋白酶體的作用下首先去折疊(unfolding),然后泛素得到釋放,通過蛋白酶體中央隧道后的蛋白質被降解成肽段,最終產生大量的小肽(8~10個氨基酸)[3]。
1.2 肽段由胞質向內質網的轉運 胞質中產生的抗原肽轉運到內質網的過程中,抗原加工相關轉運體(transporter associated with antigen processing,TAP)發揮著主要作用[4]。TAP是由TAPl和TAP2兩種蛋白組成的一種跨膜的異二聚體。TAP專門轉運與MHC-Ⅰ類分子結合的肽段,因為8~10個氨基酸肽段與TAP的親和性最高,這一長度的肽也最適宜與MHC-Ⅰ類分子結合。此外,ERp57和TAP相關蛋白tapasin(TAP-associated protein)等伴侶分子也參與到了抗原肽從胞質轉運到內質網的過程中[5]。
1.3 肽段與MHC-Ⅰ類分子的組裝 MHC-Ⅰ類分子的HC和β2m在內質網的多聚核糖體上合成后,在伴侶分子的參與下組裝成穩定的MHC-Ⅰ類分子。其中,鈣聯蛋白(calnexin)是參與MHC-Ⅰ類分子組裝的主要伴侶分子,它是內質網中的一種固有膜蛋白,可以促進多肽鏈的折疊[6]。鈣聯蛋白解離后,MHC-Ⅰ類分子與伴侶分子鈣網蛋白(calreticulin)結合,進行進一步的折疊組裝[7]。當tapasin把TAP轉運到MHC-Ⅰ類分子附近時,MHC-Ⅰ類分子能夠捕獲TAP轉運的短肽,而未能被捕獲的短肽將被迅速降解[8]。在內質網中,與抗原肽結合的MHC-Ⅰ類分子通過內質網的特殊通道離開,并經過高爾基體表達到細胞表面,從而激活CD8+T細胞(圖1),殺傷被感染細胞。然而,沒有與抗原肽結合的MHC-Ⅰ類分子則通過內質網的另一種通道離開,然后被很快降解,或者短暫地表達在細胞表面而通過內化被降解或回收[9]。
2 病毒干擾MHC-Ⅰ類分子抗原遞呈機制
鑒于MHC-Ⅰ類分子抗原遞呈是CTL識別和殺傷病毒感染細胞的重要前提,許多病毒采用不同的策略來干擾MHC-Ⅰ類分子抗原遞呈過程。
2.1 抑制抗原肽的產生 抗原肽的產生需要蛋白酶體的參與,而有的病毒能夠產生抵抗蛋白酶體降解的蛋白。例如四型人類皰疹病毒(Epstein-Barr virus,EBV)的EBNA-1蛋白N端具有238個氨基酸長度的甘氨酸和丙氨酸的重復序列(GAr),能夠抵抗蛋白酶體的降解作用[10]。此外,蛋白酶體對抗原肽C末端的剪切對于CTL的識別起到關鍵性的作用。Beekman[11]等人的研究發現,能夠識別Moloney型鼠白血病病毒(Moloney murine leukemia virus,Mo-MLV)抗原肽SSWDFITV表位的CTL可以識別Mo-MLV誘導的腫瘤細胞,但是這種CTL并不能識別Friend型鼠白血病病毒(Friend murine leukemia virus,Fr-MLV)誘導的腫瘤細胞。進一步的研究表明,Fr-MLV的潛在表位與Mo-MLV的SSWDFITV表位只有一個氨基酸的不同,正是這一個氨基酸的變化,破壞了抗原肽C末端的錨定序列,從而不能被蛋白酶體正確地降解成目的抗原肽。Gilbert[12]等人的研究發現,人巨細胞病毒(Human cytomegalovirus,HCMV)的磷蛋白65(pp65),具有絲氨酸/蘇氨酸蛋白激酶的活性,能夠特異性的磷酸化此病毒的IE-1蛋白,從而抵御蛋白酶體的降解。另一方面,HIV的Tat蛋白能夠結合蛋白酶體,并抑制蛋白酶體的活性[13]。
2.2 干擾抗原肽的轉運
2.2.1 干擾TAP的功能 在細胞質中經過蛋白酶體產生的抗原肽主要是通過TAP轉運至內質網中,由于TAP的重要作用,許多病毒能夠通過影響TAP對抗原肽的轉運而抑制MHC-Ⅰ類分子抗原遞呈過程。已有研究表明,TAP轉運抗原肽主要包括兩個步驟。第一步是TAP與抗原肽的結合,這一過程不需要消耗ATP。抗原肽與TAP結合后能夠緩慢地引起TAP構像的變化,從而引起TAP與ATP的結合,最終在水解ATP消耗能量的情況下將抗原肽轉運至內質網中。皰疹病毒(Herpes virus,HSV)編碼的蛋白ICP47能夠競爭性地與TAP抗原肽結合位點結合,而且ICP47的這種結合力比抗原肽的高出10~1000倍,因此ICP47能夠在初始階段阻礙抗原肽的轉運[14]。進一步的研究發現,ICP47不僅能夠干擾TAP與底物的結合,而且ICP47形成的長發卡結構能夠阻塞TAP的轉運通道[15]。人巨細胞病毒(Human cytomegalovirus,HCMV)的US6蛋白能夠結合TAP并影響后者與ATP的結合,從而使TAP對抗原肽的轉運失去能量支持[16]。與HSV和HCMV類似,偽狂犬病毒(Pseudorabies virus,PrV)也能夠干擾TAP的活性,而且負責干擾TAP活性的基因與PrV的毒力有關[17]。
2.2.2 干擾tapasin分子的功能 轉運到內質網中的抗原肽需要在抗原肽結合復合體(peptide loadingcomplex,PLC)中與MHC-Ⅰ類分子結合,在此過程中起主要作用的PLC成分是tapasin分子[18]。而HCMV的US3蛋白[19]和腺病毒(Adenovirus)的E3-19K蛋白[20]都能通過影響tapasin分子的功能抑制抗原肽的遞呈。此外,HCMV能夠通過抑制tapasin的轉錄來破壞PLC的功能,從而抑制抗原肽的遞呈[21]。
2.3 下調細胞表面MHC-Ⅰ類分子水平 結合抗原肽的MHC-Ⅰ類分子表達到細胞表面后, MHC-Ⅰ類分子α1、α2區形成的抗原肽結合域與CD8+T細胞的TCR結合,MHC-Ⅰ類分子的保守區與CD8+T細胞表面的糖蛋白CD8結合,從而共同激活CTL,由CTL裂解受感染細胞。因此,病毒抑制MHC-Ⅰ類分子抗原遞呈過程最廣泛而有效的方式是下調細胞表面MHC-Ⅰ類分子水平。主要有兩種較常見的途徑,一種是通過增強細胞表面現存MHC-Ⅰ類分子的內化作用,從而降低細胞表面的MHC-Ⅰ類分子水平;另一種是減少到達細胞表面的MHC-Ⅰ類分子數量。
2.3.1 增強細胞表面MHC-Ⅰ類分子的內化作用
Huang等[22]的研究表明,馬皰疹病毒1型(Equine herpesvirus type 1,EHV-1)的pUL56蛋白能加速細胞表面MHC-Ⅰ類分子的內化作用并且使內化的MHC-Ⅰ類分子通過溶酶體降解,而這種內化作用是由發動蛋白(dynamin)酪氨酸激酶(tyrosine kinase)參與的。類似現象也出現在卡波西肉瘤相關的皰疹病毒(Kaposi's sarcoma-associated herpesvirus,KSHV)和EBV感染的細胞中。KSHV的K3和K5蛋白具有E3泛素連接酶活性,能夠通過結合MHC-Ⅰ類分子而使其泛素化,進而引起MHC-Ⅰ類分子的內化并被蛋白酶體降解[23]。與K3和K5相比,EBV的BDLF3蛋白雖然沒有E3泛素連接酶活性,但BDLF3也能引起MHC-Ⅰ類分子的泛素化,并通過蛋白酶體降解。作者推測BDLF3有能力招募細胞內其他的E3泛素連接酶而發揮作用[24]。此外,HIV的Nef蛋白能夠誘導細胞表面MHC-Ⅰ類分子的細胞內吞作用,而這種內吞作用是由ADP核糖基化因子6(ARF6)介導的[25]。最近的研究發現,Nef能夠結合MHC-Ⅰ的胞質尾區形成Nef-MHC-Ⅰ復合物,該復合物能夠被轉運到初級內體、次級內體以及反面高爾基體管網狀結構中,從而阻礙MHC-Ⅰ的循環利用[26]。
2.3.2 減少到達細胞表面的MHC-Ⅰ類分子數量
雖然病毒誘導MHC-Ⅰ類分子的內化能夠有效降低細胞表面的MHC-Ⅰ類分子水平,但是為了更高效地逃逸CTL的識別和殺傷,病毒往往更加關注新合成的MHC-Ⅰ類分子,降低其到達細胞表面的水平,避免這些新合成的MHC-Ⅰ類分子有效結合病毒抗原肽。
2.3.2.1 引起MHC-Ⅰ類分子在內質網/高爾基體(ER/Golgi)的滯留 為降低新合成MHC-Ⅰ類分子到達細胞表面的水平,牛痘病毒(Cowpox virus)的CPXV203蛋白能夠與內質網中新合成并組裝的MHC-Ⅰ類分子相互作用,并使后者滯留在內質網中,抑制MHC-Ⅰ類分子往高爾基體的轉運,且C端的KTEL序列對于CPXV203蛋白的功能是必須的[27]。此外,Ziegler等[28]的研究發現鼠巨細胞病毒(Murine cytomegalovirus,MCMV)編碼的m152蛋白能夠直接與MHC-Ⅰ類分子相互作用,從而將其滯留于內質網-高爾基體過渡部位(ERGIC)。Abendroth等[29]的研究表明,帶狀皰疹病毒(VZV)能夠將MHC-Ⅰ類分子滯留于高爾基體中,從而抑制其表達到細胞表面。
2.3.2.2 引起HC或者MHC-Ⅰ類分子的降解 HCMV的US2和US11誘導新合成的HC經過Sec61復合體重新進入細胞質內并且很快被蛋白酶體降解[30]。進一步的研究發現,在細胞內質網中,US11主要通過招募E3泛素連接酶TMEM129來快速降解MHC-Ⅰ,而且這種降解速度遠大于MHC-Ⅰ的合成速度。然而,US11的胞質尾區結構能夠防止US11被TMEM129快速降解[31]。類似的,人類T細胞白血病病毒1型(Human T-cell leukemia virus type 1,HTLV-1)的p12(I)蛋白能夠結合HC,從而抑制HC與β2m蛋白的組裝,進而誘導HC被蛋白酶體降解[32]。相對于上述結合HC的病毒蛋白,MCMV的m06(gp48)蛋白能夠結合載有抗原肽的MHC-Ⅰ類分子,并且使這些分子離開內質網,進入高爾基體后直接進入溶酶體被降解,而不是到達細胞表面[33]。人皰疹病毒7型(Human herpesvirus 7,HHV-7)的UL21蛋白能夠與剛折疊的未結合抗原肽的MHC-Ⅰ類分子相互作用,進而將MHC-Ⅰ類分子轉運至溶酶體中,使之被降解[34]。最近,Du等[35]的研究結果表明,豬繁殖與呼吸綜合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的非結構蛋白1α(Nsp1α)能夠與HC和β2m相互作用,從而促進HC和β2m經泛素-蛋白酶體途徑的降解。
2.3.2.3 抑制MHC-Ⅰ類分子HC和β2m基因的轉錄 為了從源頭減少到達細胞表面的MHC-Ⅰ類分子的數量,有些病毒能夠影響MHC-Ⅰ類分子HC和β2m基因的轉錄。如人類致瘤腺病毒12(human oncogenic adenovirus 12,Ad12)的E1A蛋白和HIV-1的Tat蛋白都能抑制HC和β2m基因的轉錄。牛和人乳頭瘤病毒的E5和E7是癌蛋白,早期表達于高爾基體和內質網,能夠降低MHC-Ⅰ的mRNA水平[36],而KSHV通過病毒FLICE抑制蛋白(vFLIP)和病毒IFN調控因子1(vIRF1)調控MHC-Ⅰ轉錄[37]。此外,高致病性豬繁殖與呼吸綜合征病毒(HP- PRRSV)的非結構蛋白4(Nsp4)能夠結合到β2m基因的啟動子上,從而抑制該基因的轉錄活動[38]。
3 展 望
許多病毒可在MHC-Ⅰ類分子抗原遞呈所涉及的各個方面進行干擾:抑制抗原肽的產生、干擾抗原肽的轉運、增強細胞表面MHC-Ⅰ類分子的內化作用、引起MHC-Ⅰ類分子在內質網/高爾基體的滯留、引起HC或者MHC-Ⅰ類分子的降解、抑制MHC-Ⅰ類分子HC和β2m基因的轉錄等。雖然不同的病毒采取的干擾策略不同,但最終目的都是通過干擾MHC-Ⅰ類分子抗原遞呈,而有效地逃避CTL的識別和殺傷,得以在宿主細胞內存活。
深入研究病毒干擾MHC-Ⅰ類分子抗原遞呈的分子機制有助于揭示病毒的免疫逃逸機制,為病毒疫苗的研制提供一定的思路。有些病毒蛋白發揮重要干擾作用,可以成為開發新型病毒疫苗的理想靶標。首先,可選擇性的敲除某些干擾MHC-Ⅰ類分子抗原遞呈的病毒復制非必需蛋白,從而為弱毒疫苗的成功研制提供一定的保障。如敲除EHV-1的pUL56和HIV的Nef基因,能夠明顯降低母源病毒的毒力[39-40],這說明pUL56和Nef干擾MHC-Ⅰ類分子抗原遞呈的功能可能是影響相應病毒毒力的重要原因,從而為EHV-1和HIV的弱毒苗以及其他病毒的弱毒苗研制提供了一條重要思路。其次,可以選擇性的去除或者突變掉某些病毒蛋白的關鍵性氨基酸位點,從而在保證該蛋白免疫原性的同時,避免該蛋白對MHC-Ⅰ類分子抗原遞呈的干擾。例如,雖然PRRSV Nsp1(Nsp1α+ Nsp1β)中含有兩處線性表位(54~59aa和157~163aa)[41],但表達Nsp1(Nsp1α+ Nsp1β)的重組腺病毒不但不能誘導機體產生良好的免疫應答,反而能夠明顯抑制宿主的免疫反應,進而抑制豬瘟疫苗的免疫效果[42]。造成這種現象的原因可能與Nsp1α和Nsp1β抑制宿主的干擾素通路[43]以及Nsp1α干擾MHC-Ⅰ類分子抗原遞呈密切相關[37]。而Nsp1α鋅指結構域的關鍵四個氨基酸位點的突變(8、10、25、28位的半胱氨酸突變成絲氨酸)能夠使其失去對MHC-Ⅰ類分子抗原遞呈的影響[35]。為此,我們在制備含有Nsp1α的疫苗時,特別是病毒載體疫苗及DNA疫苗時,可以選擇性地突變上述四個氨基酸位點,從而避免不必要的免疫抑制作用。
近年來,隨著我國畜牧業養殖集約化程度的不斷提高以及病原微生物的混合感染,使疾病的復雜程度不斷加劇,對疾病的控制也越來越難,最終導致養殖業對疫苗的依賴現象越來越嚴重,進而對疫苗的免疫效果提出了更高的要求。特別是針對能夠引起動物機體免疫抑制的病毒,如禽白血病、馬立克氏病以及豬的繁殖與呼吸綜合征病毒、豬圓環病毒2型等,疫苗的研制過程中應該充分考慮到本病疫苗對機體整體免疫和其他疫苗免疫效果的影響。而對病毒干擾MHC-Ⅰ類分子抗原遞呈分子機制的研究不僅有助于提高疫苗本身的免疫效果,而且也能夠減少對其他疫苗免疫效果的影響。
[1] Dalchau N, Phillips A, Goldstein L D,etal. A peptide filtering relation quantifies MHC class I peptide optimization[J]. Plos Computational Biology, 2011, 7(10):1002144.
[2] Warnatsch A, Bergann T, Krüger E. Oxidation matters: the ubiquitin proteasome system connects innate immune mechanisms with MHC class I antigen presentation[J]. Molecular Immunology, 2012, 55(2):106-109.
[3] 楊漢春. 動物免疫學[M]. 第2版.北京:中國農業大學出版社, 2003.
Hunchun Yang. Animal Immunology[M]. The second edition.Beijing:China Agricultural University Press, 2003.
[4] Abele R, Tampé R. Function of the transport complex TAP in cellular immune recognition.[J]. Biochimica Et Biophysica Acta, 2000, 1461(2):405-419.
[5] Garbi N, H?mmerling G, Tanaka S. Interaction of ERp57 and tapasin in the generation of MHC class I-peptide complexes[J]. Current Opinion in Immunology, 2007, 19(1):99-105.
[6] Lamriben L, Graham J B, Adams B M,etal. N-Glycan-based ER Molecular Chaperone and Protein Quality Control System: The Calnexin Binding Cycle[J]. Traffic, 2016.
[7] Wijeyesakere S J, Gagnon J K, Arora K,etal. Regulation of calreticulin-major histocompatibility complex (MHC) class I interactions by ATP[J]. Proceedings of the National Academy of Sciences, 2015, 112(41): E5608-E5617.
[8] Rizvi S M, Raghavan M. Mechanisms of function of tapasin, a critical major histocompatibility complex class I assembly factor[J]. Traffic, 2010,11(3):332-347.
[9] Donaldson J G, Williams D B. Intracellular assembly and trafficking of MHC class I molecules.[J]. Traffic, 2009, 10(12):1745-1752.
[10] Yin Y, Manoury B, F?hraeus R. Self-inhibition of synthesis and antigen presentation by Epstein-Barr virus-encoded EBNA1[J]. Science, 2003, 301(5638): 1371-1374.
[11] Beekman N J, van Veelen P A, Van H T,etal. Abrogation of CTL epitope processing by single amino acid substitution flanking the C-terminal proteasome cleavage site[J]. Journal of Immunology, 2000, 164(4):1898-905.
[12] Gilbert M J, Riddell S R, Plachter B,etal. Cytomegalovirus selectively blocks antigen processing and presentation of its immediate-early gene product[J]. Nature, 1996,383(6602):720-722.
[13] Huang X, Seifert U, Salzmann U,etal. The RTP site shared by the HIV-1 Tat protein and the 11S regulator subunit alpha is crucial for their effects on proteasome function including antigen processing[J]. Journal of Molecular Biology, 2002, 323(4):771-782.
[14] Ahn K, Meyer T H, Uebel S,etal. Molecular mechanism and species specificity of TAP inhibition by herpes simplex virus ICP47[J]. Embo Journal, 1996, 15(13):3247-3255.
[15] Oldham M L, Hite R K, Steffen A M,etal. A mechanism of viral immune evasion revealed by cryo-EM analysis of the TAP transporter.[J]. Nature, 2016, 529(7587):537.
[16] Hewitt E W. The MHC class I antigen presentation pathway: strategies for viral immune evasion[J]. Immunology, 2003, 110(2):163-169.
[17] Ambagala A P, Hinkley S, Srikumaran S. An early pseudorabies virus protein down-regulates porcine MHC class I expression by inhibition of transporter associated with antigen processing (TAP) [J]. Journal of Immunology, 2000, 164(1):93-99.
[18] Praveen P V, Yaneva R, Kalbacher H,etal. Tapasin edits peptides on MHC class I molecules by accelerating peptide exchange.[J]. European Journal of Immunology, 2010, 40(1):214-224.
[19] Park B, Kim Y, Shin J,etal. Human cytomegalovirus inhibits tapasin-dependent peptide loading and optimization of the MHC class I peptide cargo for immune evasion[J]. Immunity, 2004, 20(1):71-85.
[20] Ennett E M, Bennink J R, Yewdell J W,etal. Cutting edge: adenovirus E19 has two mechanisms for affecting class I MHC expression[J]. Journal of Immunology, 1999, 162 (9):5049-5052.
[21] Halenius A, Hauka S, D?lken L,etal. Human cytomegalovirus disrupts the major histocompatibility complex class I peptide-loading complex and inhibits tapasin gene transcription[J]. Journal of virology, 2011, 85(7): 3473-3485.
[22] Huang T, Lehmann M J, Said A,etal. Major histocompatibility complex class I downregulation induced by equine herpesvirus type 1 pUL56 is through dynamin-dependent endocytosis[J]. Journal of virology, 2014, 88(21):12802-12815.
[23] Duncan L, Piper S, Dodd R,etal. Lysine-63-linked ubiquitination is required for endolysosomal degradation of class I molecules[J]. Embo Journal, 2006, 25(8):1635-1645.
[24] Quinn L L, Williams L R, White C,etal. The Missing Link in Epstein-Barr Virus Immune Evasion: the BDLF3 Gene Induces Ubiquitination and Downregulation of Major Histocompatibility Complex Class I(MHC-I) and MHC-II.[J]. Journal of Virology, 2015, 90(1):356.
[25] Blagoveshchenskaya A D, Thomas L, Feliciangeli S F,etal. HIV-1 Nef downregulates MHC-Ⅰby a PACS-1-and PI3K-regulated ARF6 endocytic pathway[J]. Cell, 2002, 111(6):853-866.
[26] Dirk B S, Pawlak E N, Johnson A L,etal. HIV-1 Nef sequesters MHC-I intracellularly by targeting early stages of endocytosis and recycling.[J]. Scientific Reports, 2016, 6:37021.
[27] Byun M, Wang X, Pak M,etal. Cowpox virus exploits the endoplasmic reticulum retention pathway to inhibit MHC class I transport to the cell surface[J]. Cell Host amp; Microbe, 2007, 2(5):306-315.
[28] Ziegler H, Thale R, Lucin P,etal. A mouse cytomegalovirus glycoprotein retains MHC class I complexes in the ERGIC/cis-Golgi compartments[J]. Immunity, 1997, 6(1):57-66.
[29] Abendroth A, Lin I, Slobedman B,etal. Varicella-zoster virus retains major histocompatibility complex class I proteins in the Golgi compartment of infected cells[J]. Journal of virology, 2001, 75(10):4878-4888.
[30] Story C M, Furman M H, Ploegh H L. The cytosolic tail of class I MHC heavy chain is required for its dislocation by the human cytomegalovirus US2 and US11 gene products[J]. Proceedings of the National Academy of Sciences, 1999, 96(15):8516-8521.
[31] Boomen D J H V D, Timms R T, Grice G L,etal. TMEM129 is a Derlin-1 associated ERAD E3 ligase essential for virus-induced degradation of MHC-I.[J]. Proceedings of the National Academy of Science, 2014, 111(31):11425-11430.
[32] Johnson J M, Mulloy J C, Ciminale V,etal. The MHC class I heavy chain is a common target of the small proteins encoded by the 3' end of HTLV type 1 and HTLV type 2[J]. Aids Research amp; Human Retroviruses, 2000, 16(16):1777-1781.
[33] Markus Wagner, Anja Gutermann, Jürgen Podlech,etal. Major Histocompatibility Complex Class I Allele-specific Cooperative and Competitive Interactions between Immune Evasion Proteins of Cytomegalovirus[J]. Journal of Experimental Medicine, 2002, 196(6):805-816.
[34] Wyatt L S, Frenkel N. Human herpesvirus 7 is a constitutive inhabitant of adult human saliva[J]. Journal of virology, 1992, 66(5):3206-3209.
[35] Du J, Ge X, Liu Y,etal. Targeting swine SLA-I molecules for proteasomal degradation by the nsp1α replicase protein of the Chinese highly pathogenic PRRSV strain JXwn06[J]. Journal of Virology, 2016, 90:682-693.
[36] Ashrafi G H, Haghshenas M R, Marchetti B,etal. E5 protein of human papillomavirus type 16 selectively downregulates surface HLA class I.[J]. International Journal of Cancer, 2005, 113(2):276-283.
[37] Lagos D, Trotter M W, Vart R J,etal. Kaposi sarcoma herpesvirus-encoded vFLIP and vIRF1 regulate antigen presentation in lymphatic endothelial cells.[J]. Blood, 2007, 109(4):1550-1558.
[38] Qi P, Liu K, Wei J,etal. Non-structural Protein 4 of Porcine Reproductive and Respiratory Syndrome Virus Modulates Cell Surface Swine Leukocyte Antigen Class I Expression by Down-regulating β2-Microglobulin Transcription[J]. Journal of Virology, 2016: JVI. 01755-16.
[39] Hussey G S. Evaluation of immune responses following infection of ponies with an EHV-1 ORF1/2 deletion mutant[J]. Veterinary Research, 2011, 42(1):1-12.
[40] Zou W. Nef functions in BLT mice to enhance HIV-1 replication and deplete CD4 + CD8 + thymocytes[J]. Retrovirology, 2012, 9(1):1-15.
[41] Song Y, Zhou Y, Li Y,etal. Identification of B-cell epitopes in the NSP1 protein of porcine reproductive and respiratory syndrome virus[J]. Veterinary Microbiology, 2012, 155(2/4):220-229.
[42] Zhou Y F, Cao J, Yu-Feng L I,etal. Suppression of immune responses in pigs by highly pathogenic porcine reproductive and respiratory syndrome virus NSP1[J]. Chinese Journal of Veterinary Science, 2012.
[43] Fang Y, Snijder E J. The PRRSV replicase: exploring the multifunctionality of an intriguing set of nonstructural proteins.[J]. Virus Research, 2010, 154(1/2):61-76.
(編輯:侯向輝)
MHC-ⅠAntigenPresentationandViralImmuneEvasion
LIU Ying,WANG Tuan-jie,WU Si-jie,ZHAO Jun-jie,KANG Kai,WAN Jian-qing,YAO Wen-sheng*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
YAOWen-sheng,E-mail:1196314953@qq.com
This paper describes the progress of antigen presentation mediated by major histocompatibility complexⅠ(MHC-Ⅰ)molecule, as well as the countermeasures and specific molecular mechanisms exploited by viruses to evade this type of immunity, which are helpful for understanding the mechanisms associated with viral immune evasion and contribute to the development of viral vaccines.
major histocompatibility complexⅠmolecule;antigen presentation;virus;immune evasion
10.11751/ISSN.1002-1280.2017.11.11
2016-12-29
A
1002-1280 (2017) 11-0071-07
S852.65
北京市科技計劃項目(D151100002515003)
劉 瑩,碩士,從事獸用生物制品檢驗與動物實驗管理工作。
姚文生。E-mail:1196314953@qq.com

