蓽茇酰胺對膠質瘤細胞的影響
張倩 徐文茂
蓽茇酰胺對膠質瘤細胞的影響
張倩 徐文茂
目的探討蓽茇酰胺(piperlongumine,PL)對膠質瘤增殖以及侵襲的作用并闡明其作用機制。方法我們應用蓽茇酰胺處理了兩種不同的人腦膠質瘤細胞系,并用正常神經元細胞和膠質細胞作為對照。通過檢測PL對于細胞ROS水平的改變以及細胞增殖信號通路的改變。隨后檢測了PL潛在的作用靶點PRDX4的活性改變。結果PL能夠顯著增強兩種人膠質瘤細胞的ROS水平以及抑制細胞增殖能力,但對正常神經元細胞則無明顯影響。隨后的檢測中,我們發現PL刺激膠質瘤細胞后多種ROS相關的氧化反應調節因子都出現了上調,其中以PRDX家族中的PRDX4表達量上升最為明顯。同時我們還發現,抑制ROS的作用之后,PL誘導膠質瘤細胞凋亡的能力出現了抑制。結論PL能夠通過提高PRDX4的表達從而介導膠質瘤細胞的凋亡,因此PL可能作為膠質瘤的潛在治療藥物。
茇酰胺;膠質瘤;侵襲
作者單位:250022 濟南,山東濟南循證醫藥科技開發中心(張倩);100054 北京,北京斯普林格醫學研究院分子醫學研究所(徐文茂)
高級別膠質瘤是中樞神經系統中惡性程度最高以及最為常見的腫瘤。其中,以膠質母細胞瘤(glioblastoma,GBM)最為高發。盡管在臨床以及實驗室研究中都進行了大量的工作,但患者在診斷后的生存時間通常小于14.6個月,僅僅比25年前的生存期增加了2.5個月[1]。目前,最為有效的GBM治療方法僅能短暫的增加患者的生存時間,而無法有效治療腫瘤,并且仍存在著易復發和轉移的特性,因此,新的GBM治療方式急需創新。
通過以往的研究,我們發現大多數的GBM都存在PRDX4的過度高表達,同時,也有研究表明,通過敲除PRDX4能夠增加ROS的表達量,進而在體外導致GBM細胞的凋亡,進一步在小鼠的原位GBM模型中,減少小鼠腫瘤體積,從而延長小鼠生存率。上述的研究都表明,通過靶向藥物抑制PRDX4能夠通過增加ROS的水平從而有效殺傷腫瘤細胞。
通過蓽茇酰胺(piperlongumine,PL)選擇性地增加ROS水平已被證明對許多腫瘤具有殺傷作用,包括乳腺癌、黑色素瘤、淋巴瘤和GBM等[2]。PL是由植物蓽茇中提取出來的天然生物堿。更為重要的是,應用PL的治療方式在殺傷腫瘤細胞的同時,還能夠減少對正常細胞生長的影響,減少化療對機體的影響。以往的研究發現,藥物處理后的腫瘤細胞中ROS水平出現了成倍的增長,而正常細胞則沒有這種表現,表明PL具有腫瘤細胞靶向治療的特性。過去的研究已經表明,PL的抗腫瘤作用與包括PRDX1的多種抗氧化蛋白密切相關[3]。更為重要的是,近期的研究表明,PL在全養分的培養條件下能夠選擇性的介導GBM的凋亡[4]。盡管如此,目前對于PL更為貼近臨床的研究,即在膠質瘤癌球以及在體作用的研究仍不清楚,因此PL距離臨床抗腫瘤藥物的應用還存在研究的空間[5]。
在本研究中,我們發現PL處理后能夠有效增加GBM細胞中ROS的水平,同時能夠選擇性的靶向介導HGG細胞的凋亡而對正常腦細胞無明顯影響。究其機制,我們發現PL通過抑制膠質瘤細胞中PRDX4的活性而增加增加其內質網應激水平介導ROS的表達。
1 材料和方法
1.1 細胞系 人膠質瘤細胞系U87、U251均來源于上海細胞庫。
1.2 藥物處理以及細胞增殖能力檢測 將5.0×103的細胞種于96孔板或3.0×104細胞種于24孔板,24 h后,用以不同濃度溶于DMEM的PL(0-10 μmol/L)處理細胞1 d-6 d,隨后通過CCK-8試劑盒檢測細胞增殖能力改變。具體方法為分別在第1、2、4、6天加入10 μL的CCK-8試劑,37oC孵育2 h,測定 450 nm的OD值。
1.3 PRDX4活性檢測 通過2-Cys-Peroxiredoxin活性檢測試劑盒檢測PRDX4的活性,具體方法為,30 μg細胞裂解液或者3 μg的重組人PRDX4蛋白與硫氧還蛋白、硫氧還蛋白還原酶以及NAPDH混合。隨后加入10 mmol/L的過氧化氫啟動反應并分別在第60、90、120秒通過分光光度法檢測NADPH的消耗量。
1.4 統計學方法 采用 SPSS 12.0 統計軟件進行數據分析,計數資料采用率(%)表示,組間比較采用卡方檢驗;計量資料采用均數±標準差(Mean±SD)表示,組間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 PL處理后顯著性介導膠質瘤細胞凋亡 我們首先應用不同濃度的PL分別對人膠質瘤細胞系以及正常的人膠質細胞以及神經元細胞進行了處理。結果發現,與未處理組相比,PL處理后的人膠質瘤細胞的增殖能力被有效的降低,其中,10 μmol/L的PL處理后,與正常培養的人膠質瘤細胞系相比較,能夠將人膠質瘤細胞系U87、U251的增殖能力降低60%-90%,存在統計學差異。同時,通過對正常膠質細胞以及神經元細胞的處理我們發現,PL對于正常細胞的增殖能力無明顯影響,PL處理后神經元的增殖能力未見明顯變化,見圖1。
2.2 PL處理后顯著提高膠質瘤細胞中ROS的水平 隨后,我們檢測了PL對膠質瘤細胞的殺傷作用是否與其對其他腫瘤的機制類似,即通過增加ROS的水平從而介導腫瘤細胞的凋亡。通過檢測后我們發現,在兩組人膠質瘤細胞U87、U251中,給予PL刺激后,ROS水平分別增加了約51%和52%,而在神經元細胞刺激后則未見明顯變化,見圖2。上述結果表明,PL的腫瘤細胞殺傷作用與誘導腫瘤細胞內ROS水平上升相一致,為PL抗腫瘤作用的可能機制。
2.3 PL處理后能夠選擇性增加膠質瘤細胞的凋亡水平隨后,我們有進一步檢測了PL處理后,人膠質瘤細胞系U87、U251以及神經元細胞的凋亡水平,結果發現,PL處理后,U87以及U251的凋亡率均出現了顯著增加,存在統計學差異,而應用PL處理神經元細胞后則未見其對神經元細胞的凋亡有明顯影響,見圖3。上述結果表明,PL能夠通過提高膠質瘤細胞的ROS水平從而進一步介導膠質瘤細胞凋亡,但對正常的神經元細胞則無影響,表現出膠質瘤細胞的靶向治療特性。
2.4 PL對于膠質瘤細胞的殺傷作用依賴于ROS的激活 同時,為了驗證PL對于腫瘤細胞的殺傷作用依賴于ROS的增高,我們又在PL處理后的膠質瘤細胞系中加入了一種經典的抗氧化劑-乙酰半胱氨酸(NAC),并且發現,U87以及U251細胞應用NAC處理后,其對于PL的殺傷作用明顯耐受增強,有統計學意義,見圖4。由此上述的結果明確了PL依賴ROS的增加從而介導人膠質瘤細胞的凋亡。
2.5 PL處理后顯著降低膠質瘤細胞中PRDX4的活性我們首先通過q-PCR檢測了PL處理后兩種人膠質瘤細胞系U87、U251以及正常人神經元細胞的ROS相關調節因子中的重要一員,PRDX家族基因表達水平的改變,結果發現,PL處理后與神經元細胞相比,PRDX4基因水平出現了顯著性增高,具有統計學意義,見圖5。同樣的,對PRDX酶活性的檢測結果也表明,細胞裂解液中的PRDX的酶活性在PL處理之后明顯出現了抑制,具有統計學差異,見圖6。上述實驗結果說明,PL刺激膠質瘤細胞后,腫瘤細胞中PRDX4的活性受到明顯的抑制,結合之前的研究證據,表明PRDX4是PL介導ROS從而導致膠質瘤細胞凋亡的重要媒介。
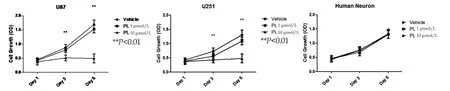
圖1 蓽茇酰胺處理后顯著性介導膠質瘤細胞凋亡
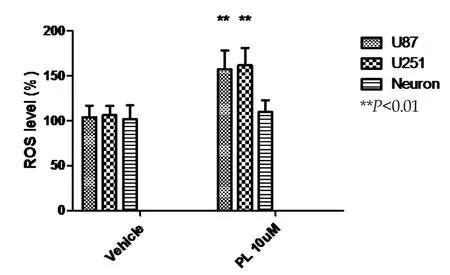
圖2 蓽茇酰胺處理后顯著性提高膠質瘤細胞中ROS的水平
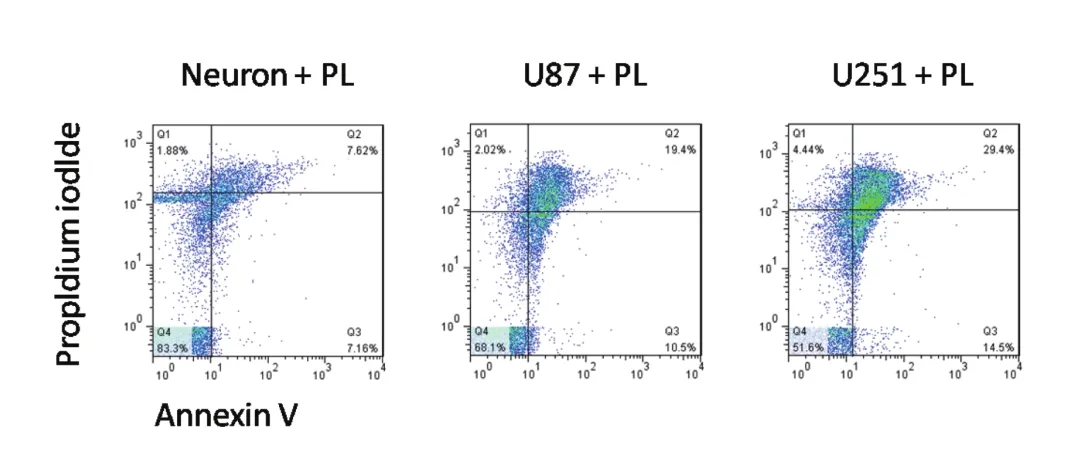
圖3 蓽茇酰胺處理后能夠選擇性增加膠質瘤細胞的凋亡水平
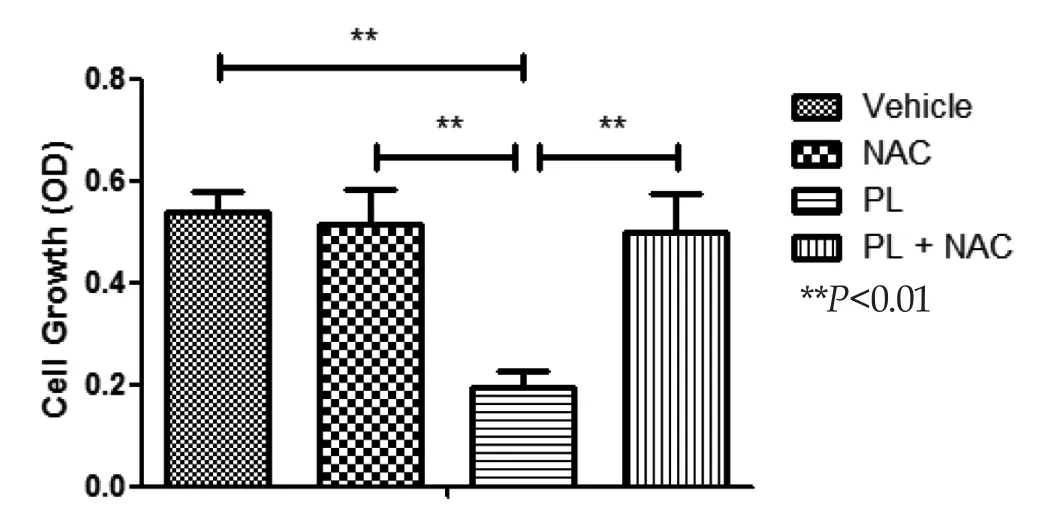
圖4 蓽茇酰胺對于膠質瘤細胞的殺傷作用依賴于ROS的激活

圖5 蓽茇酰胺處理后顯著降低膠質瘤細胞中PRDX酶的活性
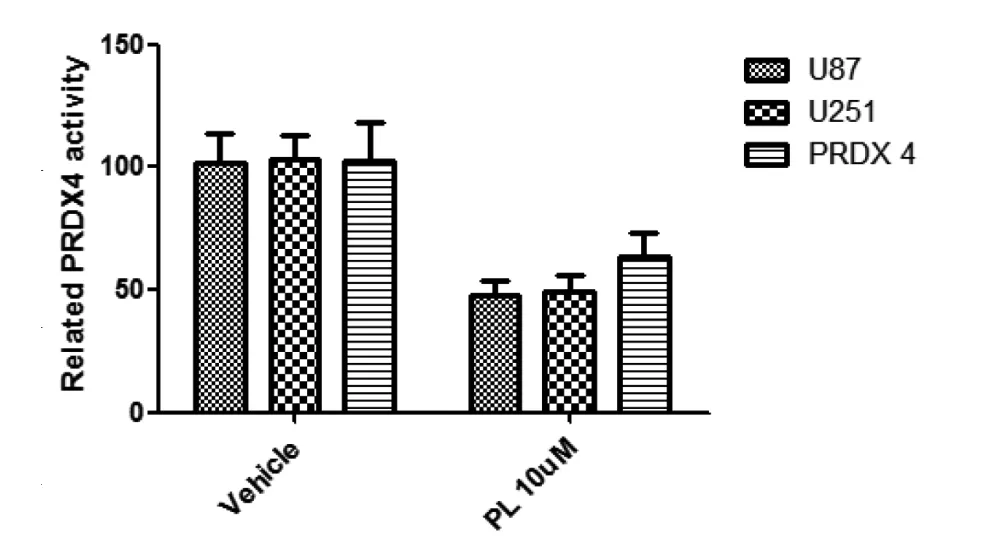
圖6 蓽茇酰胺處理后顯著降低膠質瘤細胞中PRDX4的活性
3 討論
以往關于PRDX4的研究已經明確的表明,PRDX4在膠質瘤中存在高表達的現象,并且PRDX4敲除之后能夠顯著增加ROS的水平從而殺傷膠質瘤細胞。但是如何選擇性地靶向針對PRDX4進行膠質瘤治療仍然存在較大爭議,特別是PRDX4在多種細胞上都存在廣泛的表達。通過本研究,我們發現了一種天然的植物提取物PL,能夠特異性的降低膠質瘤細胞中PRDX4的活性,從而對腫瘤細胞產生殺傷作用[6]。
ROS參與了大量的細胞活動。過量的ROS水平能夠引起氧化應激、DNA損傷和基因組的不穩定。因此,ROS水平的高低與腫瘤的發生發展密切相關,同時抗氧化應激反應也是抗腫瘤治療的潛在靶標。但是,近期的許多研究都表明,許多腫瘤中抗氧化應激蛋白的表達量均高于正常組織。這些在腫瘤組織中高表達的抗氧化應激蛋白減輕了腫瘤中ROS的水平,進而降低了內質網應激,減少了氧化應激對于腫瘤細胞的損傷,使腫瘤細胞更易于生存[7,8]。因此通過增加氧化應激來促進腫瘤細胞的凋亡,將成為未來重要的抗腫瘤治療方法,而本實驗中,PL通過增加ROS的水平從而抑制膠質瘤細胞的增殖水平,是對上述理論的有力支持。
已知PL能夠與多種ROS的調節因子相互作用。在本研究中,我們發現膠質瘤細胞中ROS的調節基因的表達水平遠高于正常的神經元細胞。但是此前的研究發現,對于CBR1、GSTZ1以及PRDX1等基因的敲除對PL介導的人膠質瘤細胞增殖能力的抑制未見影響。由此說明,PL在膠質瘤細胞中存在其他的作用靶點。本研究中發現PRDX4在PL處理過的膠質瘤細胞中存在明顯高表達,為PL作用的靶點提供了新的證據,同時也解釋了PL不影響正常神經元細胞的機制,即由于PRDX4在正常細胞中表達量較低,因此PL處理后無法滲入細胞,使其不能誘導凋亡產生[9]。
最后,對于中樞神經系統腫瘤的藥物治療,最為重要的一點即是能夠順利通過血腦屏障。根據相關報道表明,PL能夠自由的通過血腦屏障。因此,通過PL抑制PRDX4的活性,進而使膠質瘤細胞中的ROS水平增高,抑制腫瘤生長和增殖,將會成為未來膠質瘤治療中的一種有效手段。
1 Markovic DS,Vinnakota K,Chirasani S,et al.Gliomas induce and exploit microglial MT1-MMP expression for tumor expansion.Proc Natl Acad Sci U S A,2009,106(30): 12530-12535.
2 Shrivastava S,Kulkarni P,Thummuri D,et al.Piperlongumine,an alkaloid causes inhibition of PI3 K/Akt/mTOR signaling axis to induce caspase-dependent apoptosis in human triple-negative breast cancer cells.Apoptosis,2014,19(7): 1148-1164.
3 Liu Y,Chang Y,Yang C,et al.Biodegradable nanoassemblies of piperlongumine display enhanced anti-angiogenesis and anti-tumor activities.Nanoscale,2014,6(8): 4325-4337.
4 Ryu J,Kim MJ,Kim TO,et al.Piperlongumine as a potential activator of AMP-activated protein kinase in HepG2 cells.Nat Prod Res,2014,28(22): 2040-2043.
5 Liu QR,Liu JM,Chen Y,et al.Piperlongumine inhibits migration of glioblastoma cells via activation of ROS-dependent p38 and JNK signaling pathways.Oxid Med Cell Longev,2014,2014: 653732.
6 Jin HO,Lee YH,Park JA,et al.Piperlongumine induces cell death through ROS-mediated CHOP activation and potentiates TRAIL-induced cell death in breast cancer cells.J Cancer Res Clin Oncol,2014,140(12): 2039-2046.
7 Wu Y,Min X,Zhuang C,et al.Design,synthesis and biological activity of piperlongumine derivatives as selective anticancer agents.Eur J Med Chem,2014,82:545-551.
8 Suzuki-Karasaki Y,Suzuki-Karasaki M,Uchida M,et al.Depolarization controls TRAIL-sensitization and tumor-selective killing of cancer cells: Crosstalk with ROS.Front Oncol,2014,4: 128.
9 Neumann CA,Fang Q.Are peroxiredoxins tumor suppressors? Curr Opin Pharmacol,2007,7(4): 375-380.
Role of piperlongumine in glioma proliferation
Qian ZHANG1,Wenmao XU2
1Ji'nan Evidence Based Medicine Technology Development Center of Shandong,Ji'nan 250022,China;2Institute of Molecular Medicine,Beijing Springer Medical Research Institute,Beijing 100054,China
ObjectivePiperlongumine,a natural plant product,kills multiple cancer types with little effect on normal cells.Piperlongumine raises intracellular levels of reactive oxygen species (ROS),a phenomenon that may underlie the cancer-cell killing.Although these findings suggest that piperlongumine could be useful for treating cancers,the mechanism by which the drug selectively kills cancer cells remains unknown.MethodsWe treated multiple high-grade glioma (HGG) sphere cultures with piperlongumine and assessed its effects on ROS and cell growth levels as well as changes in downstream signaling.We also examined the levels of putative piperlongumine targets and their roles in HGG cell growth.ResultsPiperlongumine treatment increased ROS levels and preferentially killed HGG cells with little effect in normal brain cells.Piperlongumine reportedly increases ROS levels after interactions with several redox regulators.Furthermore,piperlongumine treatment in HGG cells,but not in normal NSCs,increased oxidative inactivation of peroxiredoxin 4 (PRDX4),an ROS-reducing enzyme that is overexpressed in HGGs.Moreover,piperlongumine’s effects was blocked after the inhibition of ROS overexpression in glioma cells.ConclusionOur results reveal that the mechanism by which piperlongumine preferentially kills HGG cells involves PRDX4 inactivation.Therefore,piperlongumine treatment could be considered as a novel therapeutic option for HGG treatment.
Piperlongumine; Glioma; Proliferation

