ERK5對體外血小板活化及在體血栓的影響*
高 穩, 李 劍, 倪喚春, 劉俊嶺, 羅心平
(復旦大學附屬華山醫院心內科, 上海 200040)
ERK5對體外血小板活化及在體血栓的影響*
高 穩, 李 劍, 倪喚春, 劉俊嶺, 羅心平△
(復旦大學附屬華山醫院心內科, 上海 200040)
目的探討細胞外信號調節激酶5(ERK5)對體外血小板聚集及在體血栓的影響及機制。方法采用Western blot對人血小板中ERK5的表達及其在血小板活化后的磷酸化水平進行檢測;采用血小板聚集儀檢測ERK5特異性抑制劑XMD8-92對血小板聚集及致密顆粒釋放的影響;采用FeCl3頸動脈血栓模型檢測ERK5對在體血栓的影響;采用Western blot檢測XMD8-92對蛋白激酶B(Akt)和人第10號染色體缺失的磷酸酶及張力蛋白同源蛋白(PTEN)磷酸化的影響。結果人血小板中存在ERK5的穩定表達,其磷酸化水平在血小板活化后顯著升高(P<0.05)。XMD8-92可抑制多種血小板激活劑引起的血小板聚集和致密顆粒釋放(P<0.05)。Western blot結果表明,XMD8-92可通過下調PTEN Ser370位點磷酸化而增強PTEN的活性,從而抑制Akt的磷酸化,這種抑制效果也通過血小板特異PTEN基因敲除小鼠得到了驗證。在體血栓研究表明,XMD8-92經尾靜脈給藥,可顯著延長小鼠第一次頸動脈血栓的形成時間。結論ERK5可通過影響PTEN的磷酸化調節Akt的活化,進而影響到體外血小板的聚集和在體血栓的形成。
細胞外信號調節激酶5; 血小板; 血栓; 人第10號染色體缺失的磷酸酶及張力蛋白同源蛋白
心血管疾病是人類健康的重大威脅,《中國心血管病報告2015》表明,2014年心血管病死亡率仍為我國各疾病之首,占居民死亡構成的主要部分(農村為44.60%,城市為42.51%),其死亡率仍然高于腫瘤及其它疾病[1]。其中,急性心肌梗死的發病率和死亡率占到心血管疾病的首位,在心肌梗死的發病過程中,血小板的異常活化是急性血栓事件發生的起始因素,因此深入研究血小板的活化通路及調控機制對研發新型抗栓藥物并闡明動脈血栓的發生機制都有重要意義[2]。
絲裂原激活的蛋白激酶(mitogen-activated protein kinases,MAPK)信號通路在血小板活化中有重要作用,它負責承接來自受體傳入的刺激信號,并向血小板內部傳遞,在與其它通路包括磷脂酰肌醇3-激酶(phosphatidylino sitol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,PKB/Akt)通路和磷脂酶C (phospholipase C, PLC)通路完成交叉后活化整合素,從而完成血小板的活化。細胞外信號調節激酶5(extracellular signal-regulated kinase 5,ERK5)是MAPK家族的新成員[3],最新研究發現血小板中也存在ERK5的穩定表達。2015年有研究通過對血小板特異ERK5基因敲除小鼠建立冠脈結扎模型,證實ERK5可以通過影響S6K1蛋白磷酸化影響到心肌梗死發生后心功能的惡化[4]。我們前期研究中發現ERK5參與了膠原引起的血小板活化[5],但ERK5是否參與了其它刺激引起的血小板的聚集,通過怎樣的機制發揮作用,對在體動脈血栓有何影響,目前尚不明確。本研究擬采用ERK5選擇性抑制劑XMD8-92對其在血小板聚集和在體血栓中的作用進行探討,并對其作用機制進行研究,為尋找新的抗血小板靶點提供實驗依據。
材 料 和 方 法
1藥品與試劑
體外實驗所用血小板來自健康志愿者,抽血前10 d無抗血小板藥物應用史,參與者均簽署知情同意書。血小板特異人第10號染色體缺失的磷酸酶及張力蛋白同源蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)基因敲除(PTEN-/-)小鼠為上海交通大學醫學院劉俊嶺教授贈予;野生型小鼠為C57BL/6背景,購自南方模式動物中心。所用膠原(collagen)和螢光素(luciferin)/螢光素酶(luciferase)購自Chrono-Log;腺苷二磷酸(adenosine diphosphate, ADP)、腺苷三磷酸雙磷酸酶(apyrase)、前列腺素E1(prostaglandin E1,PGE1)和血栓烷A2類似物U46619購自Sigma;凝血酶(thrombin)購自Enzyme Research Laboratories;XMD8-92購自Selleck;抗p-Akt (Ser473)抗體、p-Akt (Thr308)抗體、p-PTEN (Ser370)抗體和GAPDH抗體購自Cell Signaling。
2實驗方法
2.1洗滌血小板的制備[6-7]人血小板制備方法:從健康志愿者肘靜脈取血后,向制得的全血中加入等體積0.9%的氯化鈉溶液,加入apyrase(終濃度1×103U/L)和PGE1(終濃度0.1 mg/L)混勻后室溫離心1 050 r/min,10 min;吸取上層富血小板血漿,加入apyrase(終濃度1×103U/L)和EDTA(終濃度為5 mmol/L),混勻后室溫離心1 900 r/min,10 min,棄去上清后加入預熱好的Tyrodes Buffer(12 mmol/L NaHCO3、138 mmol/L NaCl、5.5 mmol/L 葡萄糖、2.9 mmol/L KCl、2 mmol/L MgCl2、0.42 mmol/L NaH2PO4和10 mmol/L HEPES,pH 7.4),將血小板沉淀充分吹開,得到云霧狀的血小板懸液,即為洗滌血小板;采用HEMAVET血球計數儀計數,調節血小板的濃度為3×1011/L。
經腹腔注射1%戊巴比妥鈉(10 mL/kg)麻醉小鼠,采用腹主動脈穿刺取血,將基因型相同的小鼠全血置于同一15 mL離心管中制備小鼠血小板,制備方法同人血小板。
2.2比濁法測定人血小板的體外聚集[7]將DMSO及終濃度分別為5、10和20 μmol/L的XMD8-92與洗滌血小板共孵育3 min,使用血小板聚集儀分別檢測在血小板常用激活劑(膠原、凝血酶、U46619和ADP)刺激下,不同濃度XMD8-92對人血小板聚集程度的影響。
2.3通過螢光素酶檢測人血小板的ATP分泌[8]在血小板聚集曲線達到平臺期后,向每個比濁管中加入10 μL的螢光素/螢光素酶,利用血小板聚集儀同時檢測血小板中ATP的分泌情況。
2.4Western blot法檢測Akt、PTEN及ERK5的磷酸化水平[9-10]向聚集反應后的血小板中加入等體積的2×SDS裂解液。在冰上充分裂解后,煮沸使蛋白變性,采用SDS-PAGE分離蛋白,并轉至PVDF膜上。加入 I 抗孵育過夜,漂洗后加入辣根過氧化物酶標記的IgG,室溫振蕩孵育1 h。漂洗后顯色,終止反應后拍照。采用ImageJ軟件對免疫印記條帶灰度值進行分析。
2.5FeCl3頸動脈血栓模型檢測在體血栓的形成[11]分別對2組野生型小鼠進行尾靜脈給藥:實驗組采用PBS稀釋XMD8-92,給藥劑量為2 mg/kg,對照組將等體積的DMSO稀釋于PBS溶液給藥。給藥30 min后,采用1%戊巴比妥鈉(10 mL/kg)麻醉小鼠后,將小鼠固定并游離一側頸動脈,將多普勒超聲血流儀探頭勾在小鼠頸動脈遠心端,待血流平穩后,將浸潤有10% FeCl3溶液的濾紙灼傷頸動脈,計時3 min后取下濾紙并記錄開始時間及血流速度,當頸動脈的血流速度低于0.06 mL/min時,記下時間,視為第一次血栓形成。
3統計學處理
采用SPSS軟件對結果進行統計分析,結果以均數±標準差(mean±SD)表示。符合正態分布的計量資料采用Studentt檢驗或單因素方差分析;不符合正態分布的計量資料采用Cruskal-Wallis檢驗。采用GraphPad Prism 5.0軟件繪制柱形圖。以P<0.05為有差異有統計學意義。
結 果
1Westernblot證實ERK5在人血小板上存在穩定表達并參與血小板活化
Western blot證實人血小板中確有ERK5的穩定表達,其磷酸化水平在分別以中濃度凝血酶(10 U/L)、ADP(10 μmol/L)、U46619(10 U/L)及膠原(2 mg/L)激活血小板后顯著升高(P<0.05),見圖1。
2ERK5抑制劑對血小板聚集和ATP分泌的影響
在中濃度凝血酶、ADP、膠原及U46619刺激下,XMD8-92對血小板聚集均呈現抑制作用,見圖2。

Figure 1. ERK5 was stably expressed in human platelets and was phosphorylated after platelet activation. Mean±SD.n=3.*P<0.05,**P<0.01vsresting.
圖1ERK5在人血小板中穩定表達并參與血小板活化

Figure 2. XMD8-92 inhibited collagen-, U46619-, thrombin- and ADP-induced platelet aggregationinvitroin a concentration-dependent manner. Mean±SD.n=3.*P<0.05,**P<0.01vsDMSO.
圖2XMD8-92對血小板聚集的影響
在上述激活劑作用下,10 μmol/L的XMD8-92顯著抑制了ATP的分泌,差異均具有統計學意義(P<0.01),見圖3。
3ERK5抑制劑對Akt473和Akt308磷酸化的影響
Akt是血小板中重要的效應激酶[12],也是ERK5的主要底物之一[13-14]。Western blot檢測發現,血小板聚集反應后,ERK5抑制劑對Akt Ser473和Thr308位點的磷酸化均呈現抑制作用,10 μmol/L的XMD8-92即可顯著抑制Akt的磷酸化水平,與DMSO組相比差異有統計學意義(P<0.05),見圖4。因此,我們認為,血小板中也存在ERK5對Akt的調節作用。
4ERK5通過調節PTEN磷酸化影響血小板活化
Akt的Ser473位點和Thr308位點磷酸化分別由哺乳動物雷帕霉素靶蛋白復合物[15]和磷酸肌醇依賴性蛋白激酶[9]調控。那么ERK5是如何影響到Akt的活化呢?我們對PI3K/Akt信號通路中主要的調控激酶PTEN[7]的磷酸化水平進行了檢測。結果顯示,XMD8-92顯著抑制了PTEN Ser370位點磷酸化水平,差異具有統計學意義(P<0.05),見圖5A。進一步,我們采用血小板特異PTEN-/-小鼠對ERK5的調控作用進行了驗證。結果顯示,以膠原為激活劑時,PTEN-/-小鼠較對照組小鼠血小板聚集程度增高;在孵育了XMD8-92后,PTEN-/-小鼠血小板聚集程度受到的抑制程度較對照組減低,見圖5B。這些結果表明,ERK5抑制劑可通過PTEN調節血小板活化。
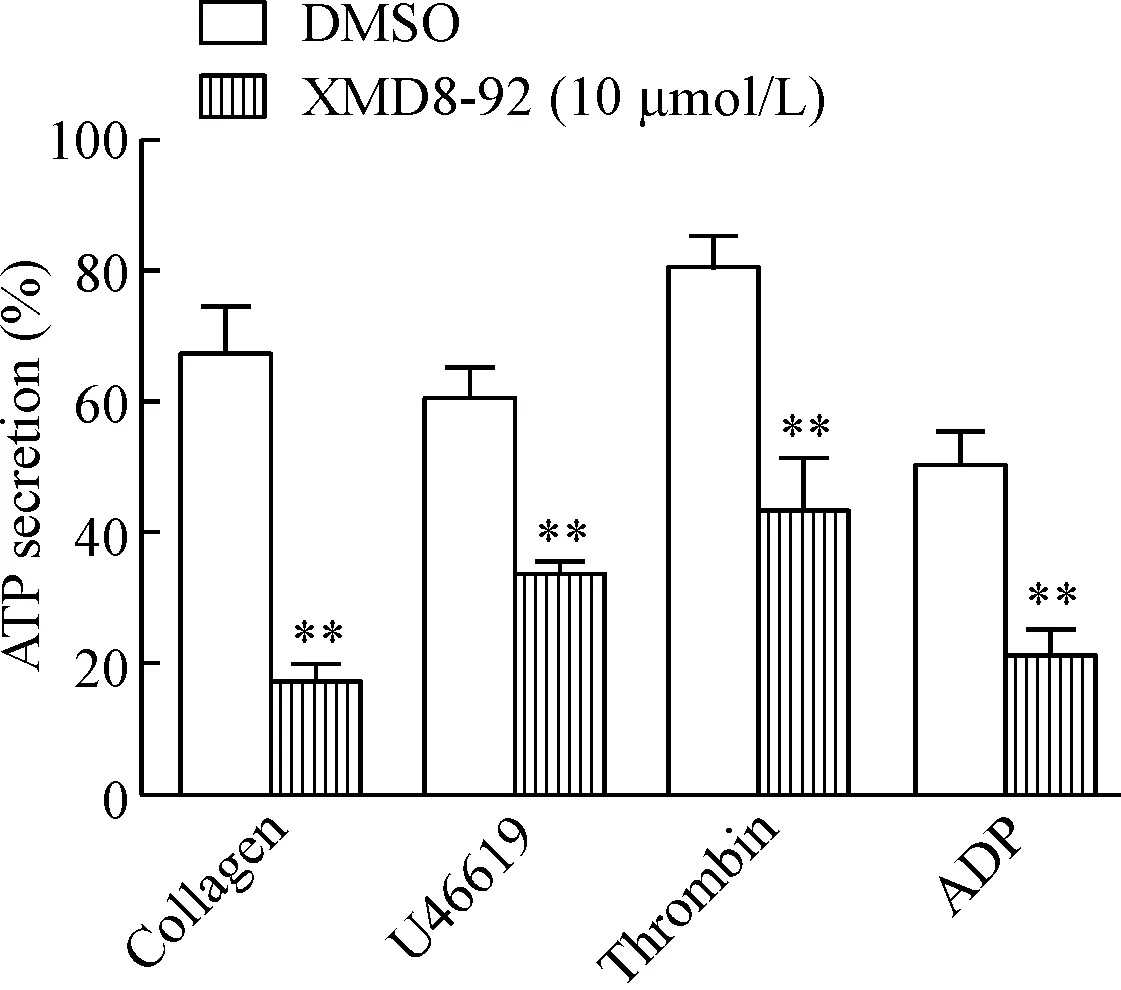
Figure 3. XMD8-92 significantly inhibited collagen-, U46619-, thrombin- and ADP- induced platelet dense granule secretion at 10 μmol/Linvitro. Mean±SD.n=3.**P<0.01vsDMSO.
圖3XMD8-92對ATP分泌的影響
5ERK5對在體血栓形成的影響
我們采用了FeCl3頸動脈損傷模型對ERK5在在體血栓中的作用進行了研究。可以看出,實驗組小鼠第一次穩定動脈血栓形成時間較對照組顯著延長,第一次血栓形成時間在XMD8-92給藥組為(10.40±0.93) min,在對照組為(6.50±0.22) min,兩者差異顯著(P<0.05),見圖6A。給藥30 min后分離血小板進行聚集實驗,發現與對照組相比,XMD8-92(2 mg/kg)給藥后顯著抑制了中濃度膠原誘導的血小板聚集,證明血小板確實受到了抑制劑的抑制作用,見圖6B。因此我們認為,ERK5也參與了在體血栓的形成過程。
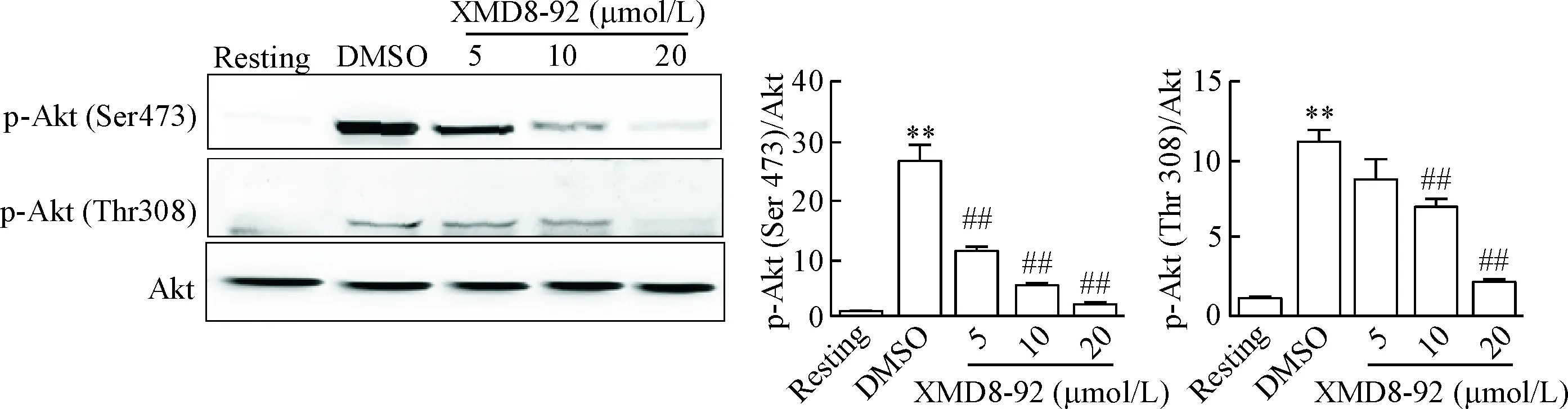
Figure 4. XMD8-92 inhibited Akt phosphorylation in collagen-stimulated platelets. Mean±SD.n=3.**P<0.01vsresting;##P<0.01vsDMSO.
圖4XMD8-92抑制膠原引起的Akt磷酸化
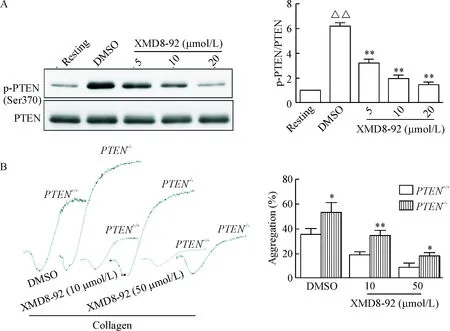
Figure 5. XMD8-92 reduced the phosphorylation level of PTEN at Ser370. A: XMD8-92 inhibited PTEN Ser370 phosphorylation in collagen-stimulated platelets; B:PTENdeficiency reduced inhibition of XMD8-92 on platelet aggregation induced by collagen.Mean±SD.n=3.△△P<0.01vsresting;*P<0.05,**P<0.01vsDMSO.
圖5XMD8-92通過抑制膠原引起的PTEN磷酸化而發揮作用
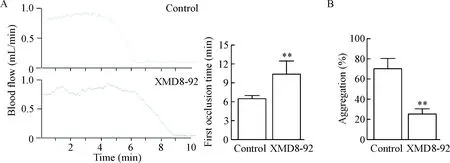
Figure 6. XMD8-92 extended the first occlusion time and decreased the activity of platelet induced by collagen. A: traces of blood flow and the first occlusion time in the carotid arteries of mice intravenously given XMD8-92 or PBS (control); B: anti-platelet effects of XMD8-92 were confirmed byinvitrostudy using platelets from mice intravenously given XMD8-92.Mean±SD.n=5.**P<0.01vscontrol.
圖6尾靜脈給藥XMD8-92延長了小鼠第一次頸動脈血栓的形成時間并降低了血小板對膠原的反應性
討 論
哺乳動物細胞內ERK5參與了多種信號通路,在心臟發育、血管新生和成熟及神經元軸突再生都扮演著非常重要的角色,但其對血小板活化的影響和機制目前尚不十分清楚。我們發現人血小板中也存在ERK5的穩定表達,其磷酸化水平在血小板活化后顯著升高。XMD8-92是一種高選擇性ERK5抑制劑,它通過競爭性抑制ERK5羧基端自磷酸化位點的磷酸化而抑制ERK5的活性,由于該位點為ERK5所特有,目前研究表明該抑制劑對其它MAPK家族成員活性沒有影響[16]。我們采用XMD8-92對血小板進行孵育,發現它對多種刺激劑引起的血小板的聚集和顆粒分泌都有濃度相關的抑制作用。此外,我們對小鼠進行尾靜脈注射ERK5抑制劑后分離血小板,發現血小板的最大聚集程度減低,對注射后的小鼠進行頸動脈血栓實驗,發現第一次頸動脈血栓的形成時間顯著延長。這些研究表明,ERK5通過磷酸化參與了血小板的活化,并參與了動脈血栓的形成。
那么ERK5是通過何機制影響到血小板的活化呢?目前對ERK5底物的研究以轉錄因子為主[17],但血小板沒有細胞核,不存在ERK5的入核調控。多項研究表明,Akt也是ERK5的重要底物[13-14]。我們的研究表明,血小板中也存在ERK5對Akt的調節關系。
PI3K/Akt通路是生物系統中的重要信號通路,也是血小板活化的重要參與者,該通路主要受到限速酶PTEN和PDK1的調控[18]。PTEN作為一種肌糖磷脂磷酸酶,可以通過使3,4,5三磷酸磷脂酰肌醇去磷酸化從而下調PI3K/Akt通路,而在血小板PI3K/Akt通路起到重要的負向調控作用[7, 19]。它以活化態形式存在于血小板中,Ser370位點磷酸化可使其活性下降。我們研究發現,ERK5的抑制劑可下調PTEN Ser370位點的磷酸化使其活性增強,從而抑制Akt的磷酸化水平,而PTEN敲除可部分消除抑制劑的這種影響。因此,我們認為,ERK5通過上調PTEN磷酸化降低PTEN的活性,從而促進PI3K/Akt通路的活化而起到調控血小板活化的作用。我們同時發現,與DMSO相比,ERK5的抑制劑對PTEN-/-小鼠血小板的聚集仍有部分影響,因此,我們認為ERK5可能還可以通過其它通路調節血小板的活化,還有一種可能是由于抑制劑的非特異性,這種可能需要由血小板特異ERK5敲除小鼠來進行驗證。該信號通路的意義還在于,由于PTEN是一種重要的抑癌基因,其活性降低在腫瘤發生發展中都有重要作用,針對ERK5的研究可能會為抗腫瘤藥物的開發提供一種思路。
綜合我們前面的實驗結果,我們認為ERK5在血小板活化中扮演重要角色,并可通過調控Akt的磷酸化調節血小板活化從而參與了動脈血栓的形成。針對ERK5的藥物對在體血栓形成有良好的抑制作用。我們推斷ERK5是很有前景的抗栓靶點。
[1] 隋 輝, 陳偉偉, 王 文.《中國心血管病報告2015》要點解讀[J]. 中國心血管雜志, 2016, 21(4):259-261.
[2] 劉紅利, 李紅蓉, 尹玉潔, 等. 通心絡對新西蘭兔動脈粥樣硬化血小板活化的影響[J].中國病理生理雜志, 2016, 32(6):1106-1111.
[3] Nithianandarajah-Jones GN, Wilm B, Goldring CE, et al. ERK5: structure, regulation and function[J]. Cell Signal, 2012, 24(11):2187-2196.
[4] Cameron SJ, Ture SK, Mickelsen D, et al. Platelet extracellular regulated protein kinase 5 is a redox switch and triggers maladaptive platelet responses and myocardial infarct expansion[J]. Circulation, 2015, 132(1):47-58.
[5] 高 穩, 李 劍, 倪喚春, 等. ERK5在急性心肌梗死患者中的磷酸化水平及對體外血小板激活的影響[J]. 復旦學報: 醫學版, 2017, 44(4):441-446.
[6] Liu J, Jackson CW, Gruppo RA, et al. The β3 subunit of the integrin αIIbβ3 regulates αIIb-mediated outside-in signaling[J]. Blood, 2005, 105(11):4345-4352.
[7] Weng Z, Li D, Zhang L, et al. PTEN regulates collagen-induced platelet activation[J]. Blood, 2010, 116(14):2579-2581.
[8] Flevaris P, Li Z, Zhang G, et al. Two distinct roles of mitogen-activated protein kinases in platelets and a novel Rac1-MAPK-dependent integrin outside-in retractile signaling pathway[J]. Blood, 2009, 113(4):893-901.
[9] Chen X, Zhang Y, Wang Y, et al. PDK1 regulates platelet activation and arterial thrombosis [J]. Blood, 2013, 121(18):3718-3726.
[10] 黃曼婷, 吳煥林, 徐丹蘋. 柚皮素通過PI3K/Akt通路拮抗血小板聚集的體外研究[J]. 中國病理生理雜志, 2017, 33(3):517-522.
[11] Liu J, Fitzgerald ME, Berndt MC, et al. Bruton tyrosine kinase is essential for botrocetin/VWF-induced signaling and GPIb-dependent thrombus formationinvivo[J]. Blood, 2006, 108(8):2596-2603.
[12] O′Brien KA, Stojanovic-Terpo A, Hay N, et al. An important role for Akt3 in platelet activation and thrombosis[J]. Blood, 2011, 118(15):4215-4223.
[13] Wang X, Finegan KG, Robinson AC, et al. Activation of extracellular signal-regulated protein kinase 5 downregulates FasL upon osmotic stress[J]. Cell Death Differ, 2006, 13(12):2099-2108.
[14] Roberts OL, Holmes K, Müller J, et al. ERK5 is required for VEGF-mediated survival and tubular morphogenesis of primary human microvascular endothelial cells[J]. J Cell Sci, 2010, 123(18):3189-3200.
[15] Jacinto E, Facchinetti V, Liu D, et al. SIN1/MIP1 maintains rictor-mTOR complex integrity and regulates Akt phosphorylation and substrate specificity [J]. Cell, 2006, 127(1):125-137.
[16] Yang Q, Deng X, Lu B, et al. Pharmacological inhibition of BMK1 suppresses tumor growth through promyelocytic leukemia protein[J]. Cancer Cell, 2010, 18(3):258-267.
[18] Laurent PA, Severin S, Gratacap MP, et al. Class I PI 3-kinases signaling in platelet activation and thrombosis: PDK1/Akt/GSK3 axis and impact of PTEN and SHIP1[J]. Adv Biol Regul, 2014, 54:162-174.
[19] 吳云婷, 劉 巖, 劉 夢, 等. PTEN在類風濕關節炎成纖維樣滑膜細胞中的表達及意義[J]. 中國病理生理雜志, 2016, 32(6):978-983.
(責任編輯: 盧 萍, 羅 森)
內皮TLR4和腸道菌群引發腦海綿狀血管畸形
腦海綿狀血管畸形(cerebral cavernous malformations, CCMs)是導致中風和癲癇的原因之一,目前還沒有有效的藥物治療方法。CCMs是由于在腦內皮細胞中負調節MEKK3-KLF2/4信號的銜接子復合物的缺失而產生的,但是該疾病通路的上游激活因子尚未被確定。Tang等確認了Toll樣受體4(Toll-like receptor 4, TLR4)和腸道菌群是CCMs形成的關鍵刺激物。通過革蘭陰性細菌或脂多糖激活TLR4,可加速CCMs形成;而在基因或藥理學上阻斷TLR4信號,可防止小鼠CCMs形成。增加 TLR4 基因(或編碼其輔助受體CD14的基因)表達的多態性與人類較高的CCMs損傷負荷相關。無菌小鼠沒有CCMs形成,且單療程的抗生素可永久改變小鼠的CCM易感性。該研究發現,腸道菌群和先天免疫信號在CCMs發病機制中具有意想不到的作用,有望成為CCMs藥物治療的靶點。
Nature, 2017, 545(7654):305-310(李肖肖)
Role of ERK5 in platelet activation in vitro and arterial thrombosis in vivo
GAO Wen, LI Jian, NI Huan-chun, LIU Jun-ling, LUO Xin-ping
(DepartmentofCardiology,HuashanHospitalofFudanUniversity,Shanghai200040,China.E-mail:luoxp206@163.com)
AIM: To investigate the role of extracellular signal-regulated kinase 5 (ERK5) in platelet aggregationinvitroand arterial thrombosisinvivo.METHODSThe expression and phosphorylation levels of ERK5 in human platelet were detected by Western blot. The effects of ERK5 selective inhibitor XMD8-92 on platelet aggregation and dense granule secretion were detected by Chrono-Log aggregometer. The effect of ERK5 oninvivothrombosis was analyzed using an FeCl3artery thrombosis model. The effects of XMD8-92 on protein kinase B (PKB/Akt) and phosphatase and tensin homolog deleted on chromosome ten (PTEN) phosphorylation levels were determined by Western blot.RESULTSERK5 was stably expressed in human platelets and its phosphorylation level increased significantly after platelet activation (P<0.05). XMD8-92, a selective inhibitor of ERK5, inhibited platelet aggregation and dense granule secretion in response to several platelet stimulators (P<0.05). The results of Western blot showed that XMD8-92 inhibited Akt phosphorylation level by down-regulating PTEN Ser370 phosphorylation and enhancing PTEN activity. The pathway was further confirmed using platelet specificPTENdeficiency mice. The first occlusion time was obviously extended in the mice intravenously given XMD8-92 in the FeCl3-induced carotid artery injury model.CONCLUSIONERK5 plays a role in platelet activation and arterial thrombosis by influencing PTEN and Akt phosphorylation.
Extracellular signal-regulated kinase 5; Platelet; Thrombosis; Phosphatase and tensin homolog deleted on chromosome ten
1000- 4718(2017)11- 1958- 06
2017- 04- 17
2017- 05- 17
國家自然科學基金資助項目(No. 81270278);上海市科委基金資助項目(No. 16411965600)
△通訊作者 Tei: 021-52888762; E-mail: luoxp206@163.com
R541.4; R363
A
10.3969/j.issn.1000- 4718.2017.11.006

