萊菔硫烷對糖尿病大鼠視網膜神經細胞的保護作用*
潘 虹, 蔣淑君, 劉紅霞, 于臘梅, 郭 莉
(濱州醫學院生理學教研室, 山東 煙臺 264003)
萊菔硫烷對糖尿病大鼠視網膜神經細胞的保護作用*
潘 虹△, 蔣淑君, 劉紅霞, 于臘梅, 郭 莉
(濱州醫學院生理學教研室, 山東 煙臺 264003)
目的研究萊菔硫烷(SF)對糖尿病大鼠視網膜神經細胞的保護效應,并初步探討其作用機制。方法通過一次性腹腔注射鏈脲佐菌素的方法制備糖尿病大鼠模型;通過測定活性氧簇(ROS)的生成、TUNEL法檢測視網膜細胞的凋亡和計數存活的視網膜神經節細胞(RGCs)等方法作為指標觀察SF對糖尿病大鼠視網膜神經細胞的保護效應;以免疫組織化學染色和Western blot法檢測視網膜核因子E2相關因子2(Nrf2)的核轉移和血紅素加氧酶1(HO-1)的表達變化。結果SF能抑制糖尿病大鼠視網膜ROS的生成,抑制視網膜神經細胞的凋亡并增加糖尿病大鼠視網膜RGCs的存活數量;同時SF還可促進Nrf2的激活及HO-1蛋白表達;使用HO-1抑制劑鋅原卟啉可明顯減弱SF對糖尿病大鼠視網膜RGCs凋亡的抑制作用。結論SF可能通過激活Nrf2/HO-1抗氧化通路改善糖尿病大鼠視網膜氧化應激狀態,減少視網膜神經細胞凋亡,減輕糖尿病大鼠的視網膜損傷。
萊菔硫烷; 糖尿病視網膜病變; 氧化應激; 核因子E2相關因子2; 血紅素加氧酶1
糖尿病(diabetes mellitus,DM)是一種嚴重的慢性病,據世界衛生組織公布的2016年糖尿病國家概況顯示,我國DM患病率逐年升高,2016年我國DM患病率高達9.4%。糖尿病視網膜病變(diabetic re-tinopathy,DR)是DM最為嚴重的眼部并發癥,已成為獲得性致盲的主要原因之一[1]。研究發現DR中視網膜神經細胞的功能損傷發生在臨床可見的視網膜微血管病理改變之前,因此,對于糖尿病引起的視網膜神經細胞損傷的機制研究及防治就顯得尤為重要。
Brownlee[2]提出“糖尿病并發癥的共同機制”學說,認為經典的糖尿病并發癥的多元醇途徑、糖基化終末產物途徑、蛋白激酶C途徑和氨基己糖途徑等均是高糖環境下線粒體呼吸鏈中氧自由基生成過多的結果,即高糖損傷的共同基礎是氧化應激。氧化應激是由細胞或組織的活性氧簇(reactive oxygen species,ROS)堆積或是其抗氧化能力下降形成[2]。事實上ROS生成增加在DR病人和動物模型上都已得到證實[3-5]。因此,在DR中積極抗氧化治療將可能將有效遏制疾病的進展,為患者提供一條新的治療途徑。萊菔硫烷(sulforaphane,SF)作為一種抗氧化劑,是核因子E2相關因子2(nuclear factor E2-related factor 2,Nrf2)重要的激活劑。大量研究顯示,在糖尿病動物模型中,SF對多種組織器官包括腎臟、心臟、血管和腦等均發揮抗氧化保護作用[6-9]。但有關SF對DR的影響尚未見報道。因此,本實驗以鏈脲佐菌素(streptozotocin,STZ)誘導大鼠糖尿病模型,觀察SF對糖尿病大鼠視網膜神經細胞的保護效應,并初步探討其作用機制。
材 料 和 方 法
1動物
SPF級雄性SD種系大鼠,8周齡,體重300~350 g,購于北京維通利華實驗動物技術有限公司,動物合格證編號為SCXK(京)2011-0011。
2主要試劑
3主要方法
3.1動物分組、模型制備及給藥 將SD大鼠隨機分為正常對照(control)組和造模組。將STZ溶解于0.1 mol/L、pH 4.5的檸檬酸-檸檬酸鈉緩沖液中,質量濃度為20 g/L,用時配制。動物禁食不禁水12 h,造模組大鼠均一次性腹腔注射STZ(60 mg/kg),control組大鼠注射相同體積的檸檬酸-檸檬酸鈉緩沖液。造模3 d后,采大鼠尾尖血測空腹血糖,大于16.7 mmol/L視為糖尿病模型造模成功。建模成功后所有大鼠每周監測空腹血糖和體重,不合格者剔除。造模組再隨機分為糖尿病模型組(DM組)、DM+SF組和DM+SF+ZnPP組。DM+SF組大鼠每天腹腔注射SF(12.5 mg/kg),DM+SF+ZnPP 組大鼠每天腹腔注射SF(12.5 mg/kg)和ZnPP(30 mg/kg),control組和DM組大鼠每天腹腔注射等量玉米油,所有組均連續給藥12周。
3.2ROS的測定 大鼠麻醉后,迅速摘除眼球,去除角膜、晶狀體和玻璃體后,將帶有新鮮視網膜的眼杯迅速用OCT包埋并用液氮速凍后,在切片機上切取厚度為10 μm的切片,用37 ℃ PBS(pH 7.4)清洗5 min,用5 μmol/L DHE于37 ℃孵育30 min后,再以37 ℃ PBS清洗3次,用封片劑封片,熒光顯微鏡下綠光激發,觀察和拍攝視網膜細胞紅色發射圖像。隨機選取圖像使用ImageJ軟件測定視網膜神經節細胞層(ganglion cell layer,GCL)、內核層(inner nuclear layer,INL)和外核層(outer nuclear layer,ONL)的吸光度,每個圖像選取5個區域。
3.3TUNEL法檢測視網膜凋亡細胞 將視網膜冰凍切片置于免疫組化濕盒,加入0.3% Trition X-100,室溫靜置20 min,dH2O沖洗2次后加入TdT Reaction Buffer,室溫孵育10 min,去除TdT Reaction Buffer,加入TdT Reaction Cocktail,37 ℃孵育60 min,然后用3% BSA洗片2次,加入Click-iT Reaction Cocktail,室溫避光孵育30 min,3% BSA洗片5 min,用含DAPI的封片劑封片,熒光顯微鏡下觀察并拍照,計數GCL和INL的凋亡細胞數。
3.4免疫組織化學染色法 SD大鼠腹腔注射氯胺酮(80 mg/kg)和噻拉嗪(5 mg/kg)麻醉后,迅速取出眼球,去除角膜、晶狀體、玻璃體后,將眼杯浸入4%多聚甲醛固定1 h之后,再分別浸入10%和20%的蔗糖中梯度脫水,并于30%的蔗糖中4 ℃過夜。OCT包埋后,液氮速凍,在切片機上連續切取厚度為10 μm的切片,切片沿眼球顳鼻軸橫向切割,為了確保實驗的可比性,我們只選取包含視盤的冰凍切片用于實驗。將冰凍切片用PBS清洗3次,用含有3% BSA、0.3% Trition X-100的封閉液,靜置,室溫封閉1 h,然后分別于不同的切片上加入以下 I 抗:兔抗RBPMS多克隆抗體(1∶5 000)、兔抗HO-1多克隆抗體(1∶200)和兔抗Nrf2多克隆抗體(1∶200),4 ℃孵育過夜,用PBS洗3次后,分別加入DyLight 488 標記抗兔IgG (H+L)免疫熒光 II 抗靜置,室溫孵育2 h(從此步驟開始以后均避光)。PBS洗3次后,用含DAPI的封片劑封片,熒光顯微鏡下觀察并拍照,分別計數GCL和INL的RBPMS陽性細胞數及GCL的核聚集Nrf2細胞數。
3.5Western blot法檢測HO-1表達 取各組大鼠視網膜組織,加入RIPA蛋白裂解液,將視網膜組織勻漿后置于EP管中,在冰上靜置10 min,并隔5 min在漩渦混合器上振蕩30 s,離心,取上清,檢測蛋白質濃度,調整蛋白量。取適量裂解產物,進行 SDS-PAGE 分離,完成電泳后將蛋白轉移至 PVDF 膜上,用含5% BSA的TBST溶液室溫封閉1 h后,分別加入 I 抗:兔抗HO-1多克隆抗體(1∶1 000)和鼠抗β-actin單克隆抗體(1∶2 000),4 ℃振蕩孵育過夜,TBST洗膜3次,分別加入 II 抗:山羊抗兔IgG-HRP(1∶2 000)、山羊抗鼠IgG-HRP(1∶4 000)室溫孵育1 h,TBST洗膜3次。在暗室中將膜浸沒于配制好的ECL超敏感光混合液,室溫下反應3 min后,X光膠片壓片曝光,經顯影及定影獲得結果,通過掃描儀掃描膠片圖像輸入計算機,用軟件ImageJ進行圖像分析,以β-actin為內參照,計算HO-1的相對含量。
4統計學處理
總而言之,隨著“互聯網+”時代的來臨,這給我國醫療行業的發展提供了良好的條件,同時也引導了我國醫學院校面臨信息專業人才培育方面的考驗及機會。醫學院校要想給社會培養一批高能力、高素養的專業人才,就要結合當前“互聯網+”背景要求,主動把“互聯網+”與創新創業人才培育教學內容進行結合,引導專業化及創新創業培育人才體系的建設,實現對學生創業精神及意識的培育,在滿足當前醫學領域人才需求的同時,給社會培養大量的綜合型醫療人才,從而促進我國醫療行業的穩定發展。
采用SPSS 16.0對數據進行統計分析。數據以均數±標準差(mean±SD)表示。多組間差異的比較采用單因素方差分析(one-way ANOVA),組間兩兩比較采用Bonferroni校正t檢驗。以P<0.05為差異有統計學意義。
結 果
1SF減少糖尿病大鼠視網膜ROS的產生
Control組視網膜僅可檢測到較低水平的ROS,而DM組大鼠視網膜DHE熒光強度明顯增強(P<0.01),提示DM組大鼠視網膜超氧化物的水平顯著升高;與DM組相比,使用SF治療后,DHE的熒光強度明顯減弱(P<0.01),即ROS的含量顯著降低,見圖1。
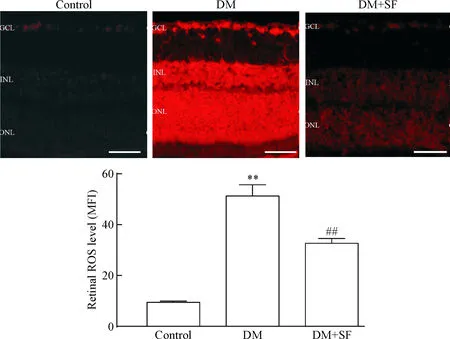
Figure 1. SF reduced ROS generation of retina in diabetic rats. The scale bar=50 μm. MFI: mean fluorescence intensity. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsDM group.
圖1SF減少糖尿病大鼠視網膜ROS的產生
2SF抑制糖尿病大鼠視網膜的神經細胞凋亡
與control組相比,DM組大鼠視網膜TUNEL陽性細胞數量明顯增加(P<0.01),主要分布在INL和GCL,提示糖尿病主要引起視網膜神經細胞凋亡;與DM組相比,給予SF治療后可顯著降低INL和GCL的TUNEL陽性細胞數(P<0.01),見圖2。
3SF對糖尿病大鼠視網膜RGCs的保護作用
采用特異性RGCs抗體RBPMS標記RGCs后顯示,與control組相比,DM組大鼠視網膜RGCs數量明顯減少(P<0.01),而使用SF治療后可顯著增加糖尿病大鼠視網膜RGCs數量(P<0.05),見圖3。
4SF促進糖尿病大鼠視網膜Nrf2的激活
氧化應激條件下,Nrf2聚集到核內,與抗氧化反應元件(antioxidant response element,ARE)結合,調控下游抗氧化酶類的表達,從而減弱細胞的氧化應激損傷。因此,本實驗中我們進一步探討SF對糖尿病大鼠視網膜的保護效應是否與激活Nrf2有關。在control組視網膜中,Nrf2散在分布于胞漿和胞核中;DM組大鼠GCL細胞Nrf2的核聚集增加,表現在核內Nrf2的熒光強度明顯增加(P<0.01);而SF治療后,糖尿病大鼠視網膜GCL細胞Nrf2的核聚集進一步增加。計算GCL Nrf2核轉移的細胞數量,證實使用SF治療后可明顯增加糖尿病大鼠視網膜GCL Nrf2核轉移的細胞數量(P<0.01),見圖4。
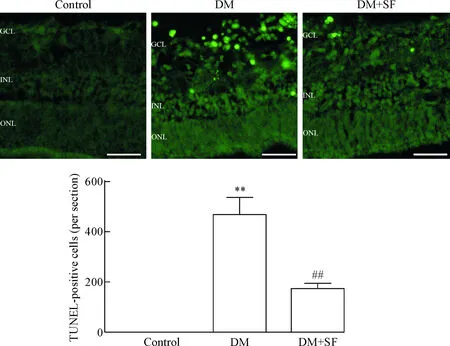
Figure 2. SF inhibited the apoptosis of retina neuronal cells in diabetic rats. The scale bar=50 μm. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsDM group.
圖2SF抑制糖尿病大鼠視網膜的神經細胞凋亡
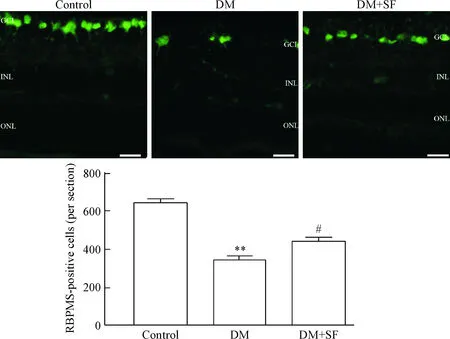
Figure 3. SF protected RGCs in diabetic rats. The scale bar=50 μm. Mean±SD.n=6.**P<0.01vscontrol group;#P<0.05vsDM group.
圖3SF對糖尿病大鼠視網膜RGCs的保護作用
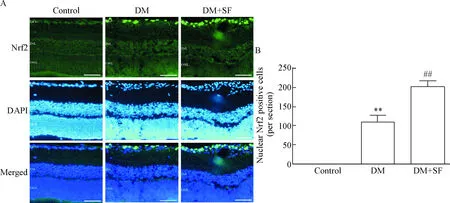
Figure 4. SF enhanced the nuclear accumulation of Nrf2 in retina of diabetic rats. The scale bar=50 μm. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsDM group.
圖4SF促進糖尿病大鼠視網膜Nrf2的激活
5SF上調糖尿病大鼠視網膜HO-1蛋白的表達
Nrf2是調控HO-1表達的轉錄因子之一。本實驗結果顯示control組大鼠視網膜HO-1的熒光強度較弱,DM組視網膜HO-1的熒光強度增加,使用SF治療可進一步增加糖尿病大鼠視網膜HO-1的熒光強度。這些結果通過Western blot實驗進一步得到證實:control組視網膜HO-1的基礎表達水平較低,DM組視網膜HO-1的表達增加,但與control組相比差異無統計學顯著性,SF治療后可使糖尿病大鼠視網膜HO-1的表達顯著增加(P<0.05)。
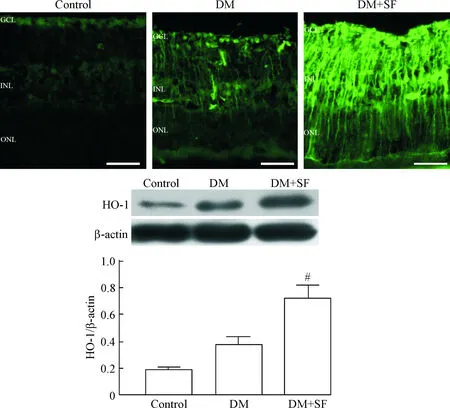
Figure 5. SF up-regulated the expression of HO-1 in retina of diabetic rats. The scale bar=50 μm. Mean±SD.n=6.#P<0.05vsDM group.
圖5SF上調糖尿病大鼠視網膜HO-1蛋白的表達
6抑制HO-1的活性可減弱SF對糖尿病大鼠視網膜RGCs凋亡的抑制作用
為了進一步探討HO-1的蛋白表達變化是否跟SF對糖尿病大鼠視網膜的保護效應有關,我們使用了HO-1的特異性抑制劑ZnPP進行驗證。與DM+SF組相比,使用ZnPP后,大鼠視網膜RBPMS陽性細胞數量顯著減少(P<0.01),即RGCs的凋亡較DM+SF組增多,見圖6。
Figure 6. The inhibitory effects of SF on apoptosis of RGCs in diabetic rats were abolished by the HO-1 inhibitor. The scale bar=50 μm. Mean±SD.n=6.**P<0.01vsDM group;##P<0.01vsDM+SF group.
圖6抑制HO-1的活性可減弱SF對糖尿病大鼠視網膜RGCs凋亡的抑制作用
討 論
本研究結果顯示,SF在糖尿病大鼠視網膜損傷中具有抗氧化應激的效應。糖尿病大鼠視網膜ROS生成明顯增加、RGCs凋亡數量增加,使用SF治療后,不僅減弱了糖尿病大鼠視網膜的損傷,而且同時促進Nrf2的激活及HO-1蛋白表達的增加;進一步研究發現,抑制HO-1的活性可以使SF對糖尿病大鼠視網膜RGCs凋亡的抑制作用明顯減弱,這些結果提示我們,SF對糖尿病大鼠視網膜的保護效應可能是通過Nrf2/HO-1抗氧化通路介導的。
SF是富含于十字花科蔬菜(如西蘭花、孢子甘藍等)中的一種異硫氰酸鹽。大量的研究表明SF作用廣泛,在肝臟、腎臟、心臟、腦等多種組織中發揮抗氧化、抗凋亡、抗癌、抗炎等藥理功能。SF對眼部疾病的保護作用也有相關報道。研究發現SF可以提高人眼視網膜色素上皮細胞的抗氧化應激能力[10],此外在tub/tub小鼠中SF可通過上調Nrf2的表達延遲光感受器細胞的變性[11]。我們以往的研究還發現SF預處理對缺血再灌注視網膜神經元可以起到保護作用[12]。然而,關于SF在DR中對RGCs的作用迄今未見相關研究。大量研究發現糖尿病大鼠視網膜ROS的產生明顯增加[3-4],ROS可攻擊鄰近細胞,導致RGCs死亡[4]。與此結果相一致,我們的實驗發現,與對照組相比,糖尿病大鼠視網膜神經細胞凋亡數量增加、RGCs存活數量明顯減少。給予SF治療后顯著抑制ROS生成的同時,RGCs細胞的凋亡也能明顯減少,這些結果提示SF在糖尿病大鼠視網膜中具有抗氧化和抗凋亡的效應。
作為Nrf2的激動劑以及強效的Ⅱ相解毒酶誘導劑,SF在心、腦、腎等多種組織的糖尿病損傷中發揮重要的保護效應,這些保護作用的發揮依賴于SF誘導產生的一系列保護性的抗氧化酶類的作用,其中HO-1作為應激性反應蛋白質中的一種,在細胞中可對抗應激反應,是神經退行性疾病的有效治療靶點。越來越多的證據顯示HO-1具有強效的內源性抗氧化、抗炎癥和抗凋亡的作用[13-14]。通過藥物誘導HO-1表達上調可起到保護糖尿病大鼠RGCs的作用[14]。而SF可通過促進Nrf2和HO-1的表達從而在糖尿病模型的多種組織中發揮保護作用[6,15]。與這些結果相一致,我們的研究發現SF治療后可顯著增加糖尿病大鼠視網膜Nrf2的核聚集和HO-1的蛋白表達。此外,糖尿病大鼠視網膜Nrf2核聚集明顯增加,內源性HO-1表達亦有一定增加(但差異無統計學顯著性),這可能是機體自身對抗氧化應激的一種暫時的內源性代償機制,而SF誘導產生的Nrf2的核轉移增加和HO-1蛋白表達的增加則是機體的主動激活機制。伴隨著SF誘導的Nrf2/HO-1的表達增加,SF治療后糖尿病大鼠視網膜RGCs的凋亡也明顯減少。由此提示SF對糖尿病大鼠視網膜的保護作用與Nrf2/HO-1抗氧化通路的激活有關。為了明確HO-1是否參與SF對糖尿病大鼠視網膜的保護作用,我們使用HO-1的抑制劑——ZnPP進行了進一步的研究。結果發現,使用ZnPP后明顯減弱SF對糖尿病大鼠視網膜RGCs凋亡的抑制作用。
綜上所述,SF可能是通過促進Nrf2的激活及增加HO-1蛋白表達來發揮對糖尿病大鼠視網膜的保護效應的。SF抗氧化、抗凋亡的這些特性使之有望成為治療DR的理想藥物。
[1] McAuley AK, Sanfilippo PG, Hewitt AW, et al. Vitreous biomarkers in diabetic retinopathy: a systematic review and meta-analysis[J]. J Diabetes Complications, 2014, 28(3):419-425.
[2] Brownlee M. The pathobiology of diabetic complications: a unifying mechanism[J]. Diabetes, 2005, 54(6):1615-1625.
[3] Li J, Wang JJ, Yu Q, et al. Inhibition of reactive oxygen species by Lovastatin downregulates vascular endothelial growth factor expression and ameliorates blood-retinal barrier breakdown indb/dbmice: role of NADPH oxidase 4[J]. Diabetes, 2010, 59(6):1528-1538.
[4] Masuda T, Shimazawa M, Hara H. Retinal diseases associated with oxidative stress and the effects of a free radical scavenger (edaravone)[J]. Oxid Med Cell Longev, 2017, 2017: 9208489.
[5] Neelam K, Goenadi CJ, Lun K, et al. Putative protective role of lutein and zeaxanthin in diabetic retinopathy[J]. Br J Ophthalmol, 2017, 101(5):551-558.
[6] Wu H, Kong L, Cheng Y, et al. Metallothionein plays a prominent role in the prevention of diabetic nephropathy by sulforaphane via up-regulation of Nrf2[J]. Free Radic Biol Med, 2015, 89:431-442.
[7] Bai Y, Cui W, Xin Y, et al. Prevention by sulforaphane of diabetic cardiomyopathy is associated with up-regulation of Nrf2 expression and transcription activation[J]. J Mol Cell Cardiol, 2013, 57:82-95.
[8] Wang Y, Zhang Z, Sun W, et al. Sulforaphane attenuation of type 2 diabetes-induced aortic damage was associa-ted with the upregulation of Nrf2 expression and function[J]. Oxid Med Cell Longev, 2014, 2014:123963.
[9] Wang G, Fang H, Zhen Y, et al. Sulforaphane prevents neuronal apoptosis and memory impairment in diabetic rats[J]. Cell Physiol Biochem, 2016, 39(3):901-907.
[10] Ye L, Yu T, Li Y, et al. Sulforaphane enhances the ability of human retinal pigment epithelial cell against oxidative stress, and its effect on gene expression profile evaluated by microarray analysis[J]. Oxid Med Cell Longev, 2013, 2013:413024.
[11] Kong L, Tanito M, Huang Z, et al. Delay of photoreceptor degeneration in tubby mouse by sulforaphane[J]. J Neurochem, 2007, 101(4):1041-1052.
[12] Pan H, He M, Liu R, et al. Sulforaphane protects rodent retinas against ischemia-reperfusion injury through the activation of the Nrf2/HO-1 antioxidant pathway[J]. PLoS One, 2014, 9(12):e114186.
[13] Song Y, Huang L, Yu J. Effects of blueberry anthocyanins on retinal oxidative stress and inflammation in diabetes through Nrf2/HO-1 signaling[J]. J Neuroimmunol, 2016, 301:1-6.
[14] Fan J, Xu G, Jiang T, et al. Pharmacologic induction of heme oxygenase-1 plays a protective role in diabetic retinopathy in rats[J]. Invest Ophthalmol Vis Sci, 2012, 53(10):6541-6556.
[15] Bai Y, Wang X, Zhao S, et al. Sulforaphane protects against cardiovascular disease via Nrf2 activation[J]. Oxid Med Cell Longev, 2015, 2015:407580.
(責任編輯: 陳妙玲, 余小慧)
Protective effects of sulforaphane on retinal neurons in diabetic rats
PAN Hong, JIANG Shu-jun, LIU Hong-xia, YU La-mei, GUO Li
(DepartmentofPhysiology,BinzhouMedicalCollege,Yantai264003,China.E-mail:pjlndy@163.com)
AIM: To clarify whether sulforaphane (SF) has protective effects on retina neuronal cells in diabetic rats and to identify the related mechanisms involved in this process.METHODSThe diabetic rat model was induced by single intraperitoneal injection of streptozotocin (STZ). The protective effects of SF were evaluated by measuring the generation of reactive oxygen species (ROS), detecting apoptosis of retina neuronal cells with TUNEL staining and counting the survival retinal ganglion cells (RGCs). The nuclear translocation of nuclear factor E2-related factor 2 (Nrf2) and the protein expression of heme oxygenase-1 (HO-1) were examined by immunofluorescence analysis and Western blot.RESULTSSF treatment significantly attenuated ROS generation, decreased the apoptosis of retina neuronal cells and increased the numbers of survival RGCs in the diabetic rats. Meanwhile, SF significantly increased the nuclear accumulation of Nrf2 and the protein level of HO-1 in the retinas of diabetic rats. However, HO-1 inhibitor, protoporphyrin IX zinc (II) diminished the inhibitory effects of SF on RGCs apoptosis.CONCLUSIONSF partially exerts the beneficial neuroprotective effects via the activation of the Nrf2/HO-1 antioxidant pathway, therefore alleviating retinal oxidative stress and decreasing the apoptosis of retina neuronal cells.
Sulforaphane; Diabetic retinopathy; Oxidative stress; Nuclear factor E2-related factor 2; Heme oxygenase-1
1000- 4718(2017)11- 1938- 07
2017- 04- 18
2017- 07- 04
山東省自然科學基金資助項目(No. BS2015YY036; No. ZR2014CM038; No. ZR2013HL009)
△通訊作者 Tel: 0535-6913210; E-mail: pjlndy@163.com
R774.1; R363.2
A
10.3969/j.issn.1000- 4718.2017.11.003

