膽汁酸代謝改變對肝癌發生影響機制的研究
張 婷,董金珂,楊新瑞,杜桂芳,李因茵,盧姍姍,陸蔭英,曲建慧,曾 珍
膽汁酸代謝改變對肝癌發生影響機制的研究
張 婷,董金珂,楊新瑞,杜桂芳,李因茵,盧姍姍,陸蔭英,曲建慧,曾 珍
目的探討膽汁酸(bile acids, BAs)各組分在乙型肝炎(乙肝)相關性肝細胞癌(hepatocellur carcinoma,HCC)患者血漿中的濃度及組成比例變化,進一步探索其與HCC的關系。方法用液相色譜-質譜聯用手段分別檢測24例HCC患者、15例乙肝肝硬化患者、6例慢性乙肝患者及12例健康對照者血漿中的各BAs組分的變化。用實時熒光定量PCR與免疫組織化學法檢測15例肝癌組織與癌旁組織中IL-1β的表達水平。結果在24例HCC患者中,BAs組分膽酸、鵝脫氧膽酸、牛磺脫氧膽酸、石膽酸、甘氨鵝脫氧膽酸、甘氨脫氧膽酸相比乙肝肝硬化與健康對照組有明顯升高,差異均有統計學意義(P均<0.05),其中石膽酸濃度在不同臨床分期患者中差異有統計學意義,C期明顯高于B期和A期。癌組織中IL-1β的表達水平低于癌旁組織。結論血漿膽汁酸中石膽酸的濃度增高與肝癌進展相關,有可能成為HCC進展的評價指標。
乙肝相關肝細胞癌;膽汁酸;IL-1β;靶向代謝組學
HBV在我國廣為傳播,感染了HBV的機體為了清除病原體而引起的長期慢性肝臟炎癥,逐步發展成為肝纖維化,進而成為肝硬化。持續性的肝損傷及不斷發生的肝細胞增殖和凋亡,誘導了約80%的肝細胞癌(hepatocellur carcinoma,HCC)的發生[1],HCC是世界第6大惡性腫瘤而且預后效果極差[2]。肝功能的損害可造成機體膽汁酸(bile acids, BAs)代謝的紊亂。BAs是由膽固醇代謝產生的一類兩性分子的總稱,其作用功能涉及脂質的消化、吸收及激素的合成[3]。在肝臟病理狀態下,BAs代謝障礙表現為患者血漿中BAs水平增高,組成比例失衡。
本文通過液相色譜-質譜聯用手段分別檢測HCC患者及對照者血漿中的各BAs組分的變化,并通過實時熒光定量PCR(quantitative real-time PCR, RT PCR)與免疫組織化學法檢測HCC患者肝癌組織與癌旁組織中IL-1β的表達水平,探討BAs各組分的變化與HCC發生發展的關系。
1 材料與方法
1.1 標本來源及處理 血漿標本均為EDTA抗凝外周血血漿。其中慢性乙型肝炎患者(后簡稱HBV組)(6例)、乙型肝炎肝硬化(HBV related liver cirrhosis, HBV-LC)患者(15例)、HCC患者(24例,A期/B期/C期,10/7/7例)血漿標本取材均來自解放軍第三〇二醫院肝臟腫瘤診療與研究中心。 健康對照者(health control,HC)血漿標本均來自解放軍第三〇二醫院體檢中心,共12例(表1)。肝組織標本共15例,均來自上述24名HCC患者的手術切除組織。
1.2 診斷與分期標準 HCC患者均為慢性乙型肝炎HCC患者,其診斷符合《原發性肝癌診療規范》(2017年)的標準[4]。HCC診斷:①具有肝硬化以及HBV感染診斷證據;②同期多排CT掃描和/或動態對比增強MRI檢查顯示肝臟占位在動脈期快速不均質血管強化,而靜脈期或延遲期快速洗脫;③血清AFP≥400 μg/L持續1個月或≥200 μg/L持續2個月,并能排除其他原因引起的AFP升高,包括妊娠、生殖系胚胎源性腫瘤、活動性肝病及繼發性肝癌等。HCC的臨床慢性乙型肝炎及HBV-LC的診斷依據《慢性乙型肝炎防治指南》(2015年版)[5]。1.3 試劑和儀器 所用的試劑:EDTA抗凝采血管(BD),BAs各組分標準品(Sigma),甲醇、乙腈均為色譜純,RT PCR所用引物(北京賽百盛公司合成),cDNA合成試劑盒(Thermal Fisher), RT PCR試劑盒(ABI),兔抗人IL-1β一抗(Abcam),羊抗兔二抗(中山金橋)。所用的儀器為:Eksigent LC100和AB SCIEX Triple TOF 5600+(Waters);色譜柱,Waters XBridge Peptide BEH C18 3.5 μm,2.1×100 mm(Waters);預柱,Phenomenex C18,4×20 mm(Waters)。
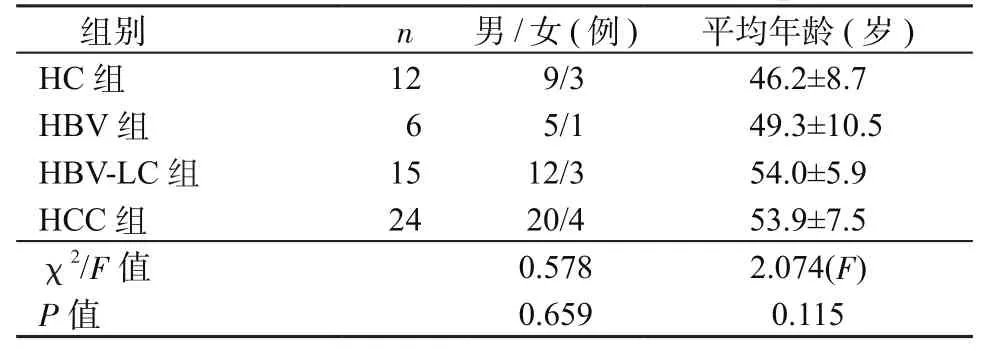
表1 標本基本臨床資料Table 1 Basic clinical data of the samples
1.4 血漿樣品處理 -80 ℃低溫保存的干燥后血漿樣品,4 ℃解凍。定量量取約50 μl于1.5 ml EP管中,加入 0.5 μg/ml內標溶液 10 μl,冷蛋白沉淀液 300 μl,渦旋45 s,4 ℃,16 000 × g離心10 min,取上清液200 μl,吹干。用甲醇 50 μl復溶,進樣 5 μl。
1.5 BAs檢測方法 BAs標準品儲備液配制,取適量BAs粉末溶于水-乙腈-異丙醇溶液 (水∶乙腈∶異丙醇=10∶6∶5),配制成濃度為10 mg/ml溶液。色譜條件為柱溫40 ℃;流速為0.4 ml/min;流動相:A相,水+0.1%甲酸+10 mM乙酸胺;B相,80%甲醇+20%乙腈+0.1%甲酸。質譜條件,噴霧電壓2.0 kV;毛細管溫度,275 ℃;S-lens,55%;碰撞能量,27% HCD;分辨率設置,一級70 000@m/z 200,二級17 500@m/z 200;母離子掃描范圍,m/z 300~1800;子離子掃描范圍,m/z>100。參照BAs標準品數據庫,用PeakView 1.2軟件將樣品中的BAs定性,用MultiQuant2.1對定性的BAs定量,用樣品中的內標校正后,用標準曲線計算相應濃度。
1.6 RT PCR法檢測肝組織中IL-1β的表達水平 分離肝癌組織與癌旁組織,分別取約2 mg組織用液氮研磨,抽提總RNA,以總RNA為模板反轉錄合成cDNA。IL-1β引物為F 5’-TTACAGTGGCAATGAGGATGAC-3’;R 5’-GTCGGAGATTCGTAGCTGGAT-3’; 內 參 為β-Actin。RT PCR條件為95 ℃預變性3 min;95 ℃變性30 s,60 ℃退火延伸1 min,循環40次。
1.7 免疫組織化學法檢測肝組織中IL-1β的表達量 肝癌組織切片脫蠟處理后,經抗原修復,一抗、二抗按照1∶1000稀釋后分別染色,蘇木素核顯色,細胞核呈深藍色,IL-1β呈紅色。
1.8 統計學處理 用SPSS 20.0軟件分析。定量資料呈正態分布者以x±s表示,組間比較用成組t檢驗或F檢驗(組間方差齊)。患者血漿BAs各組分濃度均為非正態分布,多組比較采用Kruskal-Wallis檢驗,組間兩兩比較用Mann-Whitney檢驗,雙側檢驗,P<0.05表示差異有統計學意義。
2 結 果
2.1 BAs各組分濃度 采用液相色譜-質譜聯用檢測HC組、HBV組、HBV-LC組與HCC組血漿中BAs各組分濃度的變化,結果如圖1所示,HCC組中膽酸(cholic acid, CA)、熊去氧膽酸(ursodeoxycholic acid, UDCA)、甘氨熊去氧 膽 酸(glycoursodeoxycholic acid, GUDCA)、鵝脫氧膽酸(chenodeoxycholic acid, CDCA)、牛磺脫氧膽酸(tauro ursodesoxy cholic acid,TDCA)、 石 膽酸(lithocholic acid, LCA)、甘氨膽酸(glycocholic acid, GCA)、甘氨鵝脫氧膽酸(glycochenodeoxycholic acid, GCDCA)、甘氨脫 氧 膽 酸(glycochenodeoxycholic acid, GDCA)的濃度相比HC組有明顯升高,差異有統計學意義。其中,HCC組CA、CDCA、LCA、GCDCA、TDCA、GDCA的濃度與HBV-LC組也有明顯升高,差異具有統計學意義。其他BAs如HDCA、DCA、GLCA、TCA、TUDCA等濃度的組間變化差異沒有統計學意義,具體結果見圖1。
2.2 不同HCC臨床分期BAs組分濃度 HCC組中有明顯變化的CA、CDCA、TDCA、LCA、GCDCA、GDCA濃度在HCC不同臨床分期(A、B、C期)患者中比較結果見圖2,僅LCA濃度在不同臨床分期患者中差異有統計學意義,C期明顯高于B期和A期,而B期與A期差異無統計學意義。BAs其余組分在各臨床分期差異無統計學意義。
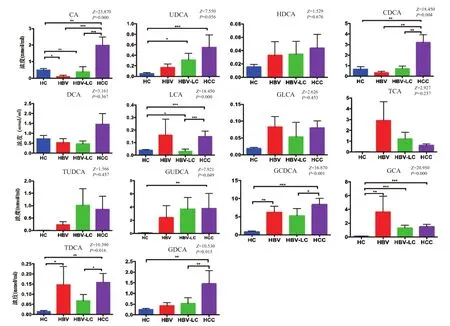
圖1 HCC組(n=24)、HBV-LC組(n=15)、HBV組(n=6)、HC組(n=12)血漿中BAs各組分濃度變化*. P0.05;**. P<0.050.01;***. P<0.050.001;注:各圖橫標目為組別Figure 1 Bile acids concentration in plasma of HCC patients (n=24), HBV-LC patients (n=15), HBV patients (n=6) and health controls (n=12)

圖2 不同分期HCC患者血漿中CA、CDCA、TDCA、LCA、GCDCA、GDCA的濃度*. P0.05;**. P0.01;***. P<0.050.001;注:各圖橫標目為臨床分期Figure 2 CA, CDCA, TDCA, LCA, GCDCA and GDCA concentration in plasma of HCC patients at different stages
2.3 BAs在癌旁組織及癌組織中IL-1β的表達的影響 本文通過RT PCR對15例HCC組患者肝癌組織與癌旁組織中IL-1β的表達水平進行檢測。RT PCR結果顯示,癌旁組織中IL-1β的表達水平為(1.02±1.27)×10-3,癌組織中的表達水平為(0.21±0.22)×10-3, 2者表達水平差異具有統計學意義(t=2.423,P=0.001),見圖3A。免疫組織化學結果顯示癌旁組織中IL-1β的表達量高于癌組織,見圖3B。
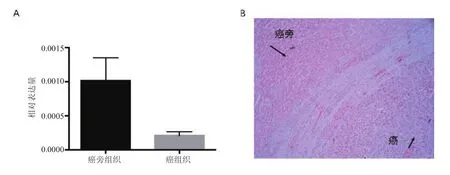
圖3 肝癌組織與癌旁組織中IL-1β的表達水平A. RT PCR;B. 免疫組織化學(20×)Figure 3 Expression of IL-1β in liver cancer tissue and paracancer tissue
3 討 論
BAs是由膽固醇代謝產生的一類兩性分子的總稱,其功能涉及脂質的消化、吸收及激素的合成[6]。肝臟對BAs有高效清除作用,使BAs濃度維持在較低水平,故外周血血漿中BAs含量甚微。在人類肝臟中,膽固醇經代謝轉化為初級BAs,包括CA及CDCA,隨后進入腸道進一步轉化為相應的次級BAs。CA、CDCA在結直腸內經過腸道細菌及其膽鹽水解酶的解離,差向異構化,氧化及7α脫羥基活性等生物轉化作用生成次級BAs如脫氫膽酸(deoxycholic acid, DCA)和LCA等[3,7-8]。約95%的次級BAs被腸道重吸收,經門靜脈重新回到肝臟,與新合成的結合BAs一起再經過膽道排入腸道,稱為BAs的肝-腸循環[9]。在生理狀態下,上述過程受到一系列正、負反饋機制的精細調節,體內眾多核受體如法尼酯受體、肝X受體、過氧化物酶體增值物激活受體、孕烷X受體以及跨膜G蛋白受體等參與BAs穩態的調節[10-11]。因此,血漿中BAs的測定能反映肝細胞合成、攝取及分泌功能。BAs異常不僅反映了肝臟的損害程度,也間接反映了肝內的膽/血屏障情況。有研究表明,肝硬化患者乃至HCC患者血清的總BAs濃度要明顯高于健康人群[12-13]。本研究顯示,HCC組中血漿 BAs中 CA、CDCA、TDCA、LCA、GCDCA及GDCA的濃度明顯高于HBV-LC組與HC組,不同HCC臨床分期BAs濃度比較顯示,僅LCA濃度在不同分期差異有統計學差異。
研究發現CDCA及代謝產物DCA、LCA可對細胞內炎癥小體NLRP3的活性產生雙向調節,并影響肝癌形成[14]。而另有研究發現次級BAs LCA可以抑制骨髓來源的巨噬細胞(BMDMs)中NLRP3炎癥小體介導的Caspase-1活化,以及下游IL-1β的分泌[15]。同時有研究表明,肝臟中癌組織中NLRP3表達水平低于癌旁組織,同時IL-1β在癌組織的表達水平也低于癌旁組織[16]。本文RT PCR與免疫組織化學的結果也顯示,血漿BAs濃度高的患者癌組織中IL-1β表達水平明顯低于癌旁組織。由此推測,HCC中癌變的肝組織抑制肝臟對BAs的吸收,而過量的BAs如LCA通過抑制炎癥小體進而抑制肝臟免疫功能,進一步促進肝臟癌變。結合血漿BAs中LCA的濃度與HCC進展呈正相關,可以推論血漿中BAs中LCA濃度的高低可能成為肝癌發生進展與免疫功能的評價指標。
[1] Kuraishy A, Karin M, Grivennikov SI. Tumor promotion via injury- and death-induced inflammation[J]. Immunity, 2011,35(4):467-477.
[2]VoPham T, Bertrand KA, Hart JE, et al. Pesticide exposure and liver cancer: a review[J]. Cancer Causes Control, 2017,28(3):177-190.
[3]Chiang JYL. Bile acids: regulation of synthesis[J]. J Lipid Res,2009, 50(10):1955-1966.
[4] 中華人民共和國國家衛生和計劃生育委員會. 原發性肝癌診療規范(2017 年版)[J].傳染病信息,2017,30(3):I-XVII.
[5] 中華醫學會肝病學分會,中華醫學會感染病學分會.《慢性乙型肝炎防治指南》(2015更新版)[J].傳染病信息,2015,6(28):321-340.
[6]Qi Y, Jiang C, Cheng J, et al. Bile acid signaling in lipid metabolism: metabolomic and lipidomic analysis of lipid and bile acid markers linked to anti-obesity and anti-diabetes in mice[J].Biochimica Et Biophysica Acta, 2015, 1851(1):19-29.
[7]Hylemon PB, Zhou H, Pandak WM, et al. Bile acids as regulatory molecules[J]. J Lipid Res, 2009, 50(8):1509-1520.
[8]Martinot E, Sèdes L, Baptissart M, et al. Bile acids and their receptors[J]. Mol Aspects Med, 2017, 56:2-9.
[9]Arab JP, Karpen SJ, Dawson PA, et al. Bile acids & nonalcoholic fatty liver disease: molecular insights and therapeutic perspectives[J]. Hepatology, 2017, 65(1):350-362.
[10]Gong Z, Zhou J, Zhao S, et al. Chenodeoxycholic acid activates NLRP3 inflammasome and contributes to cholestatic liver fibrosis[J]. Oncotarget, 2016, 7(51):83951-83963.
[11]Cd DMF, Downes M, Evans R. Bile acid analog intercepts liver fibrosis[J]. Cell, 2016, 166(4):789-789.
[12]曹龍翎. 肝病患者血清總膽汁酸和膽堿酯酶水平測定的臨床意義[J]. 海南醫學院學報,2009,15(4):362-363.
[13]Wang H, Shang X, Xing W, et al. Increased hepatocellular carcinoma risk in chronic hepatitis B patients with persistently elevated serum total bile acid: a retrospective cohort study[J].Sci Rep, 2016, 6:38180.
[14]Watanabe A, Sohail MA, Gomes DA, et al. Inflammasomemediated regulation of hepatic stellate cells[J]. Am J Physiol Gastrointest liver physiol, 2009, 296(6):G1248-G1257.
[15]Guo C, Xie S, Chi Z, et al. Bile acids control inflammation and metabolic disorder through inhibition of nlrp3 inflammasome[J].Immunity, 2016, 45(4):802-816.
[16]Wei Q, Mu K, Li T, et al. Deregulation of the NLRP3 inflammasome in hepatic parenchymal cells during liver cancer progression[J].Laboratory Investigation, 2014, 94(1):52-62.
Influence of bile acid metabolism changes on pathogenesis of hepatocellular carcinoma
ZHANG Ting, DONG Jin-ke, YANG Xin-rui, DU Gui-fang, LI Yin-yin, LU Shan-shan, LU Yin-ying, QU Jian-hui, ZENG Zhen*Comprehensive Liver Cancer Center, 302 Military Hospital of China, Beijing 100039, China
ObjectiveTo investigate the changes of serum bile acids (BAs) concentration and components in patients with HBV related hepatocellur carcinoma (HCC), and explore the relationship between BAs and HCC.MethodsLiquid chromatography mass spectrometry was used to detect the concentration of serum BAs in 24 HCC patients, 15 HBV related liver cirrhosis patients, 6 chronic HBV hepatitis patients and 12 healthy controls. The expression levels of IL-1β in liver tissues and paracancer tissue were detected by real-time PCR and immunohistochemistry in 15 liver cirrhosis cases.ResultsThe cholic acid, chenodeoxycholic acid, tauro ursodesoxy cholic acid, lithocholic acid, glycochenodeoxycholic acid, glycochenodeoxycholic acid concentrations were significantly higher in 24 HCC patients than those in the heath control and liver cirrhosis group (P<0.05). The concentrations of lithocholic acid (LCA) were positively correlated with the clinical stage of HCC and showed significant differences in different stages, the concentration at stage C was obviously higher than that at stage B and stage A. The expression level of IL-1β in cancer tissues was lower than that in adjacent tissues.ConclusionsThe increase of plasma bile acid LCA is correlated with the development of liver cancer. It may be an evaluation index for the progress of HCC.
hepatitis B virus related hepatocellular carcinoma; bile acid; IL-1β; targeted metabolomics
R735.7
A
1007-8134(2017)05-0293-05
10.3969/j.issn.1007-8134.2017.05.012
國家自然科學基金面上項目(81372248,81672467)
100039 北京,解放軍第三〇二醫院肝臟腫瘤診療與研究中心(張婷、楊新瑞、杜桂芳、李因茵、盧姍姍、陸蔭英、曲建慧、曾珍);550004 貴陽,貴州醫科大學(董金珂)
曾珍,E-mail: zengzhen1970@sina.com
*Corresponding author, E-mail: zengzhen1970@sina.com
(2017-03-24收稿 2017-07-18修回)
(本文編輯 閆晶晶)

