穩定表達GFP-Parkin融合蛋白的SH-SY5Y細胞系的建立和功能初探
趙海洲,莫燦坤,林展樂,劉文華
肇慶學院 生命科學學院,廣東 肇慶 526061
穩定表達GFP-Parkin融合蛋白的SH-SY5Y細胞系的建立和功能初探
趙海洲,莫燦坤,林展樂,劉文華
肇慶學院 生命科學學院,廣東 肇慶 526061
目的:建立穩定表達GFP-Parkin的SH-SY5Y細胞系,并檢測Parkin對MPP+引起的SH-SY5Y細胞損傷的保護作用。方法:將Parkin編碼序列克隆到載體pEGFP-C1中,構建重組質粒pEGFP-Parkin,轉染SH-SY5Y細胞,通過G418篩選,建立穩定表達GFP-Parkin的SH-SY5Y細胞系;熒光顯微鏡和Western印跡鑒定Parkin表達,MTT法檢測Parkin對MPP+致細胞損傷的保護作用。結果:酶切鑒定及測序結果表明重組質粒pEGFP-Parkin構建正確;熒光顯微鏡下可見細胞內有GFP-Parkin的融合表達,Western印跡檢測發現相對分子質量79×103的蛋白條帶;MTT結果顯示Parkin能夠減弱MPP+對SH-SY5Y細胞的損傷,與對照組相比,存活率高約15%,差異顯著(P<0.05)。結論:構建了穩定表達GFP-Parkin的SH-SY5Y細胞系,為進一步研究Parkin的細胞保護作用和其他功能機制奠定了基礎。
Parkin蛋白;SH-SY5Y細胞;穩定表達;MPP+
帕金森病(Parkinson's disease,PD)是第二大常見的神經退行性疾病,主要特征表現為靜止性震顫、肌僵直、姿勢異常及記憶力減退等。85%~90%的帕金森病患者呈散發性,其發病與農藥、重金屬等環境因素息息相關[1]。此外,帕金森病也存在家族遺傳性,5%~15%的帕金森病患者由單基因家族遺傳方式引起,這些基因包括Parkin(PARK2)、DJ-1(PARK7)、ATP13A2(PARK9)、PTEN-induced putative kinase 1(PINK1)、LRRK2(PARK8)和 SNCA(PARK1,4)等[2]。
Parkin基因于1998年被克隆,其突變呈現常染色體隱性遺傳的青少年型帕金森病(autosomal recessive juvenile parkinsonism,ARJP)[3]。該基因定位于染色體6q25.2-27,位于遺傳標記D6S305和D6S253之間,含12個外顯子,基因的開放讀框為1395bp,所編碼的蛋白Parkin含465個氨基酸殘基。Parkin基因的缺失和位點突變與ARJP相關[4-5]。Parkin是一種E3泛素連接酶,在上游基因PINK1的啟動下,Parkin可以識別異常折疊蛋白,介導底物蛋白泛素化,進而通過泛素-蛋白酶體途徑降解異常折疊蛋白[6]。Parkin還參與氧化應激及線粒體的自噬、形態維持和功能調控等[7-8]。過表達Parkin可以保護MPTP或6-OHDA引起的毒性損傷[9-10]。Parkin在神經和非神經組織中都有表達。在腦組織中,Parkin的亞細胞定位廣泛,包括線粒體、高爾基體、突觸小泡、內質網和細胞核等[11-13];在培養的細胞中,Parkin的亞細胞定位還存在爭議[14-15]。
轉基因細胞模型是研究Parkin在細胞內的定位、功能,以及與其他蛋白相互作用的重要工具,已廣泛用來研究Parkin與PD的關系[16-18]。以往在研究Parkin功能及其相關機制時常采用瞬時轉染,但瞬時轉染因存在轉染效率低、外源基因低表達等問題,而不利于精確闡明Parkin在細胞中的定位、功能等。因此,建立穩定表達細胞系有利于深入研究其功能機制。
我們構建了穩定表達融合蛋白GFP-Parkin的SH-SY5Y細胞系,為深入研究Parkin的定位和其他功能機制提供了可靠的細胞模型。
1 材料和方法
1.1 材料
SH-SY5Y細胞購自中國典型培養物保藏中心(武漢);胎牛血清、DMEM高糖培養基、胰蛋白酶、PBS為 Gibco公司產品;MTT、MPP+、G418為Sigma公司產品;BCA蛋白定量試劑盒、細胞裂解液購自碧云天公司;ECL發光液購自Tanon公司;抗體GFP來自Cell Signaling Technology公司,抗體actin、PRK8購自Santa Cruz Biotechnology公司;山羊抗兔二抗購自Merk Millipore公司;質粒提取試劑盒、膠回收試劑盒購自Omega公司;Lipo?fectAMINE 3000、蛋白marker、EB、EcoRⅠ和BamHⅠ來自Thermo Fisher Scientific公司;DNA marker購自廣州東盛生物科技有限公司;其他試劑為國產分析純產品。
1.2 Parkin基因的擴增
以pCMV-Tag2B-Parkin質粒(本實驗室保存)為模板,引物1為5'-GCGCGAATTCTATGATAGT GTTTGTCAGGTTC-3',引 物 2 為 5'-GCGCGGATC CCTACACGTCGAACCAGTGG-3',分別添加酶切位點EcoRⅠ和BamHⅠ,PCR擴增出人源Parkin編碼序列。
1.3 重組表達載體的構建及鑒定
上述PCR產物經10g/L瓊脂糖凝膠分離,用膠回收試劑盒對目的片段切膠回收,將PCR膠回收產物和pEGFP-C1質粒分別用限制性內切酶EcoRⅠ/BamHⅠ雙酶切,用T4DNA連接酶連接,轉化大腸桿菌DH5α感受態,卡那霉素篩選并挑取陽性單克隆菌落,菌落于37℃培養過夜,用質粒提取試劑盒提取重組質粒,經EcoRⅠ/BamHⅠ雙酶切初步鑒定,DNA測序進一步確認。測序鑒定采用通用引物,上游引物為EGFP-Cfor(5'-AG CACCCAGTCCGCCCTGAGC-3'),下 游 引 物 為SV40-pArev(5'-GAAATTTGTGATGCTATTGC-3')。
1.4 細胞培養
SH-SY5Y細胞用含10%胎牛血清的無抗生素DMEM培養基,在恒溫37℃、含5%CO2的細胞培養箱中培養,每隔2~3d細胞傳代一次,用對數期細胞進行實驗。
1.5 穩定表達GFP-Parkin細胞系的建立
轉染前將SH-SY5Y細胞接種于6孔板中,細胞密度為1×105/孔,待細胞生長至70%~80%融合度,用 LipofectAMINE 3000轉染 pEGFP-Parkin,同時設未轉染和轉染載體pEGFP-C1的對照。轉染方法參照試劑盒說明書。轉染后48h,將細胞培養液更換為含600μg/mL G418的DMEM培養基,篩選陽性克隆,之后每隔3d更換一次培養基(含600μg/mL G418)。
轉染3周后,對表達綠色熒光的陽性細胞用含300μg/mL G418的DMEM培養基維持培養。每天在熒光顯微鏡下觀察細胞,陽性細胞用于后續實驗,部分細胞凍存備用。
1.6 細胞形態學觀察
對挑選的陽性細胞每天用熒光倒置顯微鏡觀察并拍照,觀察內容包括細胞生長的快慢、突觸生長、細胞貼壁、細胞形態變化,以及細胞內的熒光強度等。
1.7 MTT法檢測細胞存活率
SH-SY5Y細胞按1×104/孔接種于96孔培養板,鋪板后24h用于實驗。實驗設立空白組(只有培養基,無細胞)、對照組(不加藥物)和藥物組(1mmol/L MPP+處理)。實驗每組設3個復孔,藥物作用 48h后每孔加入200μL MTT(0.5 mg/mL),孵育4h,棄上清,加入150μL DMSO溶解甲瓚,用酶標儀測定D490nm值。細胞存活率(%)=(藥物組D490nm-空白組D490nm)/(對照組D490nm-空白組D490nm)×100%。實驗重復3次。
1.8 Western印跡檢測Parkin的表達
用6cm培養皿傳代培養細胞,待細胞達到90%~100%融合度,用PBS洗1次,將細胞刮下,12 000r/min離心1min,棄上清,加入細胞裂解液至細胞沉淀,冰上裂解細胞20min,15 000r/min離心10min后取上清。Western印跡檢測Par?kin、actin的表達,分離膠濃度10%,電泳后轉膜,加相應的一抗(GFP、Parkin和actin)、二抗孵育,ECL法顯影,化學發光成像系統拍照。
1.9 統計學分析
實驗結果數據分析采用SPSS 22.0軟件進行,數據以x±s表示,采用單因素方差分析(ANOVA)和t檢驗,P<0.05認為差異具有統計學意義。
2 結果
2.1 重組質粒的構建與鑒定
如圖1A所示,PCR產物經瓊脂糖凝膠電泳檢測,可以看到1.4kb左右的條帶(白色箭頭所示),與預期大小相符。
本研究所構建的pEGFP-Parkin重組質粒是將人源Parkin編碼序列通過EcoRⅠ/BamHⅠ雙酶切位點插入pEGFP-C1載體。重組質粒EcoRⅠ/BamHⅠ雙酶切結果如圖1B所示,可見1.4kb(目的基因大小)和4.7kb(載體大小)2條片段,與預測結果相符,表明質粒構建成功。進一步DNA測序結果也顯示Parkin基因成功構建于pEGFP-C1載體上,與GenBank登錄序列(AB009973)進行序列比對,序列完全一致(序列未示)。
2.2 熒光顯微鏡檢測GFP-Parkin的表達
用質粒pEGFP-C1和pEGFP-Parkin轉染SHSY5Y細胞,經G418選擇性培養。用熒光顯微鏡檢測穩定表達載體質粒pEGFP-C1的細胞(命名為SH/GFP)和穩定表達pEGFP-Parkin的細胞(命名為SH/GFP-Parkin)的熒光情況。結果顯示(圖2),SH/GFP和SH/GFP-Parkin細胞都可以穩定表達綠色熒光(圖2D和F),可用于后續實驗。
2.3 Western印跡檢測GFP-Parkin的表達
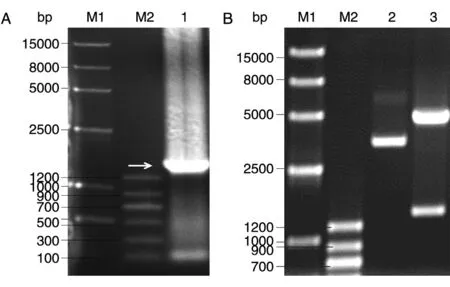
圖1 Parkin基因擴增和重組質粒鑒定
分別用GFP抗體和PRK8抗體對蛋白進行檢測。GFP抗體檢測顯示(圖3A),穩定轉染載體質粒pEGFP-C1的SH/GFP細胞可見相對分子質量約27×103的GFP條帶;穩定轉染pEGFP-Parkin的SH/GFP-Parkin細胞有相對分子質量約79×103的蛋白條帶,與GFP-Parkin的預測相對分子質量相符。PRK8抗體檢測也發現,SH/GFP-Parkin細胞可見79×103的 GFP-Parkin融合蛋白(圖3B)。這表明在蛋白水平上,Parkin基因在SH/GFP-Parkin細胞中穩定表達。
2.4 Parkin對MPP+損傷的保護作用
MTT實驗結果(圖4A)表明,經1mmol/L MPP+處理 48h,載體組細胞(SH/GFP)存活率為(43.9±3.9)%,穩定表達 Parkin組細胞(SH/GFPParkin)存活率為(58.9±8.4)%,Parkin穩定表達組細胞比載體組細胞存活率高約15%,差異顯著(P<0.05)。這表明Parkin可以部分抑制 MPP+對SH-SY5Y的損傷。
圖4B顯示,不經MPP+處理的正常細胞呈梭形,而SH/GFP細胞經1mmol/L MPP+作用48h后,較多細胞皺縮變圓;SH/GFP-Parkin細胞經1mmol/L MPP+作用48h后,較少細胞變圓。該結果與MTT實驗結果相符。
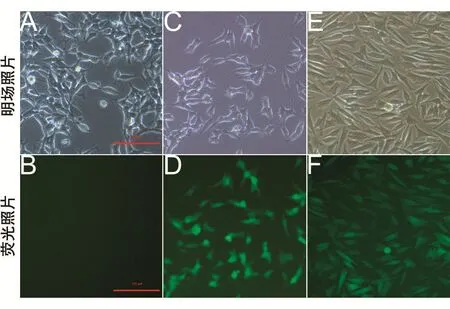
圖2 熒光檢測GFP-Parkin蛋白的穩定表達
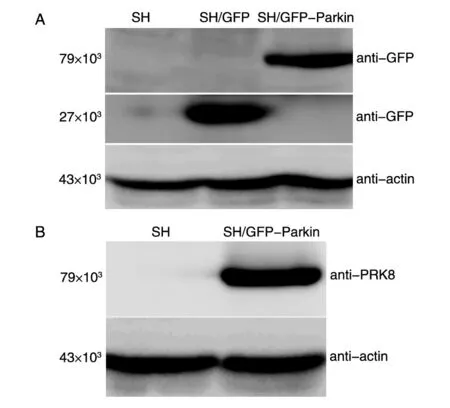
圖3 Western印跡檢測GFP-Parkin的表達
3 討論
Parkin蛋白的確切功能尚不明確,但已知其是一個E3泛素蛋白連接酶[19]。E3泛素蛋白連接酶是蛋白酶體降解系統的組成部分,主要功能是降解細胞內不需要的或錯誤折疊的蛋白質。
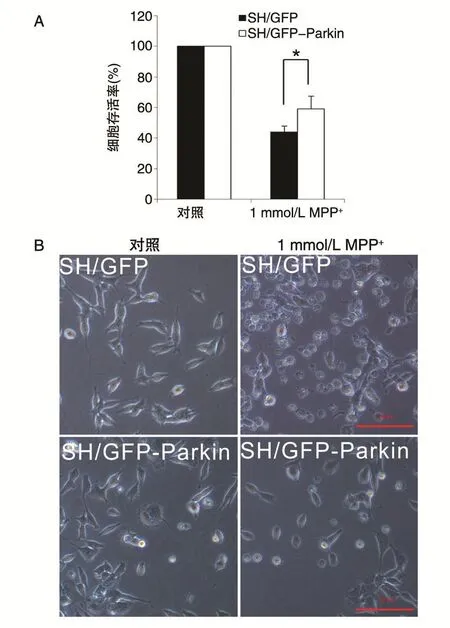
圖4 Parkin對MPP+損傷的保護作用
Parkin基因缺失和突變是ARJP發病的原因之一。Parkin保護多巴胺能細胞的機制并不十分清楚,目前一般認為Parkin通過對特定底物的降解來清除胞內異常折疊蛋白,對細胞起到保護作用[6]。Parkin具有多種多樣的重要功能。如可維持線粒體的完整性,調節線粒體的自噬過程[7];還可抑制內質網應激和自由基傷害導致的細胞死亡等[20]。另有研究顯示Parkin突變和黑色素瘤之間存在相關性[21]。Parkin過表達及Parkin轉基因動物顯示其對神經毒素MPTP和6-OHDA引起的多巴胺神經元損失,以及α-synuclein、A-beta對神經元的毒性具有明顯的保護作用[9-10,22-23]。本研究也發現穩定過表達Parkin可以保護MPP+對SHSY5Y細胞的毒性損傷。但Parkin可能還有更多功能未被發現。對Parkin進行深入研究,闡明其和PD病理之間的關系,將有助于提供新的藥物作用靶點,為PD的治療提供新的策略。
目前,對Parkin的研究主要采用瞬時轉染方式[17,24-25]。雖然瞬時轉染較為簡單,但成本高,需要大量質粒和轉染試劑,轉染效率偏低,并且基因表達不穩定,表達時間有限,不利于重復實驗和實驗結果比較。所以建立穩定表達Parkin蛋白的細胞系就顯得尤為重要,特別是在轉染效率較低的SH-SY5Y細胞中。
目的蛋白與綠色熒光蛋白的融合表達具有檢測方便、不須染色、對細胞無毒、利于研究目的蛋白的細胞內定位等優點[26]。目前Parkin在細胞內的亞細胞定位還存在爭議。
本研究構建了穩定表達融合蛋白GFP-Parkin的細胞系,這將有利于對Parkin細胞內亞細胞定位的進一步研究,尤其有利于蛋白在活細胞中的實時定位研究。目前已建立了穩定表達Parkin的PC12和SH-SY5Y細胞系[27-28],但其中Parkin并未融合GFP,不利于Parkin亞細胞定位的研究。而本研究構建的GFP-Parkin細胞系可實現對Parkin的可視化研究,這為今后觀察Parkin蛋白活細胞實時定位、細胞內的分布和轉運提供了理想的細胞系。
盡管對Parkin蛋白的研究已進行多年,但由于其功能多樣,因此很多功能機制尚不清楚,目前還處于初級階段。本研究建立了一個在基因組DNA中穩定整合pEGFP-Parkin的SH-SY5Y細胞系,在該細胞系中融合蛋白GFP-Parkin得到有效穩定表達,并初步證明Parkin可以減弱MPP+對SH-SY5Y細胞的損傷。該細胞系的建立為深入研究Parkin基因功能提供了較好的細胞模型。
[1] Kwakye G F,Mcminimy R A,Aschner M.Diseasetoxicant interactions in Parkinson's disease neuropathol?ogy[J].Neurochem Res,2017,42(6):1772-1786.
[2] Farrer M J.Genetics of Parkinson disease:paradigm shifts and future prospects[J].Nat Rev Genet,2006,7(4):306-318.
[3] Kitada T,Asakawa S,Hattori N,et al.Mutations in the parkin gene cause autosomalrecessive juvenile parkinsonism[J].Nature,1998,392(6676):605-608.
[4] Matsumine H,Yamamura Y,Hattori N,et al.A micro?deletion of D6S305 in a family of autosomal recessive juvenile Parkinsonism(PARK2)[J].Genomics,1998,49(1):143-146.
[5] Lücking C B,Dürr A,Bonifati V,et al.Association between early-onset Parkinson's disease and mutations in the parkin gene[J].N Engl J Med,2000,342(21):1560-1567.
[6] Xiong H,Wang D,Chen L,et al.Parkin,PINK1,and DJ-1 form a ubiquitin E3 ligase complex promot?ing unfolded protein degradation[J].J Clin Invest,2009,119(3):650-660.
[7] Skujat D.PINK1/Parkin-mediated mitophagy is depen?dent on VDAC1 and p62/SQSTM1[J].Nat Cell Biol,2010,12(2):119-131.
[8] Wang Y,Nartiss Y,Steipe B,et al.ROS-induced mi?tochondrial depolarization initiates PARK2/PARKIN-de?pendent mitochondrial degradation by autophagy[J].Au?tophagy,2012,8(10):1462-1476.
[9] Paterna J C,Leng A,Weber E,et al.DJ-1 and Par?kin modulate dopamine-dependent behavior and inhib?it MPTP-induced nigral dopamine neuron loss in mice[J].Mol Ther,2007,15(4):698-704.
[10]Vercammen L,Van der Perren A,Vaudano E,et al.Parkin protects against neurotoxicity in the 6-hydroxy?dopamine ratmodelforParkinson's disease[J].Mol Ther,2006,14(5):716-723.
[11]Zarate-Lagunes M,Gu W J,Blanchard V,et al.Par?kin immunoreactivity in the brain of human and nonhuman primates:an immunohistochemical analysis in normal conditions and in Parkinsonian syndromes[J].J Comp Neurol,2001,432(2):184.
[12]Shimura H,Hattori N,Kubo S,et al.Immunohisto?chemicaland subcellularlocalization ofParkin pro?tein:absence of protein in autosomal recessive juve?nile parkinsonism patients[J].Ann Neurol,1999,45(5):668-672.
[13]Stichel C C,Augustin M,Kühn K,et al.Parkin ex?pression in the adult mouse brain[J].Eur J Neurosci,2000,12(12):4181.
[14]Darios F,Corti O,Lücking C B,et al.Parkin pre?vents mitochondrial swelling and cytochrome c release in mitochondria-dependentcelldeath[J].Hum Mol Genet,2003,12(5):517-526.
[15]Kubo S I,Kitami T,Noda S,et al.Parkin is associat?ed with cellular vesicles[J].J Neurochem,2001,78(1):42-54.
[16]Koch A,Lehmann-Horn K,D?chsel J C,et al.Protea?somal inhibition reduces parkin mRNA in PC12 and SH-SY5Y cells[J].Parkinsonism Relat Disord,2009,15(3):220-225.
[17]Narendra D,Tanaka A,Suen D F,et al.Parkin is re?cruited selectively to impaired mitochondria and pro?motes their autophagy[J].J Cell Biol,2012,183(5):795-803.
[18]Joselin A P,Hewitt S J,Callaghan S M.ROS-depen?dent regulation of Parkin and DJ-1 localization dur?ingoxidativestressin neurons[J].Hum MolGenet,2012,21(22):4888-4903.
[19]Imai Y,Soda M,Takahashi R.Parkin suppresses un?folded protein stress-induced cell death through its E3 ubiquitin-protein ligase activity[J].J Biol Chem,2000;275(46):35661-35664.
[20]Wang H Q,Imai Y,Kataoka A,et al.Cell type-spe?cific upregulation of Parkin in response to ER stress[J].Antioxid Redox Signal,2007,9(5):533-542.
[21]Hu H H,Kannengiesser C,Lesage S,et al.PARKIN inactivation links Parkinson's disease to melanoma[J].J Natl Cancer Inst,2015,108(3).
[22]ShimuraH,SchlossmacherM G,HattoriN,etal.Ubiquitination of a new form of α-Synuclein by Par?kin from human brain:implications for Parkinson's dis?ease[J].Science,2001,293(5528):263-269.
[23]Burns M P,Zhang L,Rebeck G W,et al.Parkin pro?motes intracellular Abeta1-42 clearance[J].Hum Mol Genet,2009,18(17):3206-3216.
[24]Hou X O,Si J M,Ren H G,et al.Parkin represses 6-hydroxydopamine-induced apoptosisviastabilizing scaffold protein p62 in PC12 cells[J].Acta Pharmacol Sin,2015,36(11):1300-1307.
[25]Kuroda Y,Mitsui T,Kunishige M,et al.Parkin af?fects mitochondrial function and apoptosis in neuronal and myogenic cells[J].Biochem Biophys Res Commun,2006,348(3):787-793.
[26]Stepanenko O V,Verkhusha V V,Kuznetsova I M,et al.Fluorescent proteins as biomarkers and biosensors:throwing color lights on molecular and cellular process?es[J].Curr Protein Pept Sci,2008,9(4):338-369.
[27]楊卉,陳生弟,李彪,等.人野生型parkin基因真核表達載體的構建及其在PC12細胞中的表達[J].神經科學通報(英文版),2004,20(1):60-64.
[28]Jiang H,Ren Y,Zhao J,et al.Parkin protects human dopaminergic neuroblastoma cells against dopamine-in?duced apoptosis[J].Hum Mol Genet,2004,13(16):1745-1754.
EstablishmentofSH-SY5Y CellLineStablyExpressing GFP-Parkin and its Preliminary Function
ZHAO Hai-Zhou,MO Can-Kun,LIN Zhan-Le,LIU Wen-Hua*
School of Life Sciences,Zhaoqing University,Zhaoqing 526061,China
*Corresponding anthor,E-mail:wenhualiu@hotmail.com
Objective:To establish SH-SY5Y cell line stably expressing GFP-Parkin,and evaluate its protective effect against MPP+by MTT assay.Methods:The coding sequence of human Parkin was cloned into the vector pEGFP-C1 to construct recombinant plasmid pEGFP-Parkin.The pEGFP-Parkin plasmid was transfected into SHSY5Y cells using LipofectAMINE 3000,and positive-expression cells were screened by using G418.The expres?sion of GFP-Parkin was identified with fluorescent microscopy and Western blot.The protective effect of Parkin against MPP+in SH-SY5Y cells was detected by MTT assay.Results:The constructed pEGFP-Parkin plasmid was confirmed by restriction enzyme digestion and DNA sequencing analysis.Fluorescence photographs and West?ern blot data revealed that the SH-SY5Y cells expressed GFP-Parkin protein stably.MTT assay showed that sur?vival of Parkin group was 15%higher than that of control group after exposure to 1mmol/L MPP+for 48h(P<0.05),indicating that Parkin significantly enhanced cell survival.Conclusion:SH-SY5Y cell line stably express?ing GFP-Parkin has been established,laying a foundation for further investigating cytoprotective effects and other functional mechanisms of Parkin.
Parkin protein;SH-SY5Y cells;stable expression;MPP+
Q78;R741.02
A
1009-0002(2017)04-0429-06
2017-04-17
國家自然科學基金(31271124);廣東省教育廳重大項目(2014KZDXM075);廣東省教育廳創新團隊項目(2015KCXTD032);廣東省教育廳青年創新人才項目(2016KQNCX178)
趙海洲(1987- ),男,碩士,研究實習員,(E-mail)zhaohaizhou012@163.com
劉文華,(E-mail)wenhualiu@hotmail.com
10.3969/j.issn.1009-0002.2017.04.005

