基于NRPSs基因篩選與鑒定海蘆筍內生細菌
李代婧,殷躍,劉夢婕,衛婷,郭佳,辛志宏
(南京農業大學 食品科技學院,江蘇 南京,210095)
基于NRPSs基因篩選與鑒定海蘆筍內生細菌
李代婧,殷躍,劉夢婕,衛婷,郭佳,辛志宏*
(南京農業大學 食品科技學院,江蘇 南京,210095)
利用形態學觀察和分子生物學相結合的方法分離鑒定海蘆筍內生細菌,并篩選含有NRPS基因的菌株(nonribosomal peptide synthetase,NRPS),以期獲得能夠產生環肽化合物的菌株。研究結果表明,共從海蘆筍中分離到6株內生細菌Srtli-F1~Srtli-F6,分別鑒定為綠針假單胞菌橙黃亞種(Pseudomonaschlororaphissubsp.aurantiaca)、組氨酸節桿菌(Arthrobacterhistidinolovorans)、慶盛芽孢桿菌(Bacillusqingshengii)、類芽孢桿菌羽扇豆根瘤菌(Paenibacilluslupini)、假蕈狀芽孢桿菌(Bacilluspseudomycoides)、高山麝病原性阿爾伯蒂埃希氏桿菌(Escherichiaalbertii),其中菌株Srtli-F5檢測到含有NRPS基因,經系統發育樹分析,預測該菌株可能產生環肽類化合物,該株菌經過發酵,有機溶劑萃取發酵產物,并用電噴霧質譜ESI-MS (electrospray mass,ESI-MS)分析Srtli-F5能產生環肽化合物——桿菌肽,證實了該預測結果。該研究為定向篩選能夠產生環肽類化合物的菌種開拓了新思路。
內生細菌;分離鑒定;系統發育分析;非核糖體多肽合成酶;質譜;環肽
鹽生海蘆筍(SalicorniabigeloviiTorr),是通常生長在含鹽率高的湖泊及土壤附近[1]的綠色蔬菜,味道鮮美,質脆多汁。海蘆筍有莖無葉,不生蟲子,提示其組織內部或表面可能含有能產生抗菌活性物質的內生菌或附生菌[2]。目前,有關海蘆筍的研究大多集中在對其化學成分的分離鑒定及其生物活性研究方面,有關海蘆筍內生細菌的研究鮮有報道。
傳統的植物內生細菌的篩選方法多是采用活性篩選、化學篩選或二者的組合[3],這些方法過去在篩選可以產生活性次級代謝產物的菌株研究過程中非常有效,但在研究不斷深入的情況下,傳統方法的弊端也日益明顯:重復地發現已知的菌株和化合物,使得新菌株、新化合物的發現受阻,造成了時間和資源的極大浪費[4-5]。
近年來,隨著測序技術和生物信息學的快速發展,許多微生物的生物合成機制逐步解密,新的植物內生菌篩選方法應運而生。非核糖體肽類化合物合成酶(nonribosomal peptide synthetase,NRPS)是生物合成次級代謝產物過程中的多功能關鍵酶,由催化氨基酸之間肽鍵形成的縮合(condensation,C)結構域、負責底物識別和活化的腺苷酰化(adenylation,A)結構域、硫醇(thiolation,T)結構域以及 C 末端終止延伸反應的硫酯酶(thioesterase,TE)結構域組成[6]。其中 A 結構域有很強的保守性,可以通過PCR擴增該區域基因,并通過系統發育分析預測化合物的結構類型。因此,以NRPS功能基因為靶點,定向篩選含有環肽化合物的菌株,成為從“基因-合成酶系-環肽”的篩選新方法。
本實驗用采自新疆鹽湖的野生海蘆筍,采用平板劃線法分離純化培養得到內生細菌,提取其DNA,經PCR擴增16S rRNA目標序列后,建立系統發育進化樹。通過觀察菌落形態,并對菌株進行系統發育學分析,明確其種屬地位。在此基礎上,以NRPS(nonribosomal peptide synthetase)功能基因為指標,定向篩選含有NRPS基因的內生細菌,篩選到的菌株經發酵,ESI-MS(electrospray mass)分析發酵產物證實預測結果,以期為定向篩選能夠產生環肽化合物的菌株提供新的思路。
1 材料與方法
1.1實驗器材
鹽生海蘆筍,取自新疆鹽湖。
Microfuge 22R臺式微量冷凍離心機,美國Beckman公司;TP600型梯度PCR儀,日本TaKaRa公司;DYCP-31DN電泳儀,北京市六一儀器廠;JS-380C全自動數碼凝膠成像分析儀,上海培清科技有限公司。
D3350-01 E.Z.N.A細菌DNA微量提取試劑盒,美國Omega公司;Cat#DP1502多功能DNA純化回收試劑盒(進口離心柱型),南京華普生物科技有限公司。
本實驗主要采用如下培養基對細菌進行初步的分離培養:
細菌用培養基:牛肉膏蛋白胨培養基(1 L):牛肉膏5.0 g、蛋白胨10.0 g、NaCl 5.0 g、去離子水1 000 mL、瓊脂18 g,pH 7.2~7.4。
放線菌用培養基:高氏一號培養基(1 L)。可溶性淀粉20 g、KNO31.0 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、去離子水 1 000 mL、瓊脂18 g。
真菌用培養基:孟加拉紅培養基(1 L):葡萄糖10.0 g、1/3 000孟加拉紅水溶液 100 mL、蛋白胨5.0 g、KH2PO41.0 g、瓊脂20 g、MgSO4·7H2O 0.5 g、去離子水900 mL,氯霉素0.1 g。
1.2實驗步驟
1.2.1 內生細菌的分離純化
無菌條件下,先后將海蘆筍浸在75%酒精、質量分數為1%的NaClO溶液、75% 酒精中浸泡1 min,然后用無菌水清洗3次,用滅菌后的吸水紙除去表面的水分。用滅菌后的剪刀將其剪成7~9 mm小段,分別放在上述3種培養基上,每板3~5段,其中牛肉膏蛋白胨培養基、高氏一號培養基于37 ℃恒溫培養2 d至莖末端長出菌落,孟加拉紅培養基于30 ℃恒溫培養5 d直到莖末端長出菌落。用劃線分離的方法純化培養得到單菌落。
1.2.2 形態學觀察
將長有細菌菌落的平板,置于37 ℃培養2 d,觀察菌落的形態特征。
1.2.3 細菌DNA的提取
按照生產廠家提供的試劑盒說明書進行。
1.2.4 16SrRNA基因片段的PCR擴增
16S區域的擴增選擇細菌16S rRNA的通用擴增引物16S(F)(5’-AGAGTTTGATCCTGGCTCAG-3’)/16S(R)(5’-GGTTACCTTGTTACGACTT-3’),PCR反應條件為:94 ℃預變性3 min,94 ℃變性30 s,45 ℃退火1 min,72 ℃延伸1 min 40 s,共35個循環,最后72 ℃延伸7 min[7]。PCR擴增反應采用25 μL的反應體系,包括ddH2O 9.5 μL、2×TaqMaster Mix 12.5 μL、10 μmol/L Primer 16S(F) 1 μL、10 μmol/L Primer 16S(R) 1 μL、模板DNA 1 μL。使用1%瓊脂糖凝膠電泳檢測PCR擴增產物,4 ℃保存備用。
1.2.5 NRPS基因片段的PCR擴增
NRPS基因片段的擴增選擇的引物為NP1(5’-CCTAATTCAATACGAAAACCACGAADYTTNAYYTG-3’)/NP2(5’-TGTATGTTATTTATACTTCTGGTTCTACTGGTMRNCCANARGG-3’),PCR反應條件為:94 ℃預變性5 min,94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸1 min,共35個循環,最后72 ℃延伸10 min。PCR擴增反應采用25 μL的反應體系,包括ddH2O 9.5 μL、2×TaqMaster Mix 12.5 μL、10 μmol/L Primer NP1 1 μL、10 μmol/L Primer NP2 1 μL、模板DNA 1 μL。使用1%瓊脂糖凝膠電泳檢測PCR擴增產物,4 ℃保存備用。
1.2.6 PCR產物的回收和克隆
按照生產廠家提供的試劑盒說明書進行。
1.2.7 序列測定與系統發育學分析
將含有目的DNA序列的菌液交由上海美吉生物有限公司進行測序。獲得序列后,通過Ezbiocloud(http://eztaxon-e.ezbiocloud.net/)網站與所有已發表的典型菌株進行序列相似性分析,下載與供試菌株序列同源性相近的菌株序列,利用MEGA 6.0軟件NJ(neighbor joining)方法構建系統發育樹,自展數:1 000。
1.2.8 質譜測定方法
將篩選得到的含有NRPS基因的菌株發酵7 d,丙酮提取發酵產物,經旋轉蒸發器濃縮,過濾,進樣分析。質譜參數:電噴霧離子源(ESI),離子源溫度500 ℃,氣簾氣25.0 psi,噴霧電壓5 500.0 V,離子源氣1∶55.0 psi,離子源氣2∶50.0 psi。
2 結果與分析
2.1菌落形態特征
挑取平板上長出的菌落,在對應的培養基平板上劃線分離純化,得到單個菌落,進行形態學觀察。結果如圖1所示。
高氏一號培養基平板劃線純化后得到3個純的菌株Srtli-F1、Srtli-F2和Srtli-F4。Srtli-F1菌落較小而且扁平,呈淺黃色,在光照下顯現出熒光,邊緣規則,半透明,菌落濕潤易挑起。菌株Srtli-F2的菌落呈黃色,大而隆起,黏稠,不透明,邊緣不規則。菌株Srtli-F4為白色大菌落,微凸,邊緣規則,半透明,濕潤易被挑起。
經過孟加拉紅培養基平板劃線純化后僅得到1個純的菌株Srtli-F3。Srtli-F3菌落大且呈圓紅色,微微凸起,黏稠,不透明。
經牛肉膏蛋白胨培養基平板劃線純化后得到2個純的菌株Srtli-F5和Srtli-F6。Srtli-F5菌落微小,呈白色圓點狀,邊緣光滑,微微凸起、干燥、不透明,菌株Srtli-F6的菌落呈白色圓形,小而扁平,表面半透明,邊緣光滑。
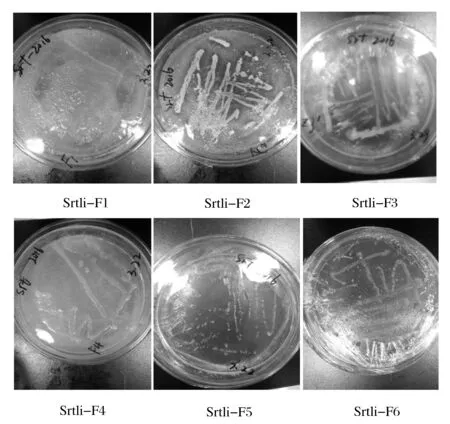
圖1 內生細菌Srtli-F1~Srtli-F6的菌落形態特征Fig.1 The morphological characters of Srtli-F1-Srtli-F6
2.2系統發育學分析
經過PCR擴增、切膠回收測序,獲得了菌株Srtli-F1~Srtli-F6的16S rDNA,序列長度均在1 500 bp左右。將菌株Srtli-F1的16S rDNA序列在EzTaxon數據庫中進行同源性搜索,選取并下載同源性較高的模式菌種16S rDNA序列,利用MEGA 6.0軟件構建系統發育樹,如圖2所示。從圖2可見,與外組Aztobacterarmeniacus(AB175655)相比,同一屬的菌株聚為一個大類,不同種的菌株聚在不同的分枝。菌株Srtli-F1與Pseudomonaschlororaphissubsp.aurantiacaT(DQ682655)聚為一枝,自展值為94,親緣關系極其相近,可鑒定為該種。以相同的方法構建系統發育樹對其他菌種進行鑒定。發現菌株Srtli-F2與ArthrobacterhistidinolovoransT(X83406)聚為一支,自展值為98(圖3),菌株Srtli-F3與BacillusqingshengiiT(JX293295)聚為一支,自展值99(圖4),菌株Srtli-F4與PaenibacilluslupiniT(KF769449)聚為一支,自展值100(圖5),菌株Srtli-F5與BacilluspseudomycoidesT(ACMX01000133)聚為一支,自展值87(圖6),菌株Srtli-F6與EscherichiaalbertiiT(ABKX01000030)聚為一支,自展值95(圖7)。綜上所述,將菌株Srtli-F1~Srtli-F6分別鑒定為綠針假單胞菌橙黃亞種P.chlororaphissubsp.aurantiaca、組氨酸節桿菌A.histidinolovorans、慶盛芽孢桿菌B.qingshengii、類芽孢桿菌羽扇豆根瘤菌P.lupini、假蕈狀芽孢桿菌B.pseudomycoides、高山麝病原性阿爾伯蒂埃希氏桿菌E.albertii。
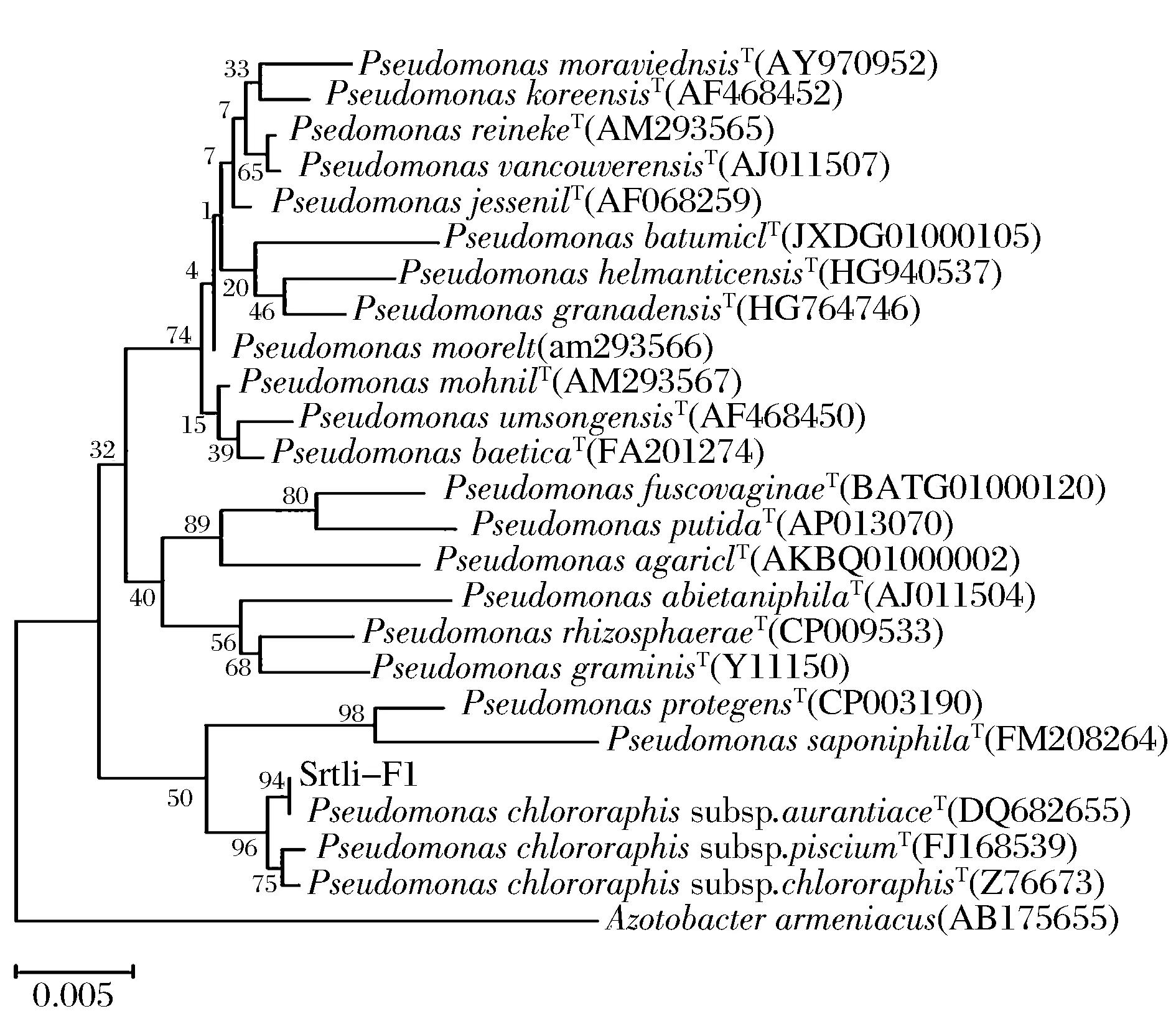
圖2 菌株Srtli-F1的系統發育進化樹(基于16S rDNA 基因序列)Fig.2 Phylogenetic tree of strain Srtli-F1 based on 16S rDNA gene sequence
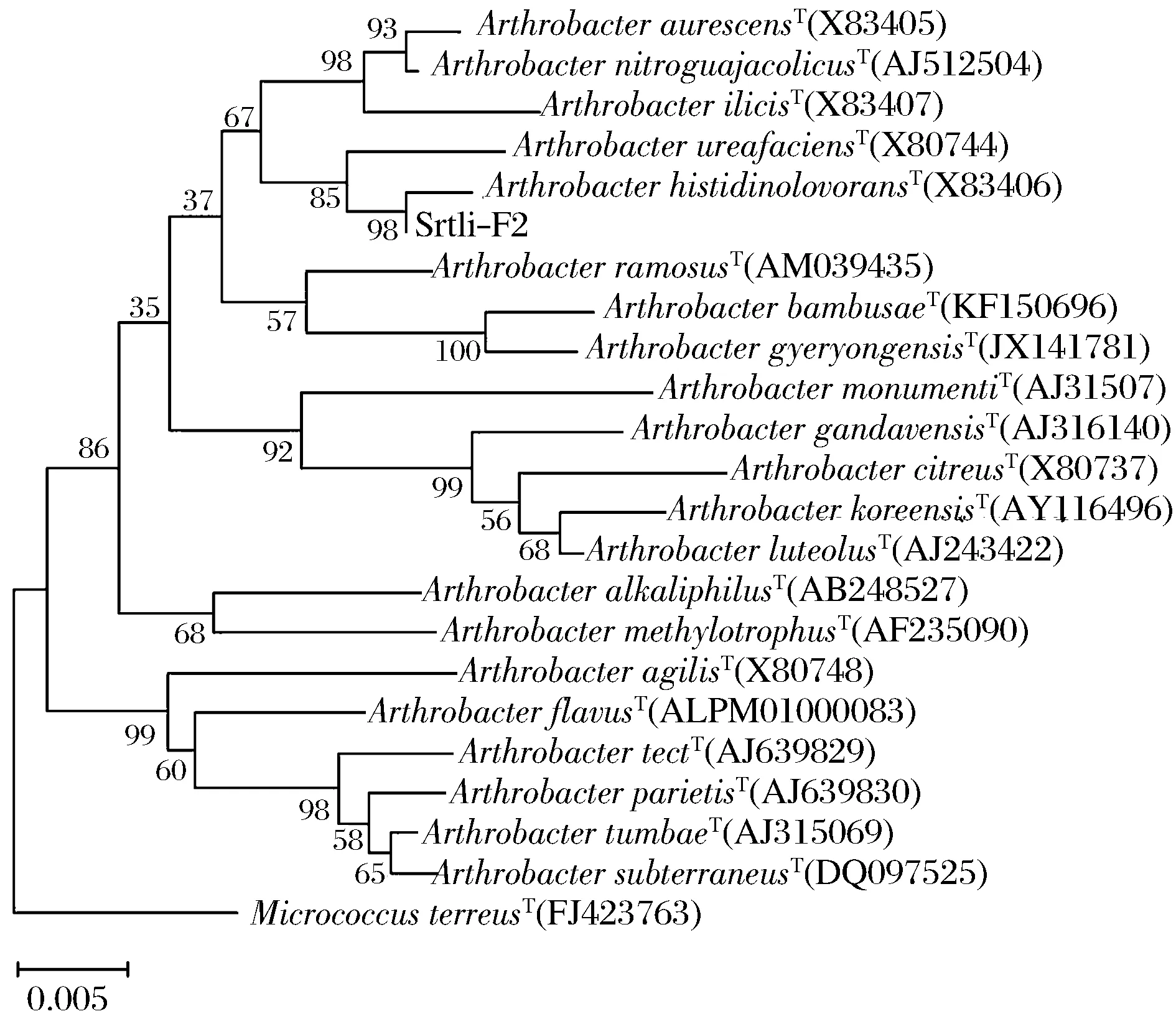
圖3 菌株Srtli-F2的系統發育進化樹(基于16S rDNA 基因序列)Fig.3 Phylogenetic tree of strain Srtli-F2 based on 16S rDNA gene sequence
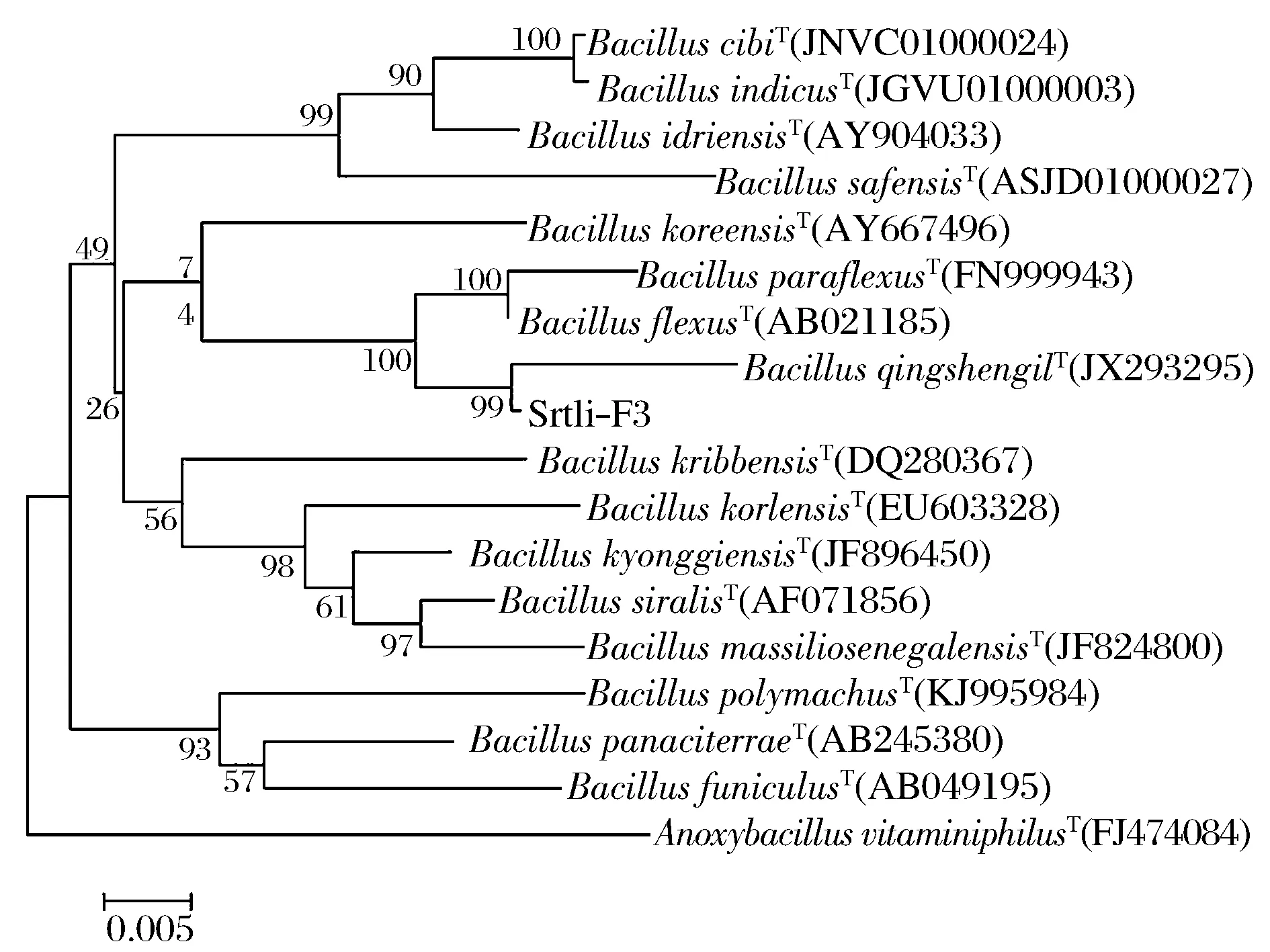
圖4 菌株Srtli-F3的系統發育進化樹(基于16S rDNA 基因序列)Fig.4 Phylogenetic tree of strain Srtli-F3 based on 16S rDNA gene sequence
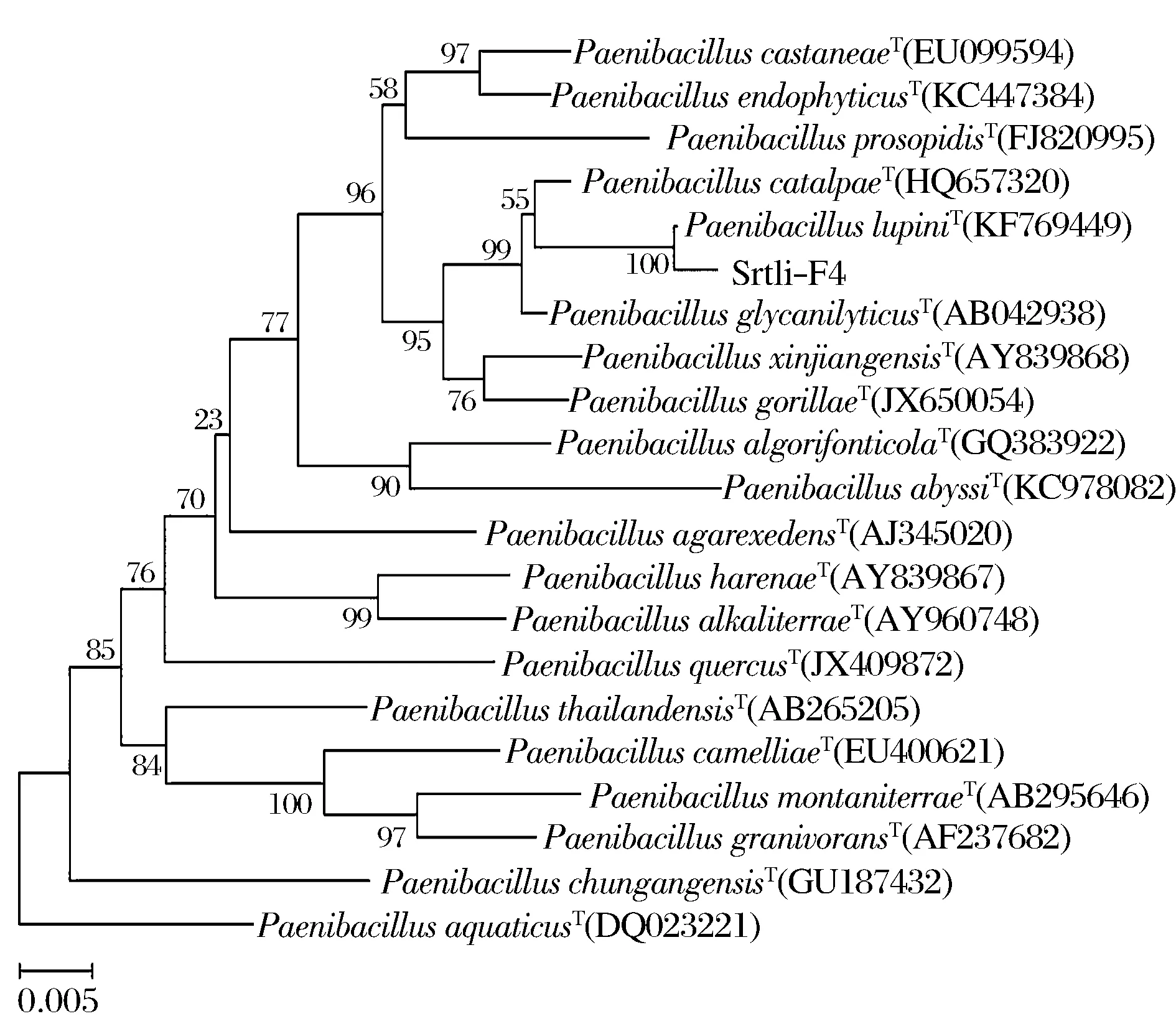
圖5 菌株Srtli-F4的系統發育進化樹(基于16S rDNA 基因序列)Fig.5 Phylogenetic tree of strain Srtli-F4 based on 16S rDNA gene sequence
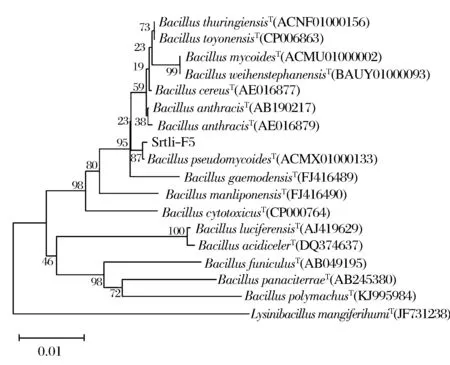
圖6 菌株Srtli-F5的系統發育進化樹(基于16S rDNA 基因序列)Fig.6 Phylogenetic tree of strain Srtli-F5 based on 16S rDNA gene sequence
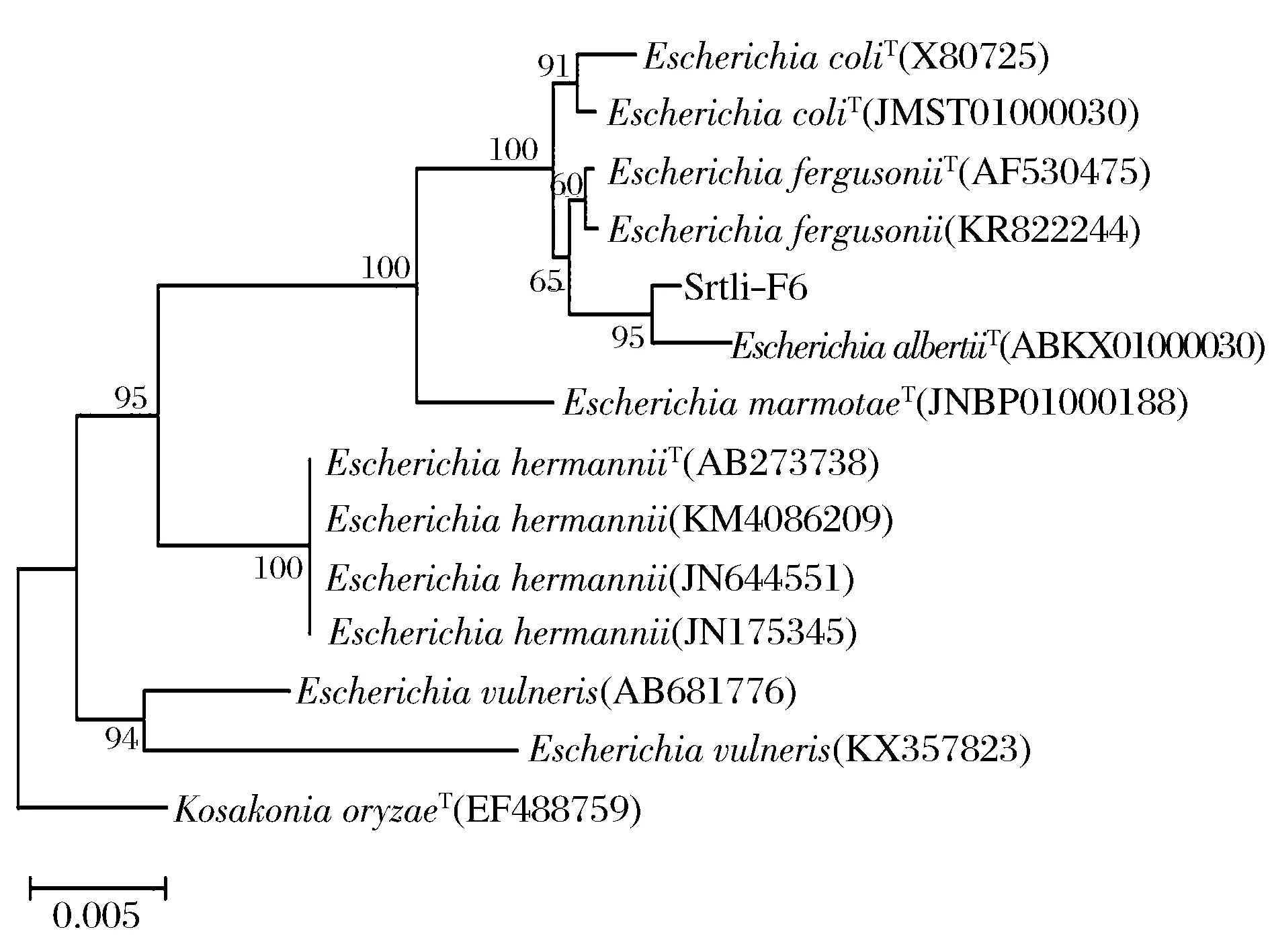
圖7 菌株Srtli-F6的系統發育進化樹(基于16S rDNA 基因序列)Fig.7 Phylogenetic tree of strain Srtli-F6 based on 16S rDNA gene sequence
2.3NRPS功能基因篩選與系統發育學分析
在確定6株內生細菌分類地位的基礎上,分別PCR擴增菌株Srtli-F1~Srtli-F6的NRPS功能基因,并對NRPS基因進行克隆測序。結果表明菌株Srtli-F3和Srtli-F5含有目的基因片段,片段大小均為780bp,利用NCBI Orf finder(Open Reading Frame Finder)將核酸序列轉化為蛋白序列,下載同源性較高的蛋白序列,用MEGA6.0軟件構建系統發育樹,分別如圖8和圖9所示。由圖可見,種屬相同的不同菌株聚為一支,提示可能產生相同類型的化合物,如Brevibacillusparabrevis(Q70LM6)和Brevibacillusparabrevis(Q70LM7)都能產生桿菌肽(Bacitracin),而不同的菌種也可聚為一支,提示也能產生相同的化合物,如Aneurinibacillusmigulanus(P0C063)和Brevibacillusbrevis(P0C064) 都能產生化合物Gramicicin。菌株Srtli-F3和Srtli-F5在2個進化樹中均與B.licheniformis(O68008)聚為一枝,自展值分別為40和44,表明菌株Srtli-F5和Srtli-F3可能產生環肽類抗生素——桿菌肽(Bacitracin)。

圖8 菌株Srtli-F3的系統發育進化樹(基于NRPS基因序列)Fig.8 Phylogenetic tree of strain Srtli-F3 based on NRPS gene sequence

圖9 菌株Srtli-F5的系統發育進化樹(基于NRPS基因序列)Fig.9 Phylogenetic tree of strain Srtli-F5 based on NRPS gene sequence
2.4菌株發酵產物的質譜分析
將分離得到的菌株發酵7 d,丙酮提取發酵產物,經旋轉蒸發器濃縮后,過濾,進行ESI-MS分析。結果分別如圖10所示。由圖10(A)可知,菌株Srtli-F5的粗提物在陽離子ESI-MS模式下在m/z1 102.7、m/z1 103.7、m/z1 104.7處產生碎片離子峰,由圖10(B)可知,菌株Srtli-F5的粗提物在陰離子ESI-MS 模式下在m/z1 034.6、m/z1 035.6、m/z1 036.6處產生碎片離子峰,為桿菌肽化合物的特征分子離子質量,因此推測Srtli-F5可產生桿菌肽類物質。然而,菌株Srtli-F3的發酵產物經ESI-MS分析并沒有出現環肽化合物特征離子峰,這可能是該菌株中含有的NRPS基因是沉默的,在實驗室條件下無法表達環肽[8]。

圖10 菌株Srtli-F5發酵產物質譜圖Fig.10 Mass spectrum diagram about the fermentation products of Srtli-F5
3 討論
研究表明,微生物能否產生有價值化合物是由其功能基因決定的[9]。因此,通過靶向擴增生物合成次級代謝產物過程中的多功能關鍵酶——NRPS,實現產環肽菌株的定向篩選,不僅減少了資源的浪費,也大大提高了篩選效率。本研究項目從海蘆筍中分離出6株內生細菌Srtli-F1~Srtli-F6,利用PCR擴增這6個菌的16S rDNA目標序列,接著通過系統發育樹分析與形態學觀察,將其分別鑒定為綠針假單胞菌橙黃亞種P.chlororaphissubsp.aurantiaca、組氨酸節桿菌A.histidinolovorans、慶盛芽孢桿菌B.qingshengii、類芽孢桿菌羽扇豆根瘤菌P.lupini、假蕈狀芽孢桿菌B.pseudomycoides、高山麝病原性阿爾伯蒂埃希氏桿菌E.albertii。基于NRPS型功能基因對這6個菌株進行篩選,發現其中編號為Srtli-F3和Srtli-F5的菌株含有NRPS基因,提示可能產生環肽類化合物,對這2個菌種分別進行發酵,利用ESI-MS分析發酵產物,發現Srtli-F5能夠產生桿菌肽,而Srtli-F3發酵產物沒有出現環肽類化合物分子離子峰,提示在實驗室條件下,產生環肽類化合物的NRPS基因可能是沉默的而無法表達。
桿菌肽,是一種環肽類化合物。因為這種多肽來源于地衣芽孢桿菌的發酵產物,所以被稱為“桿菌肽”[10]。桿菌肽是一種廣譜抗菌素[11],能夠抑制動物腸道中的許多有害菌,起到防治動物腸道疾病的效果,保證了飼料的充分利用,有利于動物生長。與傳統抗生素相比,這種抗生素安全性高、殘留少,不產生抗藥性、毒副作用弱[12],是飼料添加劑中傳統抗生素的有效替代品,已被廣泛應用在國內外動物養殖和飼料生產中[13-14],也被作為生物學的研究工具應用于生物表面活性劑、飼料添加劑、食品防腐劑研究中[15]。因此,發現能夠產生桿菌肽的微生物,對于拓寬獲得桿菌肽的途徑,具有重要的實際應用價值。本研究首次從海蘆筍中分離鑒定到假蕈狀芽孢桿菌,今后將對其發酵產物進行深入研究,研究其除產生環肽桿菌肽外,是否能夠產生其他環肽,驗證同一微生物產生多種環肽的能力。
[1] 冉火苗,孔望君,蔣會芳,等.鹽生海蘆筍抗菌內生細菌的篩選與鑒定[J].食品與發酵工業,2016,42(3):79-86.
[2] 陸東和,張慜,蔡金龍,等.海蘆筍營養價值及其采后品質變化[J].食品工業科技,2010,31(6):303-305.
[3] 朱鵬.珍珠膜海綿共附生微生物PKS與NRPS的篩選與模塊結構研究[D].杭州:浙江大學,2008.
[4] MOORE B S,Biosynthesis of marine natural products:microorganisms (Part A)[J].NATURAL PRODUCT REPORTS,2005,22(5):580-593.
[5] 文艷蘋.基于PKS、NRPS基因的抗生素paenimacrolidin和嗜鐵素paenibactin研究[D].杭州:浙江大學,2011.
[6] LANGE A,SUN H,PILGERJ,et al.Predicting the structure of cyclic lipopeptides by Bioinformatics:structure revision of Arthrofactin[J].CHEMBIOCHEM,2012,13(18):2 671-2 675.
[7] 劉怡君,潘沐,王明洋,等.海蘆筍內生真菌基于PKSⅠ型功能基因的分離與鑒定[J].食品科學,2014(11):115-119.
[8] K YAMANAKA,KA REYNOLDS,RD KERSTEN,et al.Direct cloning and refactoring of a silent lipopeptide biosynthetic gene cluster yields the antibiotic taromycin A[J].Proceedings of the National Academy of Sciences,2014,111(5):1 957-1 962.
[9] 周培瑾,徐毅,馬允卿,等.極端嗜鹽菌 16S rDNA的PCR擴增[J].微生物學報,1994,24(1):6-8.
[10] 胡尚勤.桿菌肽高產的代謝調控[J].國外醫藥(抗生素分冊),2004(4):160-162.
[11] 周巖民,王龍昌.桿菌肽產品在動物飼料中的應用研究進展[J].飼料工業,2012(18):1-5.
[12] 陳吉紅,龐玉紅,郭榮富.桿菌肽鋅在畜禽中的應用及其安全性評價[J].中國飼料,2004(9):28-29.
[13] RAVINDRAN V,THOMAS D V,THOMAS D G,et al.Performance and welfare of broilers as affected by stocking density and zinc bacitracin supplementation[J].Animal Science Journal,2006,77(1):110-116.
[14] 周臣飛,李俊輝,季朝金.桿菌肽類飼料添加劑在畜禽養殖中的應用[J].中國動物保健,2011(12):8-11.
[15] 周欣,李寶庫.桿菌肽的研究進展及應用[J].科技信息,2010(14):92-93.
ScreeningandidentificationofendophyticbacteriafromSalicorniabigelovii.TorrbasedonaNRPSfunctionalgeneassay
LI Dai-jing,YIN Yue,LIU Meng-jie,WEI Ting,GUO Jia,XIN Zhi-hong1*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
In the current research, endophytic bacteria were isolated fromSalicorniabigelovii.Torr and characterized by morphological observation and molecular methods, and the NRPS gene was screened to obtain the strains that could produce cyclic peptide compounds. The results showed that six endophytic bacteria were isolated and identified asPseudomonaschlororaphissubsp.Aurantiaca,Arthrobacterhistidinolovorans,Bacillusqingshengii,Paenibacilluslupini,Bacilluspseudomycoides,Escherichiaalbertii, respectively. Among them, the strain Srtli-F5 contained NRPS genes and was predicted to have capability of producing cyclopeptide compounds by phylogenetic tree analysis. It was further confirmed by the detection of fermentation production using ESI-MS (electrospray mass, ESI-MS) that the strain really produced bacitracin. The study provides a new method for directional screening strains with the potential to produce cyclic peptide compounds.
endophytic bacillus; isolation and identification; phylogenetic analysis; nonribosomal peptide synthetase; mass spectrum;cyclopeptide
10.13995/j.cnki.11-1802/ts.014643
本科生(辛志宏教授為通訊作者,E-mail:xzhfood@njau.edu.cn)。
2017年農產品質量安全風險評估項目(GJFP201701102);2016年南京農業大學大學生創新訓練計劃(SRT)項目(1618C01)
2017-04-27,改回日期:2017-05-17

